Method Article
上顎第二大臼歯のナイロン結紮による進行性歯周炎のマウスモデル
要約
この研究では、マウスで歯周炎を誘発するための修正された6-0ナイロンライゲーション法について説明しており、再現性が高く、研究者が歯周病の発生から病理学的結果までを研究するための代替手段を表しています。
要約
歯周病(PD)は、歯の支持組織に影響を与える炎症性疾患であり、世界中で最も蔓延している疾患の1つです。その重症型である歯周炎は、軟部組織、歯、骨の破壊につながります。歯周炎の動物モデルは、霊長類、イヌ、ミニブタ、マウスを用いて開発されています。これらの中で、結紮糸誘導マウスモデルは、ヒト歯周炎の主要な側面を効果的に再現しながら、疾患の急速な進行、再現性、予測可能性、低コストなどの利点を提供します。合字を用いたマウスモデルは、歯周組織の微生物学的および免疫学的微小環境に関する貴重な洞察を提供し、免疫応答におけるバイオフィルムの重要な役割と全身性疾患との関連を強調しています。この研究では、マウスの歯周炎を誘発するための修正ナイロンライゲーション法を紹介します。この変更には、シルク縫合糸の代わりにナイロン縫合糸を使用し、接触点を通過させるのではなく、近位間接触領域の下に配置することが含まれます。このアプローチは、歯周炎を効果的に誘発しながら、技術を簡素化します。縫合糸留置の詳細な方法論がグラフィカルに示されており、歯周炎の進行は組織学的および組織測定学的分析を通じて示されています。
概要
歯周病(PD)は、歯の支持組織の炎症性疾患であり、世界で最も蔓延している疾患の1つです1。PDの発生率は、世界中で20%〜50%の範囲であると報告されています2。PDにはさまざまな進行の程度があります。歯肉炎と呼ばれる軽度の形態は軟組織のみに影響を及ぼし、歯周炎(PT)と呼ばれるその重度の形態は骨3などの硬組織に影響を及ぼします。PTは炎症性疾患であるため、糖尿病5、心血管疾患6、有害な妊娠結果7や子癇前症などのホルモン相互作用8、炎症性疾患9、さらには眼の変化10や認知症11など、疾患のプロセス4を変える可能性のあるいくつかの危険因子によって修飾できる複雑な免疫応答と見なさなければなりません。
したがって、PTの発症または有病率に関連する病因を理解し、新しいまたはより効果的な治療戦略をテストするため、または全身性疾患とPTまたは歯周微生物叢との間の相関関係を特定するには、動物モデルが必要です12。
効果的な研究方法を選択することは、PTの発症を理解し、研究の質問に適切に答えるために重要です13。長年にわたり、PTの研究のためにさまざまな動物モデルが開発されてきました。ただし、霊長類、犬、ウサギ、ミニチュアブタなどのモデルは、14,15,16を使用するのに高価で複雑です。PTのマウスモデル、特にライゲーション誘導PTモデルには、迅速な開発、再現性、予測可能性、低コストなど、多くの利点があります17,18,19。
PTの誘導には、経口細菌接種、リポ多糖類注射、結紮糸誘導10,20など、いくつかの方法が用いられているが、それぞれに長所と短所がある17、ナイロン結紮糸によって誘導されたPTのマウスモデルは、その開発のためのヒトのメカニズムに類似していた20,21,22,23.PTは、常在する微生物叢の保持を通じて発生し、炎症を引き起こし、組織の喪失につながります。さらに、マウスは、PTの研究のために異なる細胞集団または目的の分子を研究するために遺伝子組み換えすることができます。
歯科用結紮は、歯列矯正用ワイヤー、シルク縫合糸24、25、またはナイロン縫合糸26などの異なる材料を使用して行うことができる。マウスのライゲーションによってPTを誘導するための最も一般的な材料は絹です。この方法論は、Marchesan et al.18、Abe et al.27、Chadwick et al.22など、それぞれ独自の変更を加えたさまざまな著者によって説明されており、これらの方法はすべて、いくつかの研究者によって成功裏に使用されてきました28。ただし、マウスの上臼歯の周りに絹糸を縫合するのは複雑になる可能性があります。Marchesan et al. は、「結紮ホルダー」の使用を提案しました。Abe et al. と Chadwick et al. は、縫合糸を接触点に通して配置しましたが、Chadwick et al. は大臼歯 M1 と M2 の周りに縫合糸を配置しました。
異なる厚さのナイロン縫合糸は、異なる動物モデル29,30,31のPT開発に使用されてきた。Lima et al.31 は 5-0 ナイロン縫合糸を使用しました。以前の研究では、6-0 ナイロン縫合糸を使用し、同様の結果が得られました 28。
マルチフィラメント縫合糸と比較して、ナイロン縫合糸は非吸収性のモノフィラメント合成であり、炎症性組織反応が低い32;さらに、ナイロン縫合糸はまた、微生物の蓄積33,34を許容し、フソバクテリウム核とポルフィロモナ中間体35,36の接着の証拠があり、ナイロン縫合糸12,14,17,19,24,27,35,37の通性嫌気性細菌も付着している (表1)。
これらの特性により、炎症反応は主に物質の蓄積ではなく細菌の蓄積に集中することができるかもしれません。さらに、ナイロンはシルク38よりも引張強度などの機械的特性が優れています。
そこで、本研究では、M2付近の歯間接触領域の下に6-0ナイロン縫合糸を配置したことで、マウスに進行期の歯周炎の発症を誘発した。このアプローチにより、通常のピンセットで結紮糸を配置でき、結果は一貫しています。30日後、PTの進行は組織学的および組織学的分析によって確認することができます。
プロトコル
実験動物に関するすべての手続きは、メキシコの公式規格NOM-062-ZOO-1999に準じた「実験動物に関する生物医学研究のための倫理的枠組み」に厳格に準拠して実施されました。この研究は、プロトコル CE/FESI/072024/1765 に基づいて、Facultad de Estudios Superiores Iztacala (FES-Iztacala) の倫理委員会によって承認されました。マウスは、FES-Iztacala動物施設の病原体のない環境で、餌と水に自由にアクセスできる動物室に収容されました。このプロトコルは、Abeら27によって以前に記載された方法の修正である。6週齢から8週齢の雌BALB/cマウス(体重16g)を対照群(CTL)群と歯周炎群(PT)に分けた。歯周炎は、0日目に6-0ナイロン縫合糸を留置することで誘発され、持続的な細菌の付着を促進し、重篤な慢性疾患の進行を引き起こしました。30日後、すべてのマウスを安楽死させ(施設で承認されたプロトコルに従って)、組織学的分析を通じて組織の損傷と付着喪失(AL)を評価しました(図1)。使用した試薬や機器の詳細は 、資料表に記載されています。
1.麻酔の準備
- キシラジンとケタミン(1:10)を注射用水(ストック)で希釈して調製します。4°Cで保存し、4週間以内にご使用ください。
- 各マウスを識別して体重を量ります。インスリン注射器を使用して、筋肉内適用用のキシラジン(1 mg / kg)とケタミン(2 mg / kg)の重量ベースの用量を準備します。.
- 麻酔薬溶液の総投与量の50%を後肢に注入します。.反対側で手順を繰り返します。
- マウスを深い箱(10cm³)に入れ、約3〜5分かけて眠りにつくまで待ちます。
- マウスが完全に目を覚まし、正常にまばたきできるようになるまで、15分ごとに各目にヒプロメロースドロップを塗布することにより、麻酔による目の乾燥と角膜の損傷を防ぎます。
注:マウスは、麻酔のおおよその時間である45分間観察下に置かなければなりません。手順が完了する前にマウスがウェイクアップした場合は、手順を一時停止し、マウスを交換する必要があります。
2.動物のポジショニング
- マウスがスリープ状態になったら、頭をオペレーターに向けて上を向いて作業台に置きます。各脚を緊張せずにそっと引っ張り、マイクロポアテープで固定して、突然の不随意運動を防ぎます。マウスを毛布またはガーゼで覆い、体温を維持します。
- 鼻を開いたままにするには、歯列矯正ゴムの一方の端を上顎切歯の周りに置き、もう一方の端を張力をかけずに上部ホルダーに固定します。下切歯の周りに2つ目の歯列矯正ゴムを置き、輪ゴムで下ホルダーに固定します。
- チークセパレーターを配置し、見やすくするために舌を慎重に片側に動かします。
- 上顎大臼歯が十分に可視化されるように顕微鏡を配置し、最も低い倍率の対物レンズから始めます。位置を特定したら、倍率を調整して、オペレーターの最適な快適性と集中力を確保します。
3. 合字の配置
- 画像が鮮明になったら、3つの上顎大臼歯(最大近位大臼歯(M1)、次の大臼歯(M2)、最小遠位大臼歯(M3)を特定します。6-0ナイロン縫合糸は、その直径が結紮糸の配置を容易にし、幅の広い縫合糸よりも組織への機械的損傷が少ないため、留置します。
- M2の遠位側の位置を特定し、ピンセットで6-0ナイロン縫合糸の先端を保持し、口蓋から乳頭の基部に先端を置きます。近位口蓋間腔の基部から頬面に向かって軽い圧力をかけます(図2A)。
- 6-0ナイロン縫合糸が交差したら、近位間腔を通って頬側に向かって引っ張ります(図2B)。
- 6-0ナイロン縫合糸の先端を、頬側からM2の近心面の近位部の基部に配置します。縫合糸の先端をそっと押して近位間腔の下に横切り、頬側腔を通って口蓋に戻します(図2C)。
- 6-0ナイロン縫合糸を優しく引っ張り、先端をピンセットで保持し、M2周りに調整し、3つの簡単な結び目で縫合糸を固定します。
- 6-0ナイロン縫合糸を細いハサミでカットします(図2D)。
4. 動物の回復
- マウスを離すには、チークセパレーター、脚のマイクロポアテープ、および歯列矯正ゴムを取り外します。まず、下顎の切歯の周りのゴムを外し、次に上顎の切歯の周りのゴムを外します。
- マウスを作業台から取り外し、ガーゼまたは布で包み、上向きに置きます。舌を横に動かして気道を開いたままにし、閉塞を防ぎます。
- 動物を暖かく保ち、布またはガーゼで覆い、完全に目が覚めるまで観察します。次に、それらを通常のケージに入れます。
- マウスが正常に点滅できるようになるまで、各目にヒプロメロース滴を塗ります。
- 動物を標準的な状態に保ちます。
5. 合字チェック
- ナイロン結紮糸の耐久性を毎週確認してください(図3A、B)。
- マウスを取り、頭と体をしっかりと持ち、ピンセットを使用して鼻を開きます。ランプの光の下でM2の周りの6-0ナイロン縫合糸を観察します。
- バイオフィルムの蓄積と機械的刺激に基づく歯周病の発症を確立する。これを組織学的解析で確認します。
6.組織学
- 30日後、マウスをCO2 チャンバーで安楽死させます(施設で承認されたプロトコルに従って)。以前に報告されたように上顎を収穫します39。回収した組織を0.9% NaCl溶液で洗浄し、新しい標識マイクロ遠心チューブに入れます。
- サンプルを4%パラホルムアルデヒド溶液に2時間攪拌しながら固定します。
- サンプルを水道水で2時間洗浄します。
- 骨からミネラルを除去し、高品質のパラフィン切片を調製するには、マイクロ遠心チューブで20日間4%EDTA(pH 7.3)溶液の20容量でサンプルを脱灰し、4日ごとにEDTAを交換します40。
- サンプルをパラフィンに埋め込みます。M2領域の5μm切片を切断し、ヘマトキシリンとエオシン(H&E)41で染色します。
7. データ分析
- 染色された組織切片を光学顕微鏡で観察し、溝上皮、歯肉線維、歯周線維、高さ、および歯槽稜の完全性の形状の変化の記述的分析を行います。
- セメントエナメル接合部(CEJ)と骨稜の最高点との間の距離を測定することにより、付着損失(AL)を決定します。デジタル編集プログラムを使用して、これら2つの点の間に線を引きます。Semenoff et al.42 で説明されている方法論に従って、頬側および口蓋側表面の組織測定分析を実行します (図 4)。
8. 統計分析
- CTLグループとPTグループから得られたデータを、Mann-Whitney U検定を用いて解析します。 p < 0.05 を統計的に有意であると考えます。分析には、統計およびグラフ作成ソフトウェアを使用します。
結果
この方法論により、誘導マウスは2週目以降に歯周炎(PT)を発症することができます。マウスを毎週監視して、結紮糸の存在を確認しました。安楽死は30日目に行われました。すべてのグループの臨床的特徴が評価されました。対照群は、色や辺縁歯肉の構造などの正常な特性を経時的に維持しました。CTL群と比較して、PT群の組織には炎症、出血、歯周ポケット形成が認められ、これらは誘導マウスの歯肉縁部に認められました(図5)。
この疾患の進行は、両群のM2の歯周組織のALの組織学的および組織測定学的分析を行うことによって確認されました。CTLグループは、健康な組織と類似した組織学的特徴を示しました:辺縁および溝歯肉の上皮、歯肉線維(図6A、CTL青矢印)、接合部上皮、および歯槽稜(図6A、CTL緑矢印)。結合組織繊維は正常な位置と高さにありました。シャーピーの繊維は、歯槽骨と根セメント質に挿入されたときに無傷でした。また、根の周りの対称的な厚さ(図6A、CTLオレンジ色の矢印)が、特に頬側と口蓋の両方の図のアタッチメントで観察されました。歯周靭帯(PDL)線維の細胞核、結合組織、および歯槽骨の骨細胞がはっきりと見えました(40倍)。PT群では、歯周組織は深刻な損傷を示し、歯周ポケットの存在、歯槽稜の喪失(図6A、PT、緑の矢印)、上皮の頂端移動、および根の表面でのシャーピー線維の剥離(図6A、PT、オレンジ色の矢印)を特徴とする。結合組織では、頬側と口蓋側の歯肉と骨に細胞核が欠けていましたが(図6A、PT、青矢印)、これらはすべて歯周病の特徴です。
組織測定解析により、CTL群では、骨稜の位置が頬側と口蓋側の両側で一定であることが明らかになりました。また、CTL群と比較して、PT群は組織欠損により頬面のAL深さが有意に増加した(p =0.0001、117.5nm±6 対209.17nm±10)。CTL群と比較して、PT群の口蓋表面積は有意に大きかった(p = 0.03、175.25 nm ± 8 対 254.03 nm ± 50)。両側で組織の破壊が見られましたが、それは頬面よりも口蓋面でより明白で、深さが深く、付着損失が大きかった(図6B、C)。これらの知見は、以前に発表した同様の挙動を示した結果と一致している28。
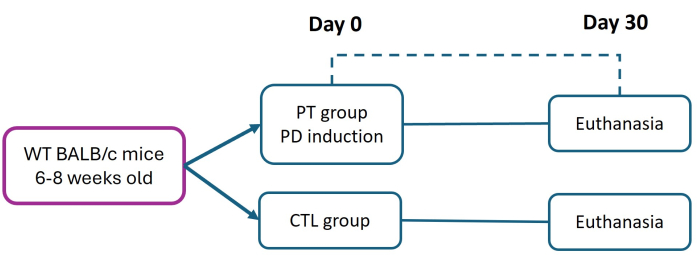
図1:実験計画。 歯周炎(PT)は、6-0ナイロン結紮糸モデル(0日目)を使用して、6〜8週齢のBALB / cマウス(16 g)に誘発されました。導入後30日で、PTおよび健康な(CTL)マウスを歯周組織の評価のために安楽死させました。3つの独立した実験が行われました。CTL群とPT群の両方のマウスの総数はn = 9でした。 この図の拡大版を表示するには、ここをクリックしてください。

図2:歯周炎を誘発するための結紮糸留置の段階的な手順。 マウスの第二上臼歯で歯周炎を誘発するために使用される一連のステップの代表的な画像:(A)6-0ナイロン縫合糸が口蓋から頬側まで、M2の遠位に挿入される方法を示しています。(B)接触領域の下で圧力を穏やかに加える方法を示しています。(C)ナイロン縫合糸が口蓋から頬側まで、M2の近心部分をどのように通過するかを示しています。(D)は、ナイロン縫合糸がM2を中心に調整され、トリプルノットで固定されて結紮糸として機能する方法を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
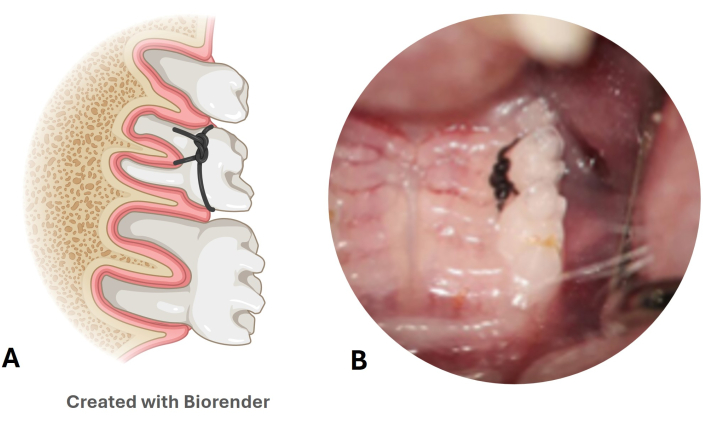
図3:ナイロン結紮糸歯周病モデル(A)上顎第2大臼歯における結紮糸の位置の図。(B)マウスモデルに装着したナイロン結紮糸の画像。この図の拡大版を表示するには、ここをクリックしてください。

図4:組織測定分析。 付着損失 (AL) は、セメントエナメル接合部 (CEJ) と歯槽稜の最も近い点との間の距離を考慮して決定され、頬側と口蓋面の両方の点の間に線を引きました。参考:V(B):頬側、P口蓋。倍率:10倍。スケールバー = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。

図5:WTマウスにおける歯周炎の臨床徴候の発症。 歯周組織の代表的な臨床像、CTLコントロール;PT、ナイロン 6-0 縫合糸の留置後 1 日目の歯周病。抜糸後30日目。3つの独立した実験の代表的な画像を実行しました。CTL群とPT群の両方のマウスの総数はn = 9でした。 この図の拡大版を表示するには、ここをクリックしてください。

図6:ナイロン誘発性歯周炎モデルでは、歯周組織は付着喪失と組織損傷を示した。 (A)歯周組織のH&E染色による代表的な組織学的画像、コントロール(CTL)。歯周炎(PT)、左パネル10x、組織測定分析が示され、セメントエナメル接合部(CEJ)から歯槽稜の端までの線で示され、頬側(B)、口蓋(P)、青色のボックス頬側赤のボックス口蓋で示されている。右のパネルは頬側と口蓋型で、40倍の倍率で拡大されています。青い矢印、結合組織;オレンジ色の矢印、根状セメントへの歯周靭帯の挿入。緑の矢印、骨の紋章。スケールバー = 100 μm. (B, C) CEJと歯槽稜の最高点の組織測定分析。3つの独立した実験の代表的な画像を実行しました。CTL群とPT群の両方のマウスの総数はn = 9でした。データはSEM±平均として表され、*p < 0.05および****p < 0.0001の値は、Mann-Whitney U検定に従って統計的に有意であると見なされました。 この図の拡大版を表示するには、ここをクリックしてください。
| 材料 | 誘導 | 利点 | 欠点 |
| 絹 | 近位間空間を通過する | 高い細菌付着性 | 挿入するにはスキルが必要です |
| マルチフィラメント縫合糸 | 簡単に破れる | ||
| 自然起源 | 結紮糸の損失 | ||
| 歯列矯正用ワイヤー | 歯間領域への挿入 | 配置が簡単 | 組織の損傷を避けるために慎重に挿入する必要があります |
| 耐性 | |||
| ナイロン | 接点の下に挿入 | 配置が簡単 | 倍率が必要です |
| 材料による組織の損傷はありません | 結び目はずれることができる | ||
| 耐性と柔軟性 | |||
| 歯周病菌の付着 |
表1:マウスの結紮糸によって歯周病を誘発するために使用されるさまざまな材料。
ディスカッション
歯周炎のいくつかの動物モデルは、微生物学的応答や免疫応答などのさまざまな側面を評価するために使用されており、ヒトの疾患といくつかの類似点があります43。これらの知見は、バイオフィルムの役割、免疫応答、全身疾患との相互作用など、歯周病の枠組みの証拠を提供する44,45。
歯周炎の動物モデルには、さまざまな複雑さと類似点があります。例えば、ヒト以外の霊長類、イヌ、またはミニブタは、ヒトの歯周病に最も類似している19が、それらを取り扱い維持するための費用と必要条件がこれらのモデルを非現実的にしている。さらに、歯周炎のマウスモデルは安価で扱いやすいです。さらに、マウスは、目的の特定の分子または細胞を生成するために遺伝子改変することができ46、その方法論は十分に確立されている47。
マウスは自然にPTを発症しませんが、さまざまな方法論によって誘発される可能性があります。最も一般的に使用されるモデルは、合字誘起モデルであり、歯列矯正ワイヤー、シルク、ナイロンなど、いくつかの材料が使用されているため、再現性が高い22,23。
特に、ナイロンはPTを誘発するための実行可能な選択肢であり得る;その特性のいくつかのために、合成モノフィラメントとして、それは最小限の組織応答を有し、Fusobacterium nucleatumおよびPorphyromona intermedia35,36のような歯周細菌の接着を可能にする。これにより、炎症反応が「正常な」細菌の蓄積につながる可能性があります。
この研究では、誘導モデルとして6-0ナイロン縫合糸を使用してPTを発症する代替案を提案し、CTLマウスとPTマウスの臨床および組織学的データを分析しました。PT群に存在する歯肉縁の特徴(出血、炎症、歯周ポケット形成など)を特定しました。これらの観察結果は、組織測定分析によって裏付けられました。特に、PT損失の程度は有意に異なっていました。頬側と口蓋側の両方の表面は組織の破壊を示しましたが、口蓋表面では大きかった。これはおそらく、マウスの方がヒトよりも頬側壁が広いためでしょう。
Limaら31 は、ナイロン結紮糸がPTを誘発することを報告しました。5-0縫合糸を使用しましたが、結び目を頬面に置き、15日後に 6 マイクロCTで直系骨量減少を測定しました。6-0ナイロン縫合糸を使用しましたが、結び目を口蓋面に配置し、30日後に組織測定分析を行い、重度のPTを誘発しました。その結果、M2の周囲に6-0のナイロン縫合糸がPTをもたらしたことが明らかになりました。 Libermanらは、骨量減少を評価するために使用された方法の間に差がないと報告しました48。
これらの結果は、提案されたモデルが再現性があり、いくつかの利点があることを示しています。まず、スレッダーを使用するのと似ているため、使いやすいです。したがって、必ずしも縫合糸を近位間腔に押し出すわけではなく、スペースが限られているためにマウスの口腔が損傷するリスクが高まります。第二に、このモデルは、自然な方法でバイオフィルムの蓄積を通じてPTの発症を可能にし、歯周組織に慢性炎症を誘発します。
このモデルには、学習曲線、視覚教材の必要性、顕微鏡や虫眼鏡の使用に関連する課題など、いくつかの制限があります。さらに、結び目や結紮糸を失う可能性が存在するため、刺激刺激が継続的に存在するためには、結紮糸の永続性を確認することが不可欠です。
要約すると、このプロトコルは、6-0ナイロン縫合糸によって誘発される高度なPTの堅牢なモデルを確立するために必要な手順を説明しています。また、麻酔薬の投与、倍率、および愛着喪失の評価の方法論についても詳しく説明します。さらに、このモデルは、PTによる炎症性骨量減少に関与する宿主特異的なメカニズム、および感染性、腫瘍性、自己免疫性、またはホルモン起源の疾患または障害の発症におけるPTの役割を調査するために使用できます。したがって、このモデルを使用してバイオフィルムの蓄積と炎症によって引き起こされるPTを研究することは、治療上の意味を持つ基本的な知識を生み出し、診断を改善する可能性があります。
開示事項
著者らは、この論文の出版に関して利益相反がないことを宣言します。
謝辞
この研究は、メキシコ科学技術評議会(COMECYT)の助成金番号[FICDTEM-2021-072]および研究プロジェクトと技術革新のための支援プログラム(PAPIIT)-UNAM、助成金番号[IN-217021]によって部分的に資金提供されました。このビデオの制作に役立った施設については、Endoperiodontología、FES Iztacala、UNAMの専門プログラム、およびこのビデオの制作に協力してくれたRosalba Yañez Ortiz(DDS)に感謝します。一部のフィギュアはBiorenderプログラム(契約番号ME282NWCI1)で作成されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
参考文献
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved