Détermination de la loi de vitesse et de l'ordre de la réaction
Vue d'ensemble
Source : Laboratoire du Dr Neal Abrams — SUNY College of Environmental Science and Forestry
Toutes les réactions chimiques ont un taux spécifique définissant l’état d’avancement des réactifs va aux produits. Ce taux peut être influencé par la température, concentration et les propriétés physiques des réactifs. Le tarif comprend également les intermédiaires et les États de transition qui sont forment, mais ne sont ni le réactif ni le produit. La Loi de vitesse qui définit le rôle de chacun des réactifs dans une réaction et peut être utilisée pour modéliser mathématiquement le temps nécessaire à une réaction de procéder. La forme générale d’une équation de taux est illustrée ci-dessous :
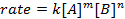
où A et B sont les concentrations des différentes espèces moléculaires, m et n est des ordres de réaction, et k est la constante de vitesse. La vitesse de presque chaque réaction change au fil du temps comme réactifs sont épuisés, rendant les collisions efficaces moins susceptibles de se produire. La constante de vitesse, toutefois, est fixée pour une seule réaction à une température donnée. L’ordre de la réaction illustre le nombre d’espèces moléculaires impliquées dans une réaction. Il est très important de connaître la Loi de vitesse, y compris les taux constants et réaction commande, qui ne peut être déterminée expérimentalement. Dans cette expérience, nous découvrir une méthode de détermination de la Loi de vitesse et il permet de comprendre l’état d’avancement d’une réaction chimique.
Procédure
1. préparation H2O2 Dilutions
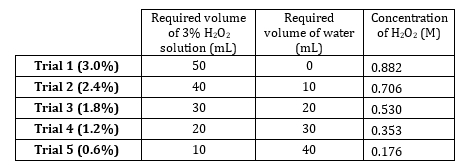
- Peroxyde d’hydrogène 3 % stock a une concentration de dilutions de préparer 5 M. 0,882 allant de 0,882 M à 0,176 M (tableau 1). Préparer ces solutions volumétriquement, mais préparer additivement puisque le soluté est très dilué et volumes d’eau sont additifs.
- Placer les solutions dans un bain d’eau de température constante, ou les laisser sur le comptoir s’équilibrer à température ambiante. Une gamme de température de 20 à 25 ° C
Résultats
Oxygène Evolution Data et vitesses initiales
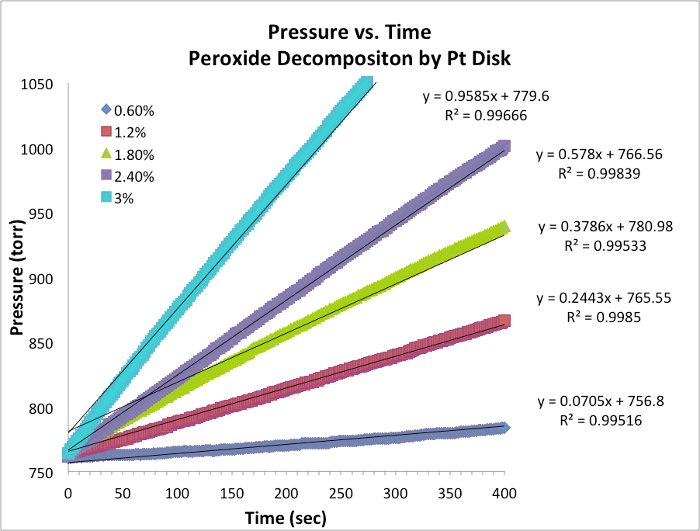
Figure 1. Pression vs chronologiques pour chaque essai à température constante. La pente est équivalente à la vitesse instantanée de la réaction.
Ordre de réaction
- Données pour cinq essais et graphique avec pente sont tab...
Applications et Résumé
Alors que la détermination des variables de droit taux peut être impliqué mathématiquement, les méthodes sont en fait assez simples. Tant que la disparition d’un réactif ou l’apparence d’un produit peut être mesurée, parcelles de taux permet de calculer la constante de vitesse. Une extension de cette méthode est fréquemment utilisée pour déterminer l’énergie d’activation d’une réaction, Eun, en mesurant le taux et calcul de la constante de vitesse à différentes températures. Cette ...
References
- Method adapted from Vetter, T. A., Colombo, D. P. Jr. Kinetics of Platinum-Catalyzed Decomposition of Hydrogen Peroxide, J. Chem. Ed. 80 (7), 788-798 (2003).
- David R. Lide, ed. CRC Handbook of Chemistry and Physics. Boca Raton, Florida: CRC Press (2005).
Passer à...
Vidéos de cette collection:

Now Playing
Détermination de la loi de vitesse et de l'ordre de la réaction
General Chemistry
196.2K Vues

Présentation et utilisation de la verrerie de laboratoire courante
General Chemistry
657.4K Vues

Solutions et Concentrations
General Chemistry
274.7K Vues

Déterminer la densité d'un solide et d'un liquide
General Chemistry
556.5K Vues

Déterminer la concentration massique d'une solution aqueuse
General Chemistry
383.7K Vues

Déterminer la formule empirique
General Chemistry
183.0K Vues

Détermination des règles de solubilité des composés ioniques
General Chemistry
141.5K Vues

Utiliser un pH-mètre
General Chemistry
346.6K Vues

Introduction au titrage
General Chemistry
425.1K Vues

Loi des gaz parfaits
General Chemistry
78.6K Vues

Détermination spectrophotométrique d'une constante d'équilibre
General Chemistry
158.6K Vues

Principe de Le Châtelier
General Chemistry
265.7K Vues

Identification d'un composé inconnu grâce à la loi de la cryométrie
General Chemistry
160.7K Vues

Utilisation de la calorimétrie différentielle à balayage pour mesurer les changements d'enthalpie
General Chemistry
44.5K Vues

Complexes de coordination
General Chemistry
91.6K Vues
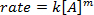 . Prenant le logarithme népérien (ln) de l’équation produit une équation linéaire
. Prenant le logarithme népérien (ln) de l’équation produit une équation linéaire 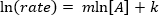 , où m, la pente, est de l’ordre de la réaction.
, où m, la pente, est de l’ordre de la réaction.