Method Article
Fluorescence Recovery After Photobleaching (FRAP) der Fluoreszenz-markierten Proteine in dendritischen Dornen von hippokampalen Neuronen
In diesem Artikel
Zusammenfassung
FRAP wurde verwendet, um die Mobilität von grün fluoreszierendes Protein (GFP)-markierter Proteine in kultivierten Zellen zu quantifizieren. Wir untersuchten die mobile / immobile Fraktionen der GFP durch die Analyse der Fluoreszenz-Recovery-Anteil nach Ausbleichen. In dieser Studie wurde FRAP am Rücken von Hippocampus-Neuronen durchgeführt.
Zusammenfassung
FRAP wurde verwendet, um die Mobilität von GFP-markierten Proteine zu quantifizieren. Mit einer starken Anregung Laser wird die Fluoreszenz einer GFP-markierten Proteins in der Region von Interesse gebleicht. Die Fluoreszenz der Region erholt, wenn die ungebleichten GFP-markierten Proteins von außerhalb der Region diffundiert in die Region von Interesse. Die Mobilität der Protein wird dann durch Messung der Fluoreszenz Recovery Rate analysiert. Diese Technik könnte verwendet werden, um Protein-Mobilität und Fluktuation zu charakterisieren.
In dieser Studie, drücken wir die (Enhanced Green Fluorescent Protein) EGFP-Vektor in kultivierten Hippocampus-Neuronen. Mit dem Zeiss 710 konfokalen Mikroskop, photobleach wir das Fluoreszenzsignal des GFP-Protein in einem einzigen Wirbelsäule, und dann nehmen Zeitreihen-Aufnahmen der Fluoreszenz recovery after photobleaching aufzunehmen. Schließlich schätzen wir den Anteil der mobilen und immobilen Fraktionen der GFP in Stacheln, durch die Analyse der Bilddaten mit ImageJ und Graphpad Software.
Das FRAP-Protokoll zeigt, wie eine grundlegende FRAP-Experiment und wie die Daten zu analysieren durchzuführen.
Protokoll
1. Neuron Transfektion
- Kultur Embryonaltag 18 (E18) Ratte Neuronen im Hippocampus auf Poly-D-Lysin-beschichtete MatTek 35-mm-Glas-bottom Gerichte 1. Am 16-18 Tage in vitro (DIV), transfizieren Neuronen mit dem Clontech CalPhos Mammalian Transfektion Kit. Zunächst ersetzen das Kulturmedium mit 1,5 ml Dulbecco Modified Eagle Medium (DMEM) pro 35-mm-Schale 0,5 Stunden vor der Transfektion. Heben Sie die Originalverpackung Kulturmedium in ein steriles 15 ml Tube für später (Schritt 1.6) zu verwenden.
- Mix 10 pg pEGFP-N1-Plasmid-DNA mit sterilem H 2 O (Clontech) und 12,4 ul 2 M Calcium-Lösung (Clontech) auf ein Gesamtvolumen von 100 ul.
- Fügen Sie die Mischung aus Schritt 1,2) auf 100 ul 2 × HBS tropfenweise unter Vortexen 2 × HBS bei mittlerer Geschwindigkeit.
- Lassen Sie die Mischung bei Raumtemperatur stehen lassen für 20 Minuten und fügen Sie dann die endgültige Mischung aus Schritt 1,3) in DMEM inkubiert Neuronen.
- Legen Sie die Neuronen wieder in die 37 ° C Inkubator für 1-1,5 Stunden.
- Entfernen Sie den Calcium-Phosphat-haltigem Medium, dann waschen Sie die Zellen mit DMEM dreimal. Vor der Rückkehr der Kulturschale in den Inkubator, den Austausch der DMEM-Medium mit dem ursprünglichen Kulturmedium.
2. FRAP-Experiment auf einer Wirbelsäule
- Neuronen sind für die FRAP-Experiment zwei vor vier Tage nach der Transfektion verwendet.
- Ersetzen Sie das Kulturmedium aus dem 35-mm-Glas-bottom Gericht, indem sie unverzüglich das Hinzufügen vorgewärmten Tyrode-Lösung, die (in mM) enthält NaCl 145, KCl 5, HEPES 10, Glucose 10, Glycin 0,005, CaCl 2 2,6 und MgCl 2 1.3 (pH-Wert auf 7,4 mit NaOH).
- Ein Zeiss LSM 710 konfokalen Mikroskop ist für die FRAP-Experiment verwendet. Die Zeiss TempModul System wird verwendet, um die Temperatur (37 ° C), die Feuchtigkeit und die CO 2 (5%) der arbeitenden System zu steuern. Stellen Sie sicher, dass die CO 2-Tank angeschlossen ist und die Wasserflasche, die für den Ausgleich Luftfeuchtigkeit verwendet wird, wird mit Wasser gefüllt.
- Finden Sie eine transfizierte reife Dendriten mit dem 100 × Objektiv (αplan-APOCHROMAT 100 × / 1.46 Öl). Wenn die transfizierten Zellen in der Schale sind spärlich, Suche nach einem gewünschten Zelle mit dem 40 × Objektiv (Plan-NEOFLUAR 40 × / 1,3 Öl), und wechseln Sie dann auf die 100 × Ziel, Bilder zu fassen.
- Verwenden Sie 5-fachem optischem Zoom und einem 256 × 256 Pixel Auflösung auf Bild ein kurzes Stück Dendriten mit mehreren Stacheln. Um Bilder aufzunehmen, nutzen Nenndrehzahl 9 (Pixelverweilzeit 3,15 us), die 0,5 Sekunden, um einen Scan fertig bringt. Die Lochkamera ist 2 um gesetzt zu starke Fluoreszenz zu erhalten. Bei der Aufnahme Bilder, versuchen, niedrige Laserdurchstrahlschweißen verwenden, z. B. 1-5%, um zu verhindern Ausbleichen das gesamte Bild.
- Wählen Sie die Wirbelsäule von Interesse. In unserem Experiment, wählen wir Pilz Stacheln mit ihrer Wirbelsäule Kopf Durchmesser von ~ 1 um.
- So führen Sie eine FRAP Experiments, 5 Steuer Bilder vor dem Bleichen, dann bleichen die Wirbelsäule von Interesse 10 Mal bei nominal 100% Laserdurchstrahlschweißen [Der Argon-Laser Leistung 30 mW, mit 50% (15 mW) in der 488 Laserlinie und etwa 3-4 mW erreicht das Mikroskop durch die 488 Laserlinie] und dann erfassen eine Reihe von Bildern sofort nach dem Bleichen. Für dieses Experiment werden die Bilder jede 1 Sekunde für 15 Sekunden nach dem Bleichen eingefangen. Die Zeitspanne sollte nach verschiedenen Targeting-Proteine und verschiedene experimentelle Designs (Abb. 1) eingestellt werden.
- Speichern von Bildern.
3. Datenanalyse
- Öffnen von Bildern mit ImageJ-Software.
- Richten Sie den Stapel von Bildern mit dem Ausrichten-Werkzeug ('plugins' → 'Stacks - Mischen' → 'align Scheiben im Stapel' → 'Übersetzung' und / oder "starrer Körper ') in ImageJ, so dass die Wirbelsäule des Interesses nicht schwimmen , in anderen Worten - es bleibt in der gleichen Position auf dem Bild.
- Messen die relative Fluoreszenzintensität der Wirbelsäule von Interesse (F s), eine transfizierte aber ungebleicht Region (Kontrolle), und einen Hintergrund-Region (F b) in Zeitreihen mit Hilfe der 'Intensität v Time Monitor "-Tool von ImageJ (' plugins '→' Stacks - Mischen '→' Intensity v Time Monitor "). Die Steuerung Region könnte ein Stück gut fokussierte distalen Dendriten werden. Der Hintergrund Region ist ein nicht-fluoreszierendes Region.
- Berechnen Sie den Bleichen (r) durch einen Vergleich der Fluoreszenz der Kontrolle Region vor (F c0) und nach (F c) Bleichen.
r = F c / F c0. - Normalisieren der Fluoreszenz-Intensität des Ziels der Wirbelsäule (F) wie folgt:
F = (F s - F b) / r. - Kurvenanpassung der Fluoreszenz-Intensität des Ziels der Wirbelsäule mit einer Ein-Phasen-exponentiellen Gleichung Graphpad Prism-Software (Abb. 2) oder other eine vergleichbare Software.
- Berechnen Sie die mobile Fraktion (f m) und die immobile Fraktion (f i) durch die folgenden Gleichungen:
f m = F ∞ / F 0,
wo F ∞ ist die Fluoreszenz-Intensität nach vollständiger Genesung, und F 0 ist die Fluoreszenz-Intensität vor Ausbleichen.
f i = 1 - f m.
4. Repräsentative Ergebnisse:
In dieser Studie führen wir eine FRAP-Experiment auf reifen Neuronen im Hippocampus. Bei 18-22 DIV, sind Pilz Stacheln bereits gebildet. Mit unserer Methode können die dynamischen Veränderungen der Fluoreszenzintensität in einer kleinen Region, wie eine Wirbelsäule, aufgezeichnet werden.
Zur Analyse der Fluoreszenz-Recovery-Prozess von EGFP, nehmen wir 5 Bilder als Kontrollen vor dem Bleichen und dann 1 Bild alle 1 Sekunden unmittelbar nach dem Bleaching für 15 Sekunden. Die Auflösung des Bildes ausreichend ist für die quantitative Analyse. Die Fluoreszenz-Recovery-Profile getaggt Fluoreszenz-Proteine sind in hohem Maße reproduzierbar.
Wir haben auch kurz zeigen, wie die mobile und immobile Fraktionen eines Fluoreszenz-Protein, mit ImageJ und Graphpad Prism-Software zu definieren. Die FRAP-Methode und Analyse zeigen wir hier lassen sich grob in den Neurowissenschaften, Zellbiologie und anderen Studien verwendet werden.

Abbildung 1. FRAP Messungen der EGFP-Fluoreszenz in einem Rückgrat aus einem kultivierten Hippocampus-Neuronen. Die roten Pfeile zeigen den Zeitpunkt der Bleichen. Fotos repräsentieren die gleiche Fläche vor (Pre) und bei 0, 1, 5, 10, 15 Sekunden nach Bleichen. Die Region der Wirbelsäule, Steuer-und Hintergrund werden mit Buchstaben S, C und B, jeweils markiert. Neuronen wurden bei 37 ° C während des Experiments aufrechterhalten. Scale-bar, 1 um.
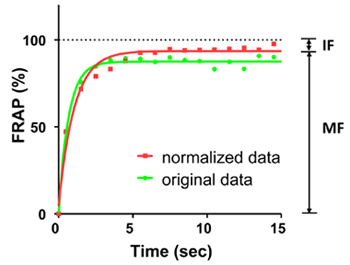
Abbildung 2. FRAP-Kurven von EGFP-Fluoreszenz über einen 15-Sekunden-Periode. Die grüne Linie zeigt die ursprüngliche Kurve, die rote Linie zeigt die normierte Kurve. Die Punkte auf Kurven zeigen die FRAP alle 1 Sekunde. Die Kurven wurden durch eine Phase exponentiellen Gleichungen ausgestattet. Die durchschnittliche Fluoreszenz vor Ausbleichen wurde als 100% gezählt. In diesem Experiment ist die mobile Fraktion (MF) 94% und die immobile Fraktion (IF) beträgt 6%.
Diskussion
FRAP-Analyse wurde im Großen und Ganzen in vivo und in vitro 1-2 Studien verwendet. Diese Technik allgemein verwendet GFP Fusionsproteine , obwohl es auch könnte Rotalge Fusion Proteinen 3. Diese Analyse ist empfindlich und kann verwendet werden, um die Mobilität von GFP-markierten Proteine zu charakterisieren.
Um zu aussagekräftigen FRAP-Analyse ist es wichtig, unnötige photobleaching vor und während der FRAP-Experiment zu vermeiden. Es gibt zwei Möglichkeiten, dies zu erreichen. Zunächst sollte das Verfahren zu suchen und zu beobachten, die experimentelle Neuron schnell sein. Besonders die Beobachtung von Neuronen mit einem 100x-Objektiv für eine lange Zeit deutlich bleicht die Fluoreszenz. Zweitens hoher Laserleistung und häufiges Scannen oft die Möglichkeit erhöhen Ausbleichen. Daher wird es notwendig sein, die photobleaching Rate in einer Kontrollregion berechnen und dann normalisieren die FRAP-Kurve in der experimentellen Region. Die Normalisierung der Methode wurde in das Protokoll beschrieben worden (siehe Schritt 3,3-3,5 für Details).
Das Ausbleichen der Schritt ist auch entscheidend für eine gute FRAP Ergebnisse. In diesem Experiment, Bleichmittel wir die Wirbelsäule von Interesse 10-mal bei 100% Laser-Übertragung. Diese Bedingung ist hinreichend zum Bleichen der Fluoreszenz einer Wirbelsäule in den Hintergrund Ebene in eine feste Zubereitung. So setzen wir die Fluoreszenz-Intensität auf die gleiche Anzahl als Hintergrund bei 0 Sekunden nach dem Bleichen. Abhängig von der Geschwindigkeit des ersten Zyklus könnte eine erhebliche Menge an Fluoreszenz Erholung bereits erkannt, wenn das Protein von Interesse ist sehr mobil sein.
Viele fluoreszierende Protein-Sonden wurden entwickelt, um Protein-Dynamik mit FRAP-Studie. Ein komplementärer Ansatz ist zum Beispiel, um photoaktivierbaren GFP (PA-GFP) oder Photokonvertierbare Varianten verwenden. Zusammen mit FRAP-Technik sind diese Werkzeuge immer unentbehrlicher für Live Cell Imaging-Studien 4-6.
Offenlegungen
Danksagungen
Diese Arbeit wurde vom National Institute on Taubheit und andere Communication Disorders (NIDCD) Intramural Programm unterstützt.
Materialien
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
Referenzen
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten