Method Article
Recuperação de fluorescência Após Fotodegradação (FRAP) de fluorescência Proteínas Tagged em espinhas dendríticas dos neurônios do hipocampo Cultivadas
Neste Artigo
Resumo
FRAP tem sido utilizada para quantificar a mobilidade de proteína de fluorescência verde (GFP) marcadas proteínas em células em cultura. Examinamos as frações móveis / imóveis da GFP, analisando o percentual de recuperação de fluorescência após a fotodegradação. Neste estudo, foi realizada na FRAP espinhas de neurônios do hipocampo.
Resumo
FRAP tem sido utilizada para quantificar a mobilidade das proteínas GFP. Usando um laser de excitação forte, a fluorescência de uma proteína GFP-tagged é branqueada na região de interesse. A fluorescência da região se recupera quando a proteína GFP-tagged crus de fora da região difunde para a região de interesse. A mobilidade da proteína é então analisada através da medição da taxa de recuperação de fluorescência. Esta técnica poderia ser usada para caracterizar a mobilidade de proteína e taxa de rotatividade.
Neste estudo, nós expressamos o (proteína verde fluorescente melhorada) vector EGFP em culturas de neurônios do hipocampo. Usando o microscópio confocal Zeiss 710, nós photobleach o sinal de fluorescência da proteína GFP em uma coluna única, e depois tirar fotos lapso de tempo para registrar a recuperação de fluorescência após a fotodegradação. Finalmente, estimamos a porcentagem de frações móvel e imóvel da GFP em espinhas, analisando os dados de imagem usando ImageJ e softwares Graphpad.
Este protocolo FRAP mostra como executar um experimento FRAP básica, bem como a forma de analisar os dados.
Protocolo
1. Transfecção neurônio
- Cultura embrionária neurônios dia 18 (E18) de ratos do hipocampo em poli-d-lisina revestido Mattek de 35 mm com fundo de vidro pratos 1. Em 16-18 dias in vitro (DIV), os neurônios transfecção usando o Clontech CalPhos Kit Transfection mamíferos. Primeiro, substituir o meio de cultura com 1,5 ml Modified Dulbecco Eagle Medium (DMEM) por 35 mm prato 0,5 horas antes da transfecção. Salvar o meio de cultura original em um tubo estéril 15 ml para uso posterior (passo 1.6).
- Misturar 10 mg DNA pEGFP-N1 do plasmídeo com estéril H 2 O (Clontech) e 12,4 mL solução de cálcio 2 M (Clontech) para um volume total de 100 l.
- Adicione a mistura a partir do passo 1.2) para 100 l 2 × HBS gota a gota enquanto vórtex 2 × HBS em velocidade média.
- Deixe a mistura descansar em temperatura ambiente por 20 minutos e depois adicione a mistura final a partir do passo 1.3) em DMEM-incubadas neurônios.
- Coloque os neurônios de volta para a 37 ° C incubadora de 1-1,5 horas.
- Remover o fosfato de cálcio contendo meio, em seguida, lavar as células com DMEM três vezes. Antes de devolver o prato de cultura para a incubadora, troca o meio DMEM com o meio de cultura original.
2. FRAP experimento em uma coluna
- Neurônios são usados para o experimento FRAP 2-4 dias após transfecção.
- Substituir o meio de cultura a partir do 35-mm prato fundo de vidro, por acrescentando imediatamente pré-aquecido solução Tyrode, que contém (em mM) NaCl 145, KCl 5, HEPES 10, Glucose 10, Glycine 0,005, CaCl 2 2,6, e MgCl 2 1.3 (pH ajustado para 7,4 com NaOH).
- A Zeiss LSM 710 microscópio confocal é usado para o experimento FRAP. O sistema TempModule Zeiss é usado para controlar a temperatura (37 ° C), a umidade e as emissões de CO 2 (5%) do sistema de trabalho. Certifique-se que o CO 2 tanque está conectado ea garrafa de água, que é usado para balanceamento de umidade, é preenchido com água.
- Encontrar uma dendrite transfectadas maduros com o objetivo × 100 (αplan Apochromat-100 × / 1,46 óleo). Se as células transfectadas no prato são pesquisa, escasso para uma célula desejada com o 40 × objetivo (plano-Neofluar 40 × / 1.3 de petróleo), e depois mudar para o 100 × objetivo de capturar imagens.
- Use 5 × zoom óptico e uma resolução de 256 × 256 pixels para a imagem de um pequeno pedaço de dendrite com espinhas várias. Para capturar as imagens, use a velocidade nominal 9 (pixel tempo de permanência 3,15 ms), que leva 0,5 segundo para terminar um scan. O pinhole é definida como 2μm para a obtenção de fluorescência forte. Ao tirar as imagens, tente usar laser de baixa transmissão, por exemplo 1-5%, para evitar a fotodegradação toda a imagem.
- Selecione a coluna de interesse. Em nosso experimento, escolhemos espinhas cogumelo com seus diâmetros coluna cabeça de ~ 1 mícron.
- Para fazer um experimento FRAP, tomar 5 imagens de controle antes de branqueamento, em seguida, água sanitária a espinha de juros de 10 vezes na transmissão do laser nominal de 100% [A potência do laser de argônio é de 30 mW, com 50% (15 mW) na linha de laser de 488, e mW aproximadamente 3-4 chega ao microscópio através da linha de laser de 488], e então capturar uma série de imagens imediatamente após o clareamento. Para este experimento, as imagens são capturadas a cada 1 segundo durante 15 segundos após o clareamento. O intervalo de tempo deve ser ajustado de acordo com diferentes proteínas alvo e diferentes desenhos experimentais (Fig. 1).
- Guardar as imagens.
3. Análise de dados
- Abrir imagens com ImageJ software.
- Alinhe a pilha de imagens utilizando a ferramenta align ("pilhas - embaralhando 'plugins' → →" align fatias na pilha de 'corpo rígido "" tradução "e / ou →) no ImageJ, de modo que a coluna de interesse não flutua , em outras palavras - ele permanece na mesma posição na imagem.
- Medir a intensidade de fluorescência relativa da coluna de interesse (F s), uma região transfectadas mas crus (controle), e uma região de fundo (F b) em imagens de lapso de tempo, usando a ferramenta 'Intensidade v Time Monitor "do ImageJ (" plugins '→' stacks - embaralhando '→' Intensidade Tempo v Monitor '). A região de controle poderia ser um pedaço de bem focada dendrite distal. A região de fundo é uma região não-fluorescente.
- Calcular a taxa de fotodegradação (r), comparando a fluorescência da região controle antes (F c0) e depois (F c) fotobranqueamento.
r = F c / F c0. - Normalizar a intensidade de fluorescência da coluna de destino (F) como segue:
F = (F s - F b) / r. - A curva é adequada a intensidade de fluorescência da coluna de destino com uma equação de uma fase exponencial de Graphpad software Prism (Fig. 2) ou outrr software similar.
- Calcular a fração móvel (f m) e da fração de imóvel (f i) pelas seguintes equações:
f m = ∞ F / F 0,
onde F ∞ é a intensidade de fluorescência após a recuperação completa, e F 0 é a intensidade de fluorescência antes de fotodegradação.
f i = 1 - f m.
4. Resultados representativos:
Neste estudo, realizamos um experimento sobre FRAP madura neurônios do hipocampo. Em 18-22 DIV, espinhas de cogumelos já estão formados. Utilizando nosso método, as mudanças dinâmicas da intensidade de fluorescência em uma região pequena, como uma coluna, pode ser gravado.
Para analisar o processo de recuperação de fluorescência de EGFP, tomamos 5 imagens como controles antes de branqueamento e, em seguida, uma imagem a cada 1 segundo imediatamente após o clareamento por 15 segundos. A resolução da imagem é suficiente para a análise quantitativa. Os perfis de recuperação de fluorescência de proteínas tag fluorescência são altamente reprodutíveis.
Também mostrarei brevemente como para definir as frações móvel e imóvel de uma proteína de fluorescência, usando ImageJ e Graphpad software Prism. O método FRAP e análise mostramos aqui pode ser amplamente utilizado em neurociência, biologia celular e outros estudos.

Figura 1. Medições FRAP de EGFP fluorescência em uma coluna de um neurônio culta do hipocampo. Das setas vermelhas indicam o tempo de fotodegradação. Fotografias representam a mesma área antes (Pré) e em 0, 1, 5, 10, 15 segundos após a fotodegradação. A região da coluna, controle e de fundo são marcadas com as letras S, C e B, respectivamente. Neurônios foram mantidos a 37 ° C durante o experimento. Escala de bar, 1 mícron.
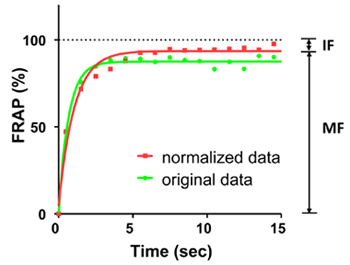
Figura 2. Curvas FRAP de EGFP de fluorescência ao longo de um período de 15 segundos. A linha verde mostra a curva original; a linha vermelha mostra a curva normalizada. Os pontos em curvas mostram a FRAP a cada 1 segundo. As curvas foram ajustadas por uma fase equações exponenciais. A fluorescência média antes fotobranqueamento foi contado como 100%. Neste experimento, a fração móvel (MF) é de 94% e da fração de imóvel (IF) é de 6%.
Discussão
FRAP análise tem sido amplamente utilizada in vivo e in vitro estudos 1-2. Esta técnica utiliza comumente GFP proteínas de fusão , embora possa também usar as proteínas de fusão alga vermelha 3. Esta análise é sensível e pode ser usado para caracterizar a mobilidade das proteínas GFP.
Para produzir análises FRAP significativa, é importante para evitar a fotodegradação desnecessários antes e durante o experimento FRAP. Há duas maneiras de conseguir isso. Primeiro, o processo para pesquisar e observar o neurônio experimental deve ser rápido. Especialmente, a observação de neurônios com um objetivo 100X por um longo tempo significativamente alvejantes a fluorescência. Segundo, potência do laser e digitalização de alta freqüência, muitas vezes aumentar a possibilidade de fotodegradação. Assim, será necessário calcular a taxa de fotodegradação em uma região de controle e depois normalizar a curva FRAP na região experimental. O método de normalização tem sido descrita no protocolo (veja o passo 3,3-3,5 para detalhes).
O passo fotobranqueamento também é crítico para assegurar resultados FRAP bom. Neste experimento, lixívia que a espinha de juros de 10 a 100 vezes a transmissão a laser%. Esta condição é suficiente para branquear a fluorescência de uma coluna para o nível de fundo em uma preparação fixo. Assim, vamos definir a intensidade de fluorescência para o mesmo número como pano de fundo em 0 segundos após a fotodegradação. Dependendo da velocidade da primeira varredura, uma quantidade significativa de recuperação de fluorescência já podem ser detectados quando a proteína de interesse é altamente móvel.
Muitas sondas proteína fluorescente têm sido desenvolvidos para estudar a dinâmica de proteínas com FRAP. Uma abordagem complementar é, por exemplo, para usar photoactivatable GFP (PA-GFP), ou variantes photoconvertible. Juntamente com a técnica FRAP, essas ferramentas estão se tornando indispensável para estudo de células vivas de imagem 4-6.
Divulgações
Agradecimentos
Este trabalho foi financiado pelo Instituto Nacional de Surdez e Outros Distúrbios de Comunicação (NIDCD) Programa intramuros.
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
Referências
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados