Method Article
교양 Hippocampal 뉴런의 돌기 쪽이에서 형광 단백질의 태그 Photobleaching 후 형광 복구 (FRAP)
요약
FRAP는 녹색 형광 단백질 (GFP) 태그 교양 세포에있는 단백질의 이동성을 계량하는 데 사용되었습니다. 우리는 photobleaching 후 형광 복구 비율을 분석하여 GFP의 모바일 / 고정되어 분수를 조사. 본 연구에서는, FRAP는 hippocampal 뉴런의 쪽이에서 수행되었다.
초록
FRAP는 GFP - 태그 단백질의 이동성을 계량하는 데 사용되었습니다. 강한 여기 레이저를 사용하여 GFP - 태그 단백질의 형광은 관심 지역에 표백됩니다. 지역의 외부에서 표백하지 않은 GFP - 태그 단백질 관심의 영역으로 diffuses 때 지역의 형광은 복구합니다. 단백질의 이동성은 다음 형광 복구 속도를 측정하여 분석합니다. 이 기술은 단백질 이동성과 회전율 속도를 특성화하는 데 사용할 수 있습니다.
본 연구에서는, 우리는 교양 hippocampal 뉴런의 (녹색 형광 단백질 강화) EGFP 벡터를 표현한다. 자이스 혈구 710 공촛점 현미경을 사용하여, 우리는 하나의 척추에 GFP 단백질의 형광 신호를 photobleach 다음 photobleaching 후 형광 회복을 기록 시간 경과 이미지를 가져가라. 마지막으로, 우리는 ImageJ와 Graphpad의 소프트웨어를 사용하여 영상 데이터를 분석하여, 쪽이에서 GFP의 모바일 및 고정되어 분수의 비율을 예상하고있다.
이 FRAP 프로토콜은뿐만 아니라 데이터를 분석하는 방법으로 기본 FRAP 실험을 수행하는 방법을 보여줍니다.
프로토콜
1. 신경 세포의 transfection
- 폴리 - D - 라이신 - 코팅 MatTek에 문화 배아 일 18 일 (E18) 쥐 hippocampal 뉴런은 35 mm 유리 바닥 요리 1. 체외에서 16-18일에서 (DIV), Clontech CalPhos 포유 동물 Transfection 키트를 사용하여 transfect의 뉴런. 첫째, 1.5 ML있는 문화 매체를 교체 Dulbecco의 수정된 이글 중간 transfection하기 전에 35 - mm 요리 0.5 시간당 (DMEM). 나중에 (단계 1.6) 사용할 수있는 살균 15 ML 튜브에서 원래 문화 매체를 저장합니다.
- 무균 H 2 O (Clontech) 100 μl의 총 볼륨에 12.4 μl 2 M의 칼슘 용액 (Clontech) 10 μg pEGFP - N1 플라스미드 DNA를 섞습니다.
- 100 μl 2 단계 1.2)의 혼합물을 추가 × HBS dropwise vortexing이 동안 × 중간 속도 HBS.
- 혼합물은 20 분 실온에서 앉아 후 DMEM - incubated 뉴런에 1.3 단계)에서 최종 혼합물을 추가하자.
- 1-1.5 시간 동안 37 ° C 배양기로 다시 뉴런 놔.
- 인산 칼슘 함유 매체를 제거 후 DMEM 세 번와 세포를 씻으십시오. 원래 문화 매체와 DMEM 매체 인큐베이터, 교류 문화 요리를 반환하기 전에.
2. 척추에 FRAP 실험
- 뉴런은 2~4일 transfection 후 FRAP 실험에 사용됩니다.
- 즉시 (MM)를 NaCl 145, KCl 5, HEPES 10, 포도당 10, 글리신 0.005, CaCl 2 2.6, 및 MgCl가 포함되어 있습니다 미리 예열 Tyrode 솔루션을 추가하여, 35 mm 유리 바닥 요리에서 배지를 교체 이 1.3 (NaOH와 7.4로 조정 PH).
- 자이스 혈구 LSM 710 공촛점 현미경은 FRAP 실험에 사용됩니다. 자이스 혈구 TempModule 시스템은 온도 (37 ° C), 습도 및 작업 시스템의 CO 2 (5 %)을 제어하는 데 사용됩니다. CO 2 탱크가 연결되어 있고 습도를 균형에 사용되는 물 병은, 물로 채워져 있는지 확인합니다.
- 100 × 목표 (αplan - 고차 색지움 100 × / 1.46 오일)와 transfected 성숙 dendrite를 찾습니다. 접시에 transfected 세포가 스파스, 40 원하는 셀 검색 × 목표 (계획 - NEOFLUAR 40 × / 1.3 석유), 다음 100 × 스위치 이미지를 캡처하는 객관적인 경우.
- 5 × 광학 줌 사용 및 이미지 몇 쪽이과 dendrite의 짧은 조각을 위해 256 × 256 픽셀 해상도를. 이미지를 캡처하려면, 0.5 초이 검사를 완료하는 데 걸리는 속도 명목 9 (픽셀 시간이 3.15 μsec 살기)을 사용합니다. 핀홀은 강한 형광을 얻기 위해 2μm로 설정됩니다. 이미지를 복용하면, 전체 이미지를 photobleaching 피하기 위해, 예를 들어 1-5%에 대한 낮은 레이저 전송을 사용하려고합니다.
- 관심 척추를 선택합니다. 우리의 실험에서, 우리는 ~ 1 μm의 자신의 척추 헤드 지름과 버섯 쪽이을 선택합니다.
- FRAP 실험을 수행하려면 488 레이저 라인에서 50 % (15 MW)와 아르곤 레이저의 파워는 30 MW입니다 [표백 후, 표백하기 전에 정격 100 % 레이저 전송에 관심을 10 번의 척추를 5 컨트롤 이미지를 가지고, 약 3-4 MW는 488 레이저 라인]를 통해 현미경에 도달하고 즉시 표백 후 이미지의 시리즈를 캡처합니다. 본 실험의 경우, 이미지는 표백 후 15 초 동안 매 일초를 점령하고 있습니다. 시간 간격은 다른 타겟팅 단백질 및 다른 실험 설계 (그림 1)에 따라 조정되어야합니다.
- 이미지를 저장합니다.
3. 데이터 분석
- ImageJ 소프트웨어와 이미지를 엽니다.
- 관심 척추가 물에 뜨지 않는다 그래야, ImageJ에서 - (→ → '번역'및 / 또는 '엄격한 신체'스택에 조각 정렬 '플러그인'→ '걸어갔다 스택')은 정렬 도구를 사용하여 이미지의 스택 정렬 다른 단어 - 그것은 이미지에 동일한 위치에 남아 있습니다.
- ImageJ의 '강도 V 타임 모니터'도구 ( '플러그인을 사용하여 관심있는 척추 (F S), transfected지만, 표백하지 않은 영역 (제어), 그리고 시간 경과 이미지에서 배경 영역 (F B)의 상대 형광 강도를 측정 '→'스택 - 걸어갔다 '→'강도 V 타임 모니터 '). 제어 영역은 잘 집중 말초 dendrite의 조각 될 수 있습니다. 배경 지역이 아닌 형광등 지역입니다.
- 전에 (F C0)와 (F C) photobleaching 후 제어 영역의 형광을 비교하여 photobleaching 속도를 (R)을 계산.
R = F C / F C0. - 다음과 같이 대상 척추의 형광 강도 (F)를 정상화 :
F = (F S - F B) / R. - 커브가 한 단계 지수 Graphpad의 프리즘 소프트웨어의 방정식 (그림 2) 또는 인접해있는 대상 척추의 형광 강도에 맞게R 유사한 소프트웨어.
- 모바일 분율 (F M) 다음과 같은 등식으로 고정되어 분수를 (F I) 계산 :
F M = F ∞ / F 0,
어디 F ∞ 전체 복구 후 형광 강도이며, F 0 photobleaching 전에 형광 강도입니다.
F I = 1 - F M.
4. 대표 결과 :
본 연구에서는, 우리는 성숙한 hippocampal 뉴런에 FRAP 실험을 수행합니다. 18-22 DIV에서 버섯 쪽이 이미 형성됩니다. 우리의 방법을 사용하여 같은 척추와 같은 작은 영역에서 형광 강도의 동적 변경, 녹음 수 있습니다.
EGFP의 형광 복구 프로세스를 분석하기 위해, 우리는 표백하기 전에 컨트롤로 5 이미지 다음 즉시 15 초 동안 표백 후 매 일초 한 이미지를 가져가라. 이미지의 해상도가 정량 분석을 위해 충분합니다. 태그 형광 단백질의 형광 복구 프로필이 높은 재현성 있습니다.
우리는 또한 간략하게 ImageJ 및 Graphpad의 프리즘 소프트웨어를 사용하여 형광 단백질의 모바일 및 고정되어 분수를 정의하는 방법을 보여줍니다. 우리가 여기에 표시 FRAP 방법 및 분석은 크게 신경 과학, 세포 생물학 연구와 다른 연구에서 사용할 수 있습니다.

그림 1. 교양 hippocampal 신경 세포에서 척추에 EGFP 형광의 FRAP 측정. 빨간 화살촉은 photobleaching의 시간을 나타냅니다. 사진은 전에 동일한 영역을 (사전) 대표와 photobleaching 0, 1, 5, 10, 15 초 후. 척추, 제어 및 배경의 지역은 문자 각각 S, C와 B와 함께 표시됩니다. 뉴런은 실험 기간 동안 37 ° C에서 유지되었다. 스케일 바, 1 μm의.
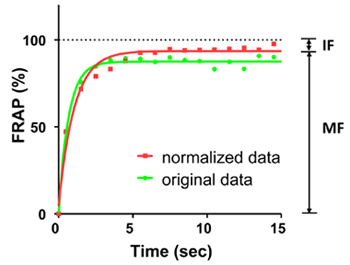
그림 2. 15 초 동안 EGFP 형광의 FRAP 곡선. 녹색 라인은 원래의 곡선을 보여주는, 빨간색 선은 표준 곡선을 보여줍니다. 곡선에있는 점들은 FRAP 매 일초을 보여줍니다. 곡선은 한 단계 지수 방정식으로 장착되었습니다. photobleaching 전에 평균 형광 100 %로 계산되었다. 본 실험에서는 모바일 분수 (MF)는 94%이고 고정되어 분수 (IF) 6 %입니다.
토론
FRAP 분석은 크게 생체내 및 시험 관내 1-2 연구에 사용되고 있습니다. 이 기술은 일반적으로 이용 GFP 융합 단백질을 그것도 빨간 알가의 융합 단백질 3을 사용할 수 있지만. 이 분석은 민감하고 GFP - 태그 단백질의 이동성을 특징하는 데 사용할 수 있습니다.
의미 FRAP 분석을 생산하기 위해서는 이전과 FRAP 실험 도중 불필요한 photobleaching을 방지하는 것이 중요합니다. 이것을 달성하기 위해 두 가지 방법이 있습니다. 첫째, 검색 및 실험 신경 세포를 관찰하는 과정이 빨리되어야합니다. 특히, 오랫동안 100X 목적으로 뉴런의 관찰 크게 형광 표백제로 닦았을. 둘째, 높은 레이저 전원과 상용 스캔은 종종 photobleaching의 가능성을 높일 수 있습니다. 그러므로, 그것은 통제 지역에서 photobleaching 율을 계산하고 실험 지역에서 FRAP 곡선을 정상화하기 위해 필요합니다. 정규화 방법 (자세한 내용은 단계 3.3-3.5 참조) 프로토콜에 설명되어있다.
photobleaching 단계는 또한 좋은 FRAP 결과를 확보 중요합니다. 본 실험에서는, 우리는 100 % 표백 레이저 전송에 관심이 10 배의 척추 있습니다. 이 조건은 표백 고정 준비 배경 수준으로 척추의 형광을하기에 충분합니다. 따라서, 우리는 photobleaching 후 0초에서 배경 같은 번호로 형광 강도를 설정합니다. 첫 번째 스캔의 속도에 따라 형광 복구의 상당량은 이미 관심의 단백질이 높은 휴대 때 감지 수 있습니다.
많은 형광 단백질 프로브는 FRAP과 단백질 역학을 연구하기 위해 개발되었습니다. 보완 접근 photoactivatable GFP (PA - GFP) 또는 photoconvertible 변종을 사용하는, 예를 들어 있습니다. 함께 FRAP 기술과 함께,이 도구는 라이브 셀 이미징 연구 4-6위한 필수가되고있다.
공개
감사의 말
이 작품은 청각 및 기타 통신 장애에 국립 연구소 (NIDCD) 교내 프로그램에 의해 지원되었다.
자료
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
참고문헌
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유