Method Article
Récupération de fluorescence après photoblanchiment (FRAP) de fluorescence protéines marquées dans les épines dendritiques des neurones de l'hippocampe de culture
Dans cet article
Résumé
FRAP a été utilisée pour quantifier la mobilité des protéine de fluorescence verte (GFP)-protéines étiquetées dans les cellules cultivées. Nous avons examiné les fractions mobiles / immobiles de la GFP en analysant le pourcentage de recouvrement de fluorescence après photoblanchiment. Dans cette étude, le FRAP a été réalisée à épines des neurones de l'hippocampe.
Résumé
FRAP a été utilisée pour quantifier la mobilité de la GFP-protéines étiquetées. L'utilisation d'un laser d'excitation forte, la fluorescence d'une protéine GFP-étiqueté est blanchi dans la région d'intérêt. La fluorescence de la région récupère lorsque l'écru GFP-protéine marquée de l'extérieur de la région se diffuse dans la région d'intérêt. La mobilité de la protéine est ensuite analysé en mesurant le taux de recouvrement de fluorescence. Cette technique pourrait être utilisée pour caractériser la mobilité des protéines et le taux de roulement.
Dans cette étude, nous exprimons le vecteur (enhanced green fluorescent protein) EGFP dans des cultures de neurones de l'hippocampe. Utilisation du microscope confocal Zeiss 710, nous photobleach du signal de fluorescence de la protéine GFP dans une colonne unique, puis de prendre des images laps de temps pour enregistrer le recouvrement de fluorescence après photoblanchiment. Enfin, nous estimons que le pourcentage des fractions mobiles et immobiles de la GFP dans les épines, en analysant les données d'imagerie utilisant ImageJ et logiciels Graphpad.
Ce protocole FRAP montre comment effectuer une expérience FRAP base ainsi que la façon d'analyser les données.
Protocole
1. Transfection Neuron
- Culture embryonnaire des neurones de rat jour 18 (E18) hippocampique sur le poly-D-lysine MatTek de 35 mm à fond de verre plats 1. Les 16-18 jours in vitro (DIV), les neurones transfecter utilisant le kit Clontech Calphos transfection mammifères. Tout d'abord, remplacer le milieu de culture avec 1,5 ml Medium Eagle modifié par Dulbecco (DMEM) par 35 mm, plat 0,5 heures avant la transfection. Enregistrer le milieu de culture d'origine dans un tube de 15 ml stériles pour plus tard (étape 1.6) utilisation.
- Mélanger 10 g pEGFP-N1 ADN plasmidique avec H 2 O stérile (Clontech) et 12,4 ul 2 M solution de calcium (Clontech) pour un volume total de 100 pl.
- Ajouter le mélange de l'étape 1.2) à 100 ul 2 x HBS goutte à goutte tout en vortex 2 x HBS à vitesse moyenne.
- Laissez reposer le mélange à la température ambiante pendant 20 minutes puis ajouter le mélange final de l'étape 1.3) dans du DMEM-incubées neurones.
- Mettez les neurones de nouveau dans l'incubateur 37 ° C pendant 1-1,5 heures.
- Retirez le phosphate contenant du calcium moyen, puis laver les cellules avec du DMEM à trois reprises. Avant de retourner la boîte de culture à l'incubateur, l'échange du milieu DMEM avec le milieu de culture d'origine.
2. FRAP expérimentation sur une colonne vertébrale
- Les neurones sont utilisés pour l'expérience FRAP deux à quatre jours après la transfection.
- Remplacez le milieu de culture de la 35-mm à fond de verre plat, en mettant immédiatement en ajoutant la solution de Tyrode préchauffé, qui contient (en mM) NaCl 145, KCl 5, HEPES 10, 10 Glucose, Glycine 0,005, CaCl 2 2,6, et MgCl 2 1.3 (pH ajusté à 7,4 avec NaOH).
- Un Zeiss LSM 710 microscope confocal est utilisé pour l'expérience du FRAP. Le système TempModule Zeiss est utilisé pour contrôler la température (37 ° C), l'humidité et le CO 2 (5%) du système de travail. Assurez-vous que le réservoir de CO 2 est connecté et la bouteille d'eau, qui est utilisé pour l'équilibrage de l'humidité, est rempli d'eau.
- Trouver une dendrite transfectées avec la maturité de 100 × objectif (αplan-Apochromat 100 × / 1,46 huile). Si les cellules transfectées dans le plat sont rares, la recherche d'une cellule souhaitée avec l'objectif de 40 × (Plan-Neofluar 40 × / 1,3 huile), puis passer à l'objectif de 100 × pour capturer des images.
- Utilisez 5 x zoom optique et une résolution de 256 × 256 pixels pour l'image d'une courte pièce de dendrites avec des épines de plusieurs. Pour capturer des images, utilisez la vitesse nominale 9 (pixel temporisation 3,15 msec) qui prend 0,5 secondes pour terminer un scan. Le sténopé est fixé à 2 pm pour obtenir une forte fluorescence. Lors de la prise d'images, essayez d'utiliser la transmission par laser basse, par exemple 1-5%, pour éviter de photoblanchiment toute l'image.
- Sélectionnez la colonne vertébrale de l'intérêt. Dans notre expérience, nous choisissons épines champignons avec leurs diamètres de la tête du rachis de ~ 1 um.
- Pour faire une expérience FRAP, prendre 5 images de contrôle avant le blanchiment, puis l'eau de Javel de la colonne vertébrale d'intérêt 10 fois à la transmission par laser nominale de 100% [La puissance laser à l'argon est de 30 mW, avec 50% (15 MW) dans la ligne 488 au laser, et mW environ 3-4 atteint le microscope par la ligne 488 au laser], puis capturer une série d'images, immédiatement après le blanchiment. Pour cette expérience, les images sont capturées chaque seconde 1 pendant 15 secondes après le blanchiment. L'intervalle de temps doit être ajustée en fonction de différentes protéines de ciblage et de différents modèles expérimentaux (Fig. 1).
- Enregistrer des images.
3. L'analyse des données
- Ouvrez les images avec logiciel ImageJ.
- Alignez la pile d'images en utilisant l'outil aligner («stacks - brassage 'plugins' → → 'aligner les tranches dans la pile' → 'corps rigide'« traduction »et / ou) dans ImageJ, de sorte que la colonne vertébrale d'intérêt ne flottent pas , en d'autres termes - il reste dans la même position sur l'image.
- Mesure relative intensité de la fluorescence de la colonne vertébrale d'intérêt (F s), une région transfectées mais non blanchie (contrôle), et une région de fond (F b) dans les images laps de temps, en utilisant l'outil 'intensité V Temps Moniteur "de ImageJ (« plugins '→' stacks - brassage '→' intensité v Heure Monitor '). La région de contrôle pourrait être un morceau de bien ciblée dendrites distales. La région de fond est une région non-fluorescent.
- Calculer le taux de photoblanchiment (r) en comparant la fluorescence de la région de contrôle avant (F C0) et après (F c) photoblanchiment.
r = F C / F C0. - Normaliser l'intensité de fluorescence de la colonne vertébrale cible (F) comme suit:
F = (F s - F b) / R. - Courbe d'ajustement de l'intensité de la fluorescence de la colonne vertébrale cible avec une équation d'une phase exponentielle de logiciel GraphPad Prism (fig. 2) ou Other un logiciel similaire.
- Calculer la fraction mobile (f m) et la fraction immobile (f i) par les équations suivantes:
f m = F ∞ / F 0,
où F ∞ est l'intensité de fluorescence après guérison complète, et F 0 est l'intensité de fluorescence avant photoblanchiment.
f i = 1 - F M.
4. Les résultats représentatifs:
Dans cette étude, nous procédons à une expérience sur le FRAP matures neurones de l'hippocampe. À 18-22 DIV, les épines de champignons sont déjà formées. Grâce à notre méthode, les changements dynamiques de l'intensité de fluorescence dans une petite région, comme une colonne vertébrale, peut être enregistrée.
Pour analyser le processus de récupération de fluorescence de l'EGFP, nous prenons 5 images que les contrôles avant le blanchiment et ensuite une image toutes les 1 secondes immédiatement après blanchiment pendant 15 secondes. La résolution de l'image est suffisante pour une analyse quantitative. Les profils de recouvrement de fluorescence des protéines étiquetées par fluorescence sont hautement reproductibles.
Nous avons également montrer brièvement comment définir les fractions mobiles et immobiles d'une protéine de fluorescence, en utilisant le logiciel ImageJ et Prism Graphpad. La méthode FRAP et de l'analyse que nous présentons ici peut être largement utilisé dans les neurosciences, la biologie cellulaire et d'autres études.

Figure 1. FRAP mesures de fluorescence dans EGFP une colonne vertébrale à partir d'un neurone en culture d'hippocampe. Les flèches rouges indiquent les temps de photoblanchiment. Photographies représentent la même zone avant (Pre) et à 0, 1, 5, 10, 15 secondes après photoblanchiment. La région de la colonne vertébrale, de contrôle et de fond sont marqués avec les lettres S, C et B, respectivement. Les neurones ont été maintenues à 37 ° C pendant l'expérience. La barre d'échelle, une um.
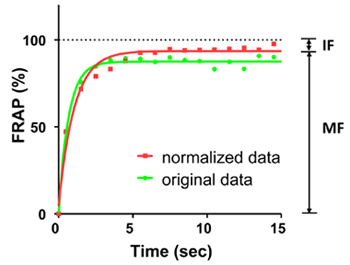
Figure 2. FRAP courbes de EGFP par fluorescence sur une période de 15 secondes. La ligne verte représente la courbe d'origine, la ligne rouge montre la courbe normalisée. Les points sur les courbes montrent la FRAP chaque seconde 1. Les courbes ont été montés par une phase équations exponentielles. La fluorescence moyenne avant photoblanchiment a été compté comme 100%. Dans cette expérience, la fraction mobile (MF) est de 94% et la fraction immobile (SI) est de 6%.
Discussion
Analyse du PAF a été largement utilisée in vivo et in vitro 1-2 études. Cette technique utilise couramment la GFP des protéines de fusion , mais elle pourrait également utiliser les protéines de fusion algue rouge 3. Cette analyse est sensible et peut être utilisée pour caractériser la mobilité des protéines étiquetées GFP.
Pour produire une analyse FRAP sens, il est important d'éviter de photoblanchiment inutiles avant et pendant l'expérience de FRAP. Il ya deux façons d'y parvenir. Premièrement, le processus de rechercher et d'observer les neurones expérimentale devrait être rapide. Surtout, l'observation des neurones avec un objectif 100X pour une longue période blanchit de manière significative la fluorescence. Deuxièmement, la puissance du laser à balayage élevée et fréquente souvent à accroître la possibilité de photoblanchiment. Ainsi, il sera nécessaire de calculer le taux de photoblanchiment dans une région de contrôle puis de normaliser la courbe du PAF dans la région expérimentale. La méthode de normalisation a été décrite dans le protocole (voir l'étape 3.3 à 3.5 pour plus de détails).
L'étape photoblanchiment est également essentielle pour assurer des résultats FRAP bon. Dans cette expérience, nous avons l'eau de Javel de la colonne vertébrale d'intérêt 10 fois à 100% de transmission laser. Cette condition est suffisante pour blanchir la fluorescence d'une colonne vertébrale au niveau de base dans une préparation fixée. Ainsi, nous avons mis de l'intensité de fluorescence pour le même nombre que de fond à 0 secondes après photoblanchiment. Selon la vitesse de la première analyse, une quantité importante de récupération de fluorescence peut-être déjà détecté lors de la protéine d'intérêt est très mobile.
Beaucoup de sondes protéine fluorescente ont été développées pour étudier la dynamique des protéines avec des FRAP. Une approche complémentaire est, par exemple, d'utiliser la GFP photoactivables (PA-GFP), ou des variantes photoconvertible. Ensemble, avec la technique du FRAP, ces outils deviennent indispensables pour vivre des études d'imagerie cellulaire 4-6.
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par l'Institut national sur la surdité et autres troubles de communication (NIDCD) programme intra-muros.
matériels
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
Références
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon