Method Article
Recupero della fluorescenza dopo photobleaching (FRAP) di fluorescenza proteine Tagged in spine dendritiche di colture di neuroni ippocampali
In questo articolo
Riepilogo
FRAP è stato utilizzato per quantificare la mobilità di Green Fluorescence Protein (GFP)-tagged proteine in cellule in coltura. Abbiamo esaminato le frazioni mobile / immobile della GFP, analizzando la percentuale di recupero di fluorescenza dopo photobleaching. In questo studio, FRAP è stato effettuato a dorso di neuroni dell'ippocampo.
Abstract
FRAP è stato utilizzato per quantificare la mobilità dei GFP-tagged proteine. Utilizzando un laser forte eccitazione, la fluorescenza di una proteina GFP-tagged è sbiancato nella regione di interesse. La fluorescenza della regione recupera quando il greggio GFP-tagged proteine al di fuori della regione diffonde nella regione di interesse. La mobilità della proteina viene poi analizzata misurando il tasso di fluorescenza di recupero. Questa tecnica potrebbe essere usata per caratterizzare la mobilità proteine e tasso di turnover.
In questo studio, esprimiamo la (enhanced green fluorescent protein) vettore EGFP in colture di neuroni dell'ippocampo. Utilizzando il microscopio confocale Zeiss 710, abbiamo photobleach il segnale di fluorescenza della proteina GFP in una sola colonna vertebrale, e poi prendere le immagini lasso di tempo per registrare il recupero di fluorescenza dopo photobleaching. Infine, si stima la percentuale di frazioni mobile e immobile della GFP in spine, analizzando i dati di imaging con ImageJ e software GraphPad.
Questo protocollo FRAP mostra come eseguire un esperimento di base FRAP e come analizzare i dati.
Protocollo
1. Neuron trasfezione
- Cultura embrionale i neuroni di ratto giorno 18 (E18) dell'ippocampo sulla poli-d-lisina rivestite MatTek da 35 mm con fondo di vetro piatti 1. Sul 16-18 giorni in vitro (DIV), i neuroni trasfezione utilizzando il kit CalPhos Transfection mammiferi Clontech. In primo luogo, sostituire il terreno di coltura con 1,5 ml di coltura Dulbecco modificato Aquila Media (DMEM) per 35 mm, piatto 0,5 ore prima della trasfezione. Salvare il supporto originale la cultura in un tubo sterile 15 ml per rivederlo (passo 1,6) uso.
- Mix 10 mcg pEGFP-N1 DNA plasmidico con sterili H 2 O (Clontech) e 12,4 microlitri soluzione 2 M di calcio (Clontech) per un volume totale di 100 ul.
- Aggiungere il composto a partire dal punto 1.2) a 100 l 2 × HBS goccia a goccia, mentre vortex 2 × HBS a velocità media.
- Lasciate il composto a temperatura ambiente per 20 minuti e poi aggiungete il composto finale dal punto 1.3) in DMEM-incubate neuroni.
- Mettete i neuroni indietro nel 37 ° C incubatore per 1-1,5 ore.
- Rimuovere il fosfato contenenti calcio medio, quindi lavare le cellule con DMEM tre volte. Prima di restituire il piatto alla cultura, incubatore di cambio del mezzo DMEM con il terreno di coltura originale.
2. FRAP esperimento su una spina dorsale
- I neuroni sono utilizzati per l'esperimento FRAP 2-4 giorni dopo la trasfezione.
- Sostituire il terreno di coltura da 35 mm con fondo di vetro piatto, da subito l'aggiunta di pre-riscaldato Soluzione Tyrode, che contiene (in mm) NaCl 145, KCl 5, HEPES 10, Glucosio 10, glicina 0,005, CaCl2 2.6, e MgCl 2 1.3 (pH regolato a 7,4 con NaOH).
- Un Zeiss LSM 710 microscopio confocale è utilizzato per l'esperimento FRAP. Il sistema TempModule Zeiss è utilizzato per controllare la temperatura (37 ° C), l'umidità e la CO 2 (5%) del sistema di lavoro. Assicurarsi che la CO 2 del serbatoio è collegato e la bottiglia d'acqua, che viene utilizzato per bilanciare l'umidità, si riempie di acqua.
- Trova un dendrite transfettate maturo con l'obiettivo × 100 (αplan-Apochromat 100 × / 1,46 olio). Se le cellule transfettate nel piatto sono sparse, ricerca di una cella desiderata con l'obiettivo 40 × (Plan-Neofluar 40 × / 1,3 olio), e poi passare alla 100 × obiettivo di catturare le immagini.
- Utilizzare 5 × zoom ottico e di una risoluzione di 256 × 256 pixel per l'immagine di un breve brano di dendrite con spine diverse. Per catturare le immagini, utilizzare velocità nominale 9 (pixel tempo di sosta 3,15 msec) che prende 0,5 secondi per completare una scansione. Il foro stenopeico è impostato per 2μm di ottenere una forte fluorescenza. Quando si scattano immagini, tenta di utilizzare la trasmissione a bassa laser, per esempio 1-5%, per evitare photobleaching l'intera immagine.
- Selezionare la colonna vertebrale di interesse. Nel nostro esperimento, abbiamo scelto spine di funghi con diametro della colonna vertebrale la testa di circa 1 micron.
- Per fare un esperimento FRAP, prendere 5 immagini di controllo prima dello sbiancamento, poi candeggina la colonna vertebrale di interesse 10 volte al valore nominale di trasmissione laser 100% [La potenza argon laser è 30 mW, con il 50% (15 mW) in linea 488 laser, e mW circa 3-4 arriva al microscopio attraverso la linea 488 laser], e quindi acquisire una serie di immagini subito dopo lo sbiancamento. Per questo esperimento, le immagini vengono catturate ogni 1 secondo per 15 secondi dopo lo sbiancamento. L'intervallo di tempo dovrebbe essere regolata in base alle diverse proteine target e diversi disegni sperimentali (Fig. 1).
- Salvare le immagini.
3. Analisi dei dati
- Aprire le immagini con il software ImageJ.
- Allineare la pila di immagini utilizzando lo strumento di allineamento ('plugins' → 'pile - mischiare' → 'allineare le fette in pila' → 'corpo rigido' 'traduzione' e / o) in ImageJ, in modo che la colonna vertebrale di interesse non galleggia , in altre parole - rimane nella stessa posizione sull'immagine.
- Misura relativa intensità di fluorescenza della colonna vertebrale di interesse (F s), una regione transfettate ma greggi (controllo), e una regione di fondo (F b) nelle immagini lasso di tempo, utilizzando lo strumento 'intensità v Tempo Monitor' di ImageJ ('plugin '→' pile - mischiare '→' intensità v Tempo Monitor '). La regione di controllo potrebbe essere un pezzo di ben focalizzato dendrite distale. La regione sfondo è un non-fluorescente regione.
- Calcolare il tasso photobleaching (r) confrontando la fluorescenza della regione di controllo prima (F c0) e dopo (F c) photobleaching.
r = F c / F c0. - Normalizzare l'intensità di fluorescenza della colonna di destinazione (F) come segue:
F = (F s - F b) / r. - Curva adatta l'intensità di fluorescenza della colonna vertebrale bersaglio con una sola fase equazione esponenziale del software Prism GraphPad (Fig. 2) o Other software simili.
- Calcolare la frazione mobile (f m) e la frazione di immobile (f) dalle seguenti equazioni:
f m = ∞ F / F 0,
dove F ∞ è l'intensità di fluorescenza dopo il recupero completo, e F 0 è l'intensità di fluorescenza prima photobleaching.
f i = 1 - lettera f m.
4. Rappresentante dei risultati:
In questo studio, noi dobbiamo fare un esperimento su FRAP maturo neuroni dell'ippocampo. A 18-22 DIV, spine funghi sono già formate. Utilizzando il nostro metodo, i cambiamenti dinamici della fluorescenza in una regione piccola, come una spina dorsale, può essere registrato.
Per analizzare il processo di recupero di fluorescenza EGFP, prendiamo 5 immagini come controlli prima dello sbiancamento e poi 1 immagine ogni 1 secondo subito dopo lo sbiancamento per 15 secondi. La risoluzione dell'immagine è sufficiente per l'analisi quantitativa. I profili di recupero di fluorescenza di tag proteine fluorescenza sono altamente riproducibili.
Abbiamo anche brevemente illustrato come definire le frazioni mobile e immobile di una proteina a fluorescenza, utilizzando ImageJ e software Prism GraphPad. Il metodo FRAP e analisi mostriamo qui può essere ampiamente utilizzato nel campo delle neuroscienze, biologia cellulare e altri studi.

Figura 1. FRAP misure di fluorescenza EGFP in una spina da un neurone dell'ippocampo colta. Le frecce rosse indicano il tempo di photobleaching. Fotografie rappresentano la stessa area prima (Pre) e 0, 1, 5, 10, 15 secondi dopo photobleaching. La regione del controllo della colonna vertebrale, e lo sfondo sono contrassegnate con le lettere S, C e B, rispettivamente. I neuroni sono stati mantenuti a 37 ° C durante l'esperimento. Scala bar, 1 micron.
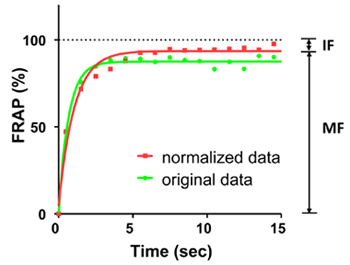
Figura 2. Curve FRAP di fluorescenza EGFP nel corso di un periodo di 15 secondi. La linea verde mostra la curva originale, la linea rossa indica la curva normalizzata. I puntini sulle curve mostrano il FRAP ogni 1 secondo. Le curve sono stati montati da equazioni esponenziali monofase. La fluorescenza media prima photobleaching è stato contato come 100%. In questo esperimento, la frazione mobile (MF) è del 94% e la frazione di immobile (IF) è del 6%.
Discussione
Analisi FRAP è stato ampiamente utilizzato in vivo e in vitro 1-2 studi. Questa tecnica utilizza comunemente GFP proteine di fusione , anche se potrebbe anche usare proteine di fusione alga rossa 3. Questa analisi è sensibile e può essere utilizzato per caratterizzare la mobilità dei GFP-tagged proteine.
Per produrre analisi significativa FRAP, è importante evitare inutili photobleaching prima e durante l'esperimento FRAP. Ci sono due modi per raggiungere questo obiettivo. In primo luogo, la procedura per ricercare e osservare il neurone sperimentale dovrebbe essere veloce. In particolare, l'osservazione di neuroni con un obiettivo 100X per lungo tempo schiarisce in modo significativo la fluorescenza. In secondo luogo, il potere e la scansione laser ad alta frequenza spesso aumentano la possibilità di photobleaching. Quindi, sarà necessario per calcolare il tasso photobleaching in una zona di controllo e poi normalizzare la curva FRAP nella regione sperimentale. Il metodo di normalizzazione è stato descritto nel protocollo (vedere il passaggio 3,3-3,5 per i dettagli).
Il passo fotodecolorazione è inoltre fondamentale per garantire buoni risultati FRAP. In questo esperimento, abbiamo candeggina la colonna vertebrale di interesse 10 volte al 100% di trasmissione laser. Questa condizione è sufficiente per sbiancare la fluorescenza di una spina dorsale a livello di fondo in un preparato fisso. Così, abbiamo fissato l'intensità di fluorescenza allo stesso numero da sfondo a 0 secondi dopo photobleaching. A seconda della velocità della prima scansione, una quantità significativa di recupero fluorescenza potrebbe essere già rilevato quando la proteina di interesse è molto mobile.
Molte sonde proteina fluorescente sono stati sviluppati per studiare la dinamica delle proteine con FRAP. Un approccio complementare è, per esempio, per utilizzare photoactivatable GFP (GFP-PA), o varianti photoconvertible. Insieme con la tecnica FRAP, questi strumenti stanno diventando indispensabile per gli studi di imaging cellulare dal vivo 4-6.
Divulgazioni
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute on Deafness e altri disturbi della comunicazione (dell'NIDCD) Programma Intramural.
Materiali
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
Riferimenti
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon