Method Article
Флуоресценция Восстановление после фотообесцвечивания (FRAP) флуоресценции меткой Белки в Дендритные Шипы культивированный нейронов гиппокампа
В этой статье
Резюме
FRAP была использована для количественного мобильность Зеленый флуоресцентный белка (GFP), помеченные белков в культуре клеток. Мы рассмотрели мобильных / неподвижные доли GFP путем анализа флуоресценции процент выздоровления после фотообесцвечивания. В этом исследовании, FRAP была выполнена на шипы нейронов гиппокампа.
Аннотация
FRAP была использована для количественной оценки подвижности GFP с метками белков. Использование сильного лазерного возбуждения флуоресценции GFP с метками белка отбеливается в области интереса. Флуоресценции области восстанавливается при небеленой GFP с метками белка из-за пределов региона диффундирует в область интересов. Подвижность белка затем анализируется путем измерения флуоресценции скорость восстановления. Этот метод может быть использован для характеристики подвижности белка и текучести кадров.
В этом исследовании, мы выражаем (улучшенный зеленый флуоресцентный белок) EGFP вектор в культуре нейронов гиппокампа. Использование Zeiss 710 конфокальной микроскопии, мы photobleach флуоресценции сигнал GFP белка в одном позвоночника, а затем получать изображения промежуток времени для записи флуоресценции восстановления после фотообесцвечивания. Оценим, наконец, процент подвижных и неподвижных доли GFP в шипы, на основе анализа данных с использованием изображений ImageJ и GraphPad программного обеспечения.
Этот протокол FRAP показано, как выполнять основные эксперимент FRAP, а также, как анализировать данные.
протокол
1. Нейрон трансфекции
- Культуры эмбриональных крыс день 18 (E18) нейронов гиппокампа на поли-D-лизин покрытием Маттек 35-мм со стеклянным дном блюда 1. На 16-18 дней в пробирке (DIV), трансфекции нейронов использованием Clontech CalPhos млекопитающих Kit трансфекции. Во-первых, заменить культуральной среде с 1,5 мл изменения Eagle Дульбеко среднего (DMEM) в 35-мм блюдо 0,5 часа до трансфекции. Сохраните оригинальную питательную среду в стерильные 15 мл трубку для последующего использования (шаг 1,6) использования.
- Смешайте 10 мкг pEGFP-N1 ДНК плазмиды стерильной H 2 O (Clontech) и 12,4 мкл 2 М раствор кальция (Clontech) до общего объема 100 мкл.
- Добавить смесь из шага 1.2) до 100 мкл 2 × HBS по каплям при вортексе 2 × HBS на средней скорости.
- Пусть смесь сидеть при комнатной температуре в течение 20 минут, а затем добавить конечной смеси с шага 1.3) в DMEM-инкубировали нейронов.
- Положите нейронов обратно в 37 ° C инкубатора в течение 1-1,5 часов.
- Удалить из фосфата кальция среде, содержащей, затем промыть клетки с DMEM три раза. Перед возвращением культуры блюдо инкубатор, обмен среде DMEM с оригинальным питательной среды.
2. FRAP эксперимент по позвоночнику
- Нейроны используются для FRAP эксперимент двух до четырех дней после трансфекции.
- Замените культуральной среде с 35-мм со стеклянным дном тарелку, добавив, немедленно подогретого Tyrode Решение, которое содержит (в мМ) NaCl 145, KCl 5, HEPES 10, Глюкоза 10, Глицин 0,005, CaCl 2 2.6 и MgCl 2 1.3 (рН до 7,4 с NaOH).
- Zeiss LSM 710 конфокальной микроскопии используется для FRAP эксперимента. Система Zeiss TempModule используется для контроля температуры (37 ° С), влажности и CO 2 (5%) из работающей системы. Убедитесь, что CO 2, танк подключен и бутылку воды, которая используется для балансировки влажности, заполнен водой.
- Найти трансфицированных зрелых дендритных с 100 × цели (αplan-Apochromat 100 × / 1,46 масла). Если трансфекции клеток в блюдо редкие, поиск нужную ячейку с 40 × цель (план-NEOFLUAR 40 × / 1,3 масла), а затем переключиться на 100 × цель для захвата изображений.
- Используйте 5 × оптический зум и 256 × 256 пикселей на изображение небольшой фрагмент дендрита с несколькими шипами. Для захвата изображения, использовать номинальной скорости 9 (пиксель время задержки 3,15 мкс), который занимает 0,5 секунды, чтобы закончить проверку. Обскуры установлен в 2 мкм, чтобы получить сильную флуоресценцию. При съемке изображений, попробуйте использовать низкие передачи лазера, например, 1-5%, чтобы избежать фотообесцвечивания всего изображения.
- Выберите позвоночника интересов. В нашем эксперименте мы выбираем гриб шипами с позвоночником головы диаметром ~ 1 мкм.
- Для этого FRAP эксперимент, возьмите 5 изображений контроль до отбеливания, то отбеливатель позвоночника интерес в 10 раз при номинальной 100% лазерной передачи [власти аргонового лазера составляет 30 мВт, при этом 50% (15 мВт) в 488 лазерных линий, а примерно 3-4 мВт достигает микроскопом через 488 лазерных линий], а затем захват серии изображений сразу после отбеливания. Для этого эксперимента, что изображения будут захвачены каждую 1 секунду в течение 15 секунд после отбеливания. Промежуток времени должен быть скорректирован в зависимости от различных ориентации белков и различных экспериментальных конструкций (рис. 1).
- Сохранение изображений.
3. Анализ данных
- Открытие изображений с ImageJ программного обеспечения.
- Выровняйте стопку фотографий с помощью инструмента выравнивания ('стеки - перетасовка "," плагины "→ →" выровнять ломтики в стеке' → «перевод» и / или «твердого тела») в ImageJ, так, чтобы позвоночник интерес не плавает , другими словами - он остается в том же положении на изображении.
- Мера относительной интенсивности флуоресценции позвоночника интереса (F ы), трансфицированных но небеленой регионе (контроль), и фона области (F б) в образах промежуток времени, используя инструмент "Интенсивность V Time Monitor 'из ImageJ (" плагинов '→' стеки - перетасовка '→' Интенсивность V Time Monitor "). Контроль региона может быть частью целенаправленной дистальных дендрита. Фон регионе не является люминесцентная регионе.
- Рассчитать фотообесцвечивания ставка (г), сравнивая флуоресценции контрольного региона до (F c0) и после (F в) фотообесцвечивания.
г = F C / F с0. - Нормализация интенсивности флуоресценции целевой позвоночника (F) следующим образом:
F = (F ы - F б) / r. - Кривая соответствует интенсивности флуоресценции целевой позвоночника с однофазной экспоненциальным уравнением программного обеспечения Призма GraphPad (рис. 2) или КетеГ подобного программного обеспечения.
- Рассчитать мобильных фракции (е м) и неподвижные фракции (е я) следующими уравнениями:
F M = F ∞ / F 0,
где F ∞ является интенсивность флуоресценции после полного восстановления, а F 0 является интенсивность флуоресценции до фотообесцвечивания.
F = 1 - е м.
4. Представитель Результаты:
В этом исследовании мы проводим эксперимент по FRAP зрелых нейронов гиппокампа. На 18-22 DIV, грибы шипы уже сформировались. Используя наш метод, динамические изменения интенсивности флуоресценции в небольшой области, например, позвоночника, могут быть записаны.
Для анализа флуоресценции процесс восстановления EGFP, мы берем 5 изображений в качестве контроля перед отбеливанием, а затем 1 изображение каждые 1 секунды сразу после отбеливания в течение 15 секунд. Разрешение изображения достаточно для количественного анализа. Флуоресценции профилей восстановления меченых флуоресценции белков высокой воспроизводимостью.
Мы также кратко показать, как определить подвижные и неподвижные доли флуоресценции белка, используя ImageJ и GraphPad Призма программного обеспечения. Метод FRAP и анализа мы показываем здесь, могут быть широко использованы в неврологии, клеточной биологии и других исследований.

Рисунок 1. FRAP измерения флуоресценции EGFP в позвоночнике от культурных гиппокампа нейрона. Красные стрелки указывают время фотообесцвечивания. Фотографии представляют той же области до (Pre) и 0, 1, 5, 10, 15 секунд после фотообесцвечивания. Отделе позвоночника, контроль и фона, помечены буквами S, C и B, соответственно. Нейроны были сохранены при 37 ° С в течение эксперимента. Шкала бар, 1 мкм.
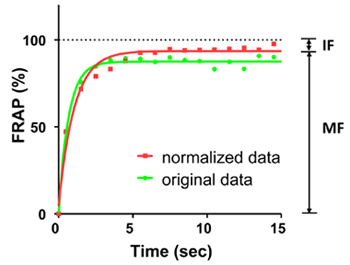
Рисунок 2. FRAP кривых флуоресценции EGFP в течение 15-секундного периода. Зеленая линия показывает оригинальной кривой, красная линия показывает нормированный кривой. Точками на кривых показывают FRAP каждую 1 секунду. Кривые были установлены на одну фазу показательные уравнения. Средний флуоресценции до фотообесцвечивания считался 100%. В этом эксперименте мобильных фракции (MF) составляет 94%, а неподвижные фракции (ИФ) составляет 6%.
Обсуждение
FRAP анализ был широко используются в естественных условиях и в пробирке 1-2 исследований. Эта техника широко использует GFP слитых белков , хотя она может также использовать красные водоросли белков слияния 3. Этот анализ чувствительны и могут быть использованы для характеристики мобильности GFP с метками белков.
Для получения полноценного анализа FRAP, важно, чтобы избежать ненужных фотообесцвечивания до и во время FRAP эксперимента. Есть два пути для достижения этого. Во-первых, процесс поиска и наблюдения экспериментальных нейрон должен быть быстрым. В частности, наблюдения нейронов с 100X цель в течение длительного времени значительно отбеливает флуоресценции. Во-вторых, высокая мощность лазерного сканирования и частые часто увеличивают возможность фотообесцвечивания. Таким образом, необходимо будет рассчитать фотообесцвечивания ставка в контрольной области, а затем нормализовать FRAP кривой в экспериментальной области. Нормализации метод был описан в протоколе (см. шаг 3.3-3.5 право).
Фотообесцвечивания шаг также решающее значение для обеспечения хороших результатов FRAP. В этом эксперименте мы отбеливателя позвоночника интерес в 10 раз при 100 передачи лазерного%. Это условие является достаточным, чтобы отбелить флуоресценции позвоночника к фоновому уровню в фиксированном подготовки. Таким образом, мы устанавливаем интенсивности флуоресценции на тот же номер в качестве фона на 0 секунд после фотообесцвечивания. В зависимости от скорости первого сканирования, значительное количество флуоресценции восстановления, возможно, уже обнаружена, когда белок является очень мобильны.
Многие флуоресцентных зондов белка были разработаны для изучения динамики белков с FRAP. Дополнительный подход является, например, использовать фотоактивируемых GFP (PA-GFP), или photoconvertible вариантов. Вместе с FRAP техники, эти инструменты становятся необходимыми для живой клетки диагностическая визуализация 4-6.
Раскрытие информации
Благодарности
Работа выполнена при поддержке Национального института глухоты и других расстройств связи (NIDCD) Внутренние программы.
Материалы
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| 35 mm glass-bottom dishes | MatTek | P35GC-1.0-14-C | ||
| CalPhos Mammalian Transfection Kit | Clontech | 631312 | ||
| pEGFP-N1 plasmid | Clontech | 6085-1 | ||
| Zeiss confocal microscope | Zeiss | LSM 710 | ||
| Zeiss TempModule system | Zeiss | N.A. | ||
| ImageJ software | NIH | N.A. | ||
| Graphpad Prism software | Graphpad software | N.A. |
Ссылки
- Zheng, C. Y., Petralia, R. S., Wang, Y. X., Kachar, B., Wenthold, R. J. SAP102 is a highly mobile MAGUK in spines. J Neurosci. 30, 4757-4766 (2010).
- Grati, M. Rapid turnover of stereocilia membrane proteins: evidence from the trafficking and mobility of plasma membrane Ca(2+)-ATPase 2. J Neurosci. 26, 6386-6395 (2006).
- Liu, L. N., Aartsma, T. J., Thomas, J. C., Zhou, B. C., Zhang, Y. Z. FRAP Analysis on Red Alga Reveals the Fluorescence Recovery Is Ascribed to Intrinsic Photoprocesses of Phycobilisomes than Large-Scale Diffusion. PLoS ONE. 4, e5295-e5295 (2009).
- Wiedenmann, J., Nienhaus, G. U. Live-cell imaging with EosFP and other photoactivatable marker proteins of the GFP family. Expert Rev Proteomics. 3, 361-374 (2006).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. J Cell Sci. 120, 4247-4260 (2007).
- Sprague, B. L., McNally, J. G. FRAP analysis of binding: proper and fitting. Trends Cell Biol. 15, 84-91 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены