Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Untersuchung Darmentzündungen in DSS-induzierten Modell der IBD
In diesem Artikel
Zusammenfassung
Experimentelle Modelle von chronisch entzündlichen Darmerkrankungen haben uns erlaubt, die komplexen angeborenen und adaptiven Immunantwort mit Pathogenese assoziiert zu untersuchen. Mit histologische Scoring, Quantifizierung von pro-inflammatorischen Zytokinen und Myeloperoxidase-Aktivität, kann man anfangen, diese Reaktionen in chronisch entzündlichen Darmerkrankungen gesehen zu beurteilen.
Zusammenfassung
Entzündliche Darmerkrankungen (IBD) umfasst eine Reihe von Darm-Erkrankungen, die häufigste die Colitis ulcerosa (UC) und Morbus Crohn (CD) sind. Beide UC und CD, wenn sie in den Dickdarm, erzeugen ein ähnliches Symptom Profil, Durchfall, rektale Blutungen, Bauchschmerzen und Gewichtsverlust umfassen kann. 1 Obwohl die Pathogenese der CED ist nicht bekannt, wird es als eine multifaktorielle Erkrankung, die sowohl beinhaltet beschrieben genetische und umweltbedingte Komponenten. 2
Es gibt zahlreiche und variable Tiermodellen der Kolon-Entzündung, die mehrere Funktionen von IBD ähneln. Tiermodelle der Kolitis reichen von denjenigen, die sich spontan in empfindliche Stämme bestimmter Arten auf diese erfordern Gabe von bestimmten Konzentrationen von Colitis-induzierende Chemikalien wie Natrium-Dextransulfat (DSS). Chemisch-induzierte Modelle Darmentzündungen sind die am häufigsten verwendete und am besten beschriebenen Modelle der IBD. AdminiStration der DSS im Trinkwasser produziert akute oder chronische Kolitis in Abhängigkeit von der Verwaltung Protokoll. 3 Tiere gegeben DSS zeigen Gewichtsverlust und Zeichen von weichem Stuhl oder Durchfall, manchmal mit Anzeichen von rektale Blutungen. 4,5 Hier beschreiben wir die Methoden, mit denen Colitis Entwicklung und die daraus resultierenden entzündlichen Reaktion kann nach der Verabreichung von DSS charakterisiert werden. Zu diesen Methoden zählen die histologische Analyse der Hämatoxylin / Eosin gefärbt Doppelpunkt Abschnitte, die Messung des pro-inflammatorischen Zytokinen, und die Bestimmung von Myeloperoxidase (MPO)-Aktivität, die als Surrogat-Marker für Entzündungen verwendet werden kann. 6
Das Ausmaß der entzündlichen Reaktion in Krankheit Zustand kann durch das Vorhandensein von klinischen Symptomen oder durch Veränderung in der Histologie in Schleimhautgewebe bewertet werden. Colonic histologischen Schadens wird durch die Verwendung eines Scoring-System, dass der Verlust der Krypta Architektur-, Entzündungs-Zell-Infiltration, Muskel-t hält bewertethickening, Pokal-Zell-Depletion, und die Krypta Abszess. 7 Quantitativ lässt Ebenen des pro-inflammatorischen Zytokinen mit akuten entzündlichen Eigenschaften, wie z. B. Interleukin (IL)-1β, IL-6 und Tumor Nekrose Faktor (TNF)-α, ermittelt werden konventionellen ELISA-Verfahren. Darüber hinaus kann der MPO-Aktivität gemessen mit einem kolorimetrischen Assay werden und als ein Index der Entzündung. 8
In experimenteller Colitis, ist die Schwere der Erkrankung oft mit einem Anstieg der MPO-Aktivität und ein höheres Niveau von pro-inflammatorischen Zytokine korreliert. Colitis Schwere und Entzündungen-assoziierten Schäden können durch die Untersuchung Stuhlkonsistenz und Blutungen, die neben der Beurteilung der histopathologischen Zustand des Darms mit Hämatoxylin / Eosin gefärbt Kolon Abschnitte beurteilt werden. Kolon-Fragmente können verwendet werden, um MPO-Aktivität und Zytokin-Produktion zu bestimmen. Zusammengenommen können diese Maßnahmen verwendet werden, um die intestinale Entzündungsreaktion in auszuwertenTiermodellen der experimentellen Kolitis.
Protokoll
1. Mausmodell der DSS-induzierten akuten Colitis
- Add Dextransulfat-Natrium (DSS) auf autoklaviert Trinkwasser, um die gewünschte Endkonzentration (1-5%) (wt / vol) (dh zu einer 5% DSS-Lösung zu machen, fügen Sie 25 mg DSS Pulver auf 500 ml Wasser autoklaviert) . Stammlösung kann bei Raumtemperatur stehen gelassen werden für bis zu 1 Woche oder bei 4 ° C bis zur Verwendung.
- In einem Biosicherheit Kapuze, pour Lager DSS-Lösung in 50 mL Falcon-Röhrchen (eine pro Käfig erforderlich). Halten Sie die Stammlösung zu Nachfüllrohr, wenn nötig.
- Ersetzen Sie Trinkwasser in jeder Maus Käfig mit dem DSS-Lösung (in der 50 ml Falcon-Röhrchen) (Die Dauer hängt von der DSS Regime, das verwendet wird ab. Zum Beispiel mit 6-8 Wochen alten männlichen C57BL / 6 Mäusen, wir verwalten 5% DSS-Lösung für insgesamt fünf Tage). Mäuse sollten keinen Zugang zu einer anderen Wasserquelle. Control-Mäuse sind autoklaviert Trinkwasser ohne DSS gegeben.
- Wiegen Mäusen täglich und den Betrag der DSS pro Tag verbraucht. Top jedesFlasche zu 50 ml nach der Aufnahme DSS Ebenen. Dies ist die ungefähre Volumen des DSS pro Käfig pro Maus während der gesamten Dauer des Experiments konsumiert zu messen. In unseren Untersuchungen verwenden wir eine 5% DSS-Lösung für 5 Tage mit männlichen C57BL / 6 Mäusen. Deutlicher Gewichtsverlust, veränderte Stuhlkonsistenz und Anzeichen von Blut im Stuhl sind so früh wie Tag 3 mit diesem speziellen DSS Regime gesehen. Während der DSS Verwaltung, zeigen Mäuse ausgeprägter Gewichtsverlust (ca. 5-10% ihres ursprünglichen Gewichts an Tag 5) mit Gewichtsverlust von mehr als 20% des ursprünglichen Gewichts mit Austrocknung und Durchfall auf die wesentlichen physiologischen Indikator dafür, dass ein Tier an oder ist in der Nähe Endpunkt. Wenn das Tier ist der Zugang zu normalem Wasser nach dem 5 Tage 5% DSS gegeben, wird es innerhalb von 7 Tagen zu erholen. Alle Versuche sollten durch die Institution Tier Ethikkommission genehmigt werden und werden in Übereinstimmung mit dem genehmigten Tier Utilization Protocol (AUP).
- Während der Dauer des Experiments, ein Disease Activity Index (DAI)Gäste können bewertet, um die klinische Progression der Colitis bewerten. Das DAI ist der kombinierte Score von Gewichtsverlust im Vergleich zu ursprünglichen Gewichts, Stuhlkonsistenz und Blutungen. Scores sind wie folgt definiert: Gewichtsverlust: 0 (kein Verlust), 1 (1-5%), 2 (5-10%), 3 (10-20%) und 4 (> 20%); Stuhlkonsistenz: 0 (normal), 2 (lose Stuhl) und 4 (Durchfall) und Blutungen: 0 (kein Blut), 1 (Hemoccult positiv), 2 (Hemoccult positive und visuelle Pellet Blutungen) und 4 (Brutto-Blutungen, Blut um Anus). DAI können täglich während der Dauer der DSS-Behandlung erzielt werden.
- Zum Zeitpunkt der Wahl, zu wiegen und zu opfern Mäusen. Mäuse können durch Genickbruch nach Inhalation von Isofluran oder durch eine andere Methode, mit der Institution Tierhaltung genehmigt eingeschläfert werden.
2. Sammeln colonic Gewebeproben
- Expose der Bauchseite des Tieres und nassen Bauch-Bereich mit 70% Ethanol-Lösung. An dieser Stelle finden Sie in Tabelle 1 beziehen, und notieren Sie einesny Anzeichen von rektalen Blutungen (Blut vorhanden an der Afteröffnung) oder Rektumprolaps in jedem Tier.
- Verwenden Sie Standard-Präparierscheren auf den Bauch, indem sie einen ventralen Medianschnitt incise.
- Suchen Sie den Doppelpunkt und Transekt den Doppelpunkt als der Darmkrebs-Marge nahe wie möglich am distalen Kolon frei.
- Vorsichtig und langsam herausziehen die ganze Dickdarm, da er vom umgebenden Mesenterium.
- Transect den Doppelpunkt am colonocecal Marge auf das proximale Ende des Dickdarms frei. Kot kann durch Spülen Doppelpunkt mit sterilem PBS mit einem Magensonde Nadel ein 3 oder 5 ml-Spritze oder durch vorsichtiges Quetschen es aus mit einem Paar von gebogenen Pinzette / Zange entfernt werden. Mit den ganzen Dickdarm, für Schäden zu beurteilen (siehe Abschnitt 3.1)
- Gewebeentnahme zur histologischen Untersuchung und andere Tests können durch Schneiden 0,5 cm bis 1,0 cm langen Colon-Fragmente Nennung welchem Bereich wird die Probe aus durchgeführt werden (dh proximalen, mittleren oder distalen).
- Gewebeprobenverwendet für die Tests können einzeln in 1,5 ml Eppendorf-Röhrchen platziert werden und in flüssigem Stickstoff eingefroren und bis zur Verwendung gelagert bei -70 ° C werden
3. Beurteilung der Schwere Colitis
- Makroskopische oder Schwere der Erkrankung Score ist unheilbar von einem unvoreingenommenen Beobachter mit einem zuvor veröffentlichten Scoring-System (Tabelle 1) beurteilt. 9 Stuhlkonsistenz kann durch die Verwendung einer Pinzette und Drücken auf dem Stuhl, um die Konsistenz zu bestimmen beurteilt werden. Um zu bestimmen, eine Partitur für Blut im Stuhl, beachten Sie die Farbe des Kots (dh schwarzen Stuhl gegenüber hellbraunen Stuhl) und eine weitere Bestätigung mit einer Hemoccult testen. Mit dem Scoring-System, bestimmen eine Punktzahl für jede der Bedingungen. Die endgültige makroskopische Score für jedes Tier ist die Summe der einzelnen Gastes.
- Zur Beurteilung histologischen Schadens von Colitis Schwere, schneiden Sie ein kleines Fragment (0,5 cm) des Dickdarms, in einem Gewebekassette und tauchen in gepufferter 10% Formalin-Lösung. Bereiten Sie 5um in Paraffin eingebettete Schnitte und Flecken Abschnitte mit Hämatoxylin / eoxin (H & E) mit den entsprechenden Verfahren. Colon-Fragmente aus dem proximalen, mittleren Doppelpunkt oder distalen Abschnitt des Dickdarms genommen werden.
- H & E gefärbten Kolon Abschnitte sind durch eine verblindete Beobachter mit einem zuvor veröffentlichten System für folgende Maßnahmen erzielt: (- schwere Krypta Verzerrung mit dem Verlust der gesamten Krypten, 3 normal, 0), dem Grad der entzündlichen Zellinfiltration (normal, 0 Krypta Architektur - dichten entzündlichen Infiltrat, 3), Muskel-Verdickung (Basis Krypta sitzt auf der muscularis mucosae, 0 - markiert Muskel Verdickung vorhanden ist, 3), Kelch-Zell-Depletion (fehlende, 0 - vorhanden ist, 1) und die Krypta Abszess (abwesend, 0 - Gegenwart , 1). 7 Die histologischen Schadens-Score ist die Summe der einzelnen Gastes. Es ist anzumerken, dass im Gegensatz zu menschlichen UC, Kryptenabszesse nicht charakteristisch für dieses Modell und sind selten zu sehen; mikroskopische Ulzerationen sind ebenfalls selten. Wenn mehrere Doppelpunkt Schnitte wurdengebeizt, histologischen Scores zwischen ähnlichen Abschnitten sollten verwendet werden, um das Endergebnis für den jeweiligen Bereich (dh histologische Ergebnis in proximalen Kolon im Vergleich zu histologischen Score in distalen Kolon) zu bestimmen.
4. Stammlösungen von Reagenzien für die Tests
- Bereiten Sie eine 50 mM Lösung von Kaliumphosphat-Puffer, indem Lösung B (K 2 HPO 4, 8,7 g zweibasische Kaliumphosphat in 1 l dH 2 O) zu Lösung A (KH 2 PO 4, 6,8 g einbasiges Kaliumphosphat in 1L von dH 2 O) bis zu einem pH von 6,0 erreicht ist. Verbleibende Lösungen können im Kühlschrank (2-8 ° C) bis zum späteren Gebrauch gespeichert werden.
- Bereiten Hexadecyltrimethylammoniumbromid (HTAB) Puffer durch Zugabe von 5 g HTAB in 1 l Kaliumphosphatpuffer (50 mM, pH = 6,0). Gently Hitze sich auflösen und bei 2-8 ° C lagern bis zum Gebrauch. Bei Bedarf Wärme wieder auflösen.
- Bereiten Lysepuffer für Tissue Homogenisierung für Protein-AnalyseZugabe von 10 ml 1 M Tris-Salzsäure (pH = 8,0), 6 ml 5M Natriumchlorid und 2 ml Triton X-100 bis 182 ml sterilisiertem destilliertem Wasser. Triton X-100 ist sehr zähflüssig bei Raumtemperatur und sollte daher vorsichtig erwärmt, vor der Verwendung. Die vorbereiteten Lysepuffer kann bei -20 ° C bis zur Verwendung gelagert werden.
5. Probenvorbereitung für Tests
- Probenvorbereitung für MPO-Analyse.
- Nehmen Sie Proben von -70 ° C und auf Eis stellen. Das Gewicht jeder Probe nach dem Entfernen keine sichtbaren Rückstände oder Fett mit einem gebogenen ForceP / Pinzette und in einen 2 ml Eppendorf Safe-Lock Mikrozentrifugenröhrchen (oder Rohr, das mit einem Homogenisator verwendet werden können). Die Proben sollten auf Eis zu allen Zeiten gehalten werden. Es ist wichtig zu beachten, dass ähnliche Doppelpunkt Fragmente aus jeder biologischen replizieren (dh distalen Abschnitte nur oder proximalen Abschnitte nur) verwendet werden.
- Add Homogenisator Wulst zu jedem Probenröhrchen.
- Fügen Sie die entsprechende Menge an HTAB buffer nach Gewebe Gewicht. Wenn Gewebe Gewicht beträgt weniger als 25 mg, fügen Sie den Puffer bei einem Verhältnis von 12.5mg/mL, wenn Gewebe Gewicht liegt zwischen 25-50, bei einem Verhältnis von 25mg/ml hinzuzufügen. Wenn Gewebe Gewicht größer als 50, add-Puffer bei einem Verhältnis von 50mg/ml.
- Homogenisieren mit einem Gewebe-Homogenisator für 4 min bei 30 Hz. Wiederholen Sie, wenn Gewebe nicht vollständig homogenisiert.
- Entfernen Homogenisator Wulst und Zentrifuge für 6 min (13400 xg, 4 ° C).
- Sammeln Überstand und entsorgen Sie die resultierende Pellet. Überstand kann bei -70 ° C bis zur Verwendung gelagert werden.
- Probenvorbereitung für die Zytokin-Analyse.
- Wiederholen Sie die Schritte 5.1.1. auf 5.1.2.
- Dann werden 50 ul von Protease-Inhibitor-Cocktail (PIC) zu 10 mL der vorbereiteten Lysepuffer.
- 1 ml der PIC und Lysepuffer Lösung für jede Probe, unabhängig von Gewicht.
- Homogenisieren für 5 min bei 30 Hz. Wiederholen Sie, wenn Gewebe nicht vollständig homogenisiert.
- Entfernen Homogenisator Wulst und Zentrifuge Löfür 5 min bei 3300 x g.
- Sammeln Überstand und entsorgen Sie die resultierende Pellet. Überstand kann bei -70 ° C bis zur Verwendung gelagert werden.
6. Die Quantifizierung der Entzündungsmarker
- MPO-Aktivitätstest
- Bereiten o-Dianisidin dihydrochlorid (o-Dianisidin)-Lösung durch die Kombination von 16,7 mg o-Dianisidin Dihydrochlorid, 90 ml dH 2 O und 10 ml Kaliumphosphatpuffer. Diese Lösung sollte bereit für jeden Test frisch angesetzt werden.
- Add 7 ul der Gewebehomogenat (hergestellt in Abschnitt 5.1) in dreifacher Ausfertigung in einer 96-Well-Platte.
- Dann werden 50 ul der verdünnten H 2 O 2 (4 ul von 30% H 2 O 2 in 96 ul dH 2 O verdünnt) auf die o-Dianisidin Mischung.
- Verwenden Sie einen Multi-Kanal-Pipette auf 200 ul des o-Dianisidin Gemisch aus H 2 O 2 für jede der Vertiefungen hinzu.
- Messen Sie die Absorption bei 450 nm mit einem Spektrophotometertometer. Nehmen Sie drei Lesungen in 30 Sekunden Intervallen.
- Berechnen MPO-Aktivität. MPO-Aktivität wird in Einheiten (U) des MPO / mg Gewebe, wobei eine Einheit von MPO als die benötigte Menge an 1 mol H 2 O 2 pro Minute bei Raumtemperatur zersetzen definiert wird gemessen. Man bedenkt, dass eine Einheit (U) der MPO = 1 mol H 2 O 2 gespalten und die 1 umol von H 2 O 2 eine Änderung der Absorption von 1,13 x 10 -2 nm / min liefert, ist Einheiten der MPO in jeder Probe bestimmt als Änderung der Absorption [&Dgr; (t 2-t 1)] / Δmin x (1,13 x 10 -2). Um Einheiten pro mg Gewebe, die Gewebe: Puffer-Verhältnis. Zum Beispiel, wenn ein Gewebe: Puffer-Verhältnis von 50 mg / mL eingesetzt wurde, in 7 ul Homogenat, gibt es 0,35 mg Gewebe. Deshalb, um Einheiten pro mg Gewebe zu bekommen, teilen sich die Einheiten der MPO von 0,35. Ein Rechenbeispiel mit Extinktionswerte (nm) ist unten (unter der Annahme, dass die Probe in dreifacher Ausfertigung hinzugefügt wurde) enthalten:
| Probe | Zeit 0 Sek. | 30 sec. | 60 Sekunden | ||||||
| A | 1 | 2 | 3 | 1 ' | 2 ' | 3 ' | 1 " | 2'' | 3 " |
| 0,048 | 0,048 | 0,051 | 0,061 | 0,061 | 0,065 | 0,074 | 0,073 | 0,078 | |
- Durchschnittliche Zeitpunkt 0 sec = (0,048 + 0,048 + 0,051) / 3 = 0,049 nm
- Durchschnittliche bei Time 30 sec = 0.0623 nm
- Durchschnittliche bei Time 60 sec = 0,075 nm
- Änderung der Absorption (&Dgr;) 0 bis 30 Sek. / mg Gewebe (vorausgesetzt, 50 mg / ml Gewebe: Puffer-Verhältnis) = [(0,0623 bis 0,049) / (1,13 x 10 -2)] / 0,35 = 3,363
- Ändern Sie in absorbierenversicherung (&Dgr;) 30 bis 60 Sek. / mg Gewebe = 3,211
- * MPO-Aktivität (U / mg Gewebe) = Durchschnitt der &Dgr; (0-30) und &Dgr; (30-60) = 3,287
- Die Quantifizierung der pro-inflammatorischen Zytokinen durch ELISA
- Cytokine (IL-1β, IL-6 und TNF-α) bestimmt werden können mit handelsüblichen enzyme-linked immunosorbent assay (ELISA)-Kit (Quantikine Murine; R & D Systems).
- Extinktionswerte voneinander ELISA ist normiert mit einem Bradford-Protein-Assay jeweiligen jeder Probe und wird in Einheiten von pg / mg Protein ausgedrückt.
7. Repräsentative Ergebnisse
Die Verwaltung der entsprechenden DSS Regime wird akuter Kolitis in Mäusen zu induzieren. Während der Dauer der DSS-Behandlung kann DAI dient der Beurteilung und Bewertung der klinischen Progression der Krankheit sein. Tiere mit DSS behandelt wird zeigen signifikanten Gewichtsverlust im Vergleich zu ihrer ursprünglichen Gewichte, weicher Stuhl und fäkaleBlutungen (Abbildung 1). Bei Opfer und Untersuchung des Dickdarms ist die Schwere der Colitis makroskopisch basierend auf Verkürzung der Doppelpunkt Länge, Kolon-Blutungen, fäkale Blutungen, Lockerung der Stuhlkonsistenz erzielte, und Anzeichen einer rektalen Blutungen, die Kontrollen nur mit Wasser behandelt wurden, verglichen (Abbildung 2 und Tabelle 1). Querschnitte von Kolon-Gewebeproben mit H & E gefärbten haben höhere histologischen Scores für DSS-behandelte Doppelpunkte im Vergleich zu Wasser-behandelten Kontrollen (Abbildung 3). Zur weiteren Charakterisierung der Ausdehnung der Entzündung in DSS-behandelten Mäusen, können MPO-Aktivität aus homogenisierten colonic Gewebeproben beurteilt werden. DSS-behandelte Doppelpunkte haben höhere MPO-Aktivität im Vergleich zur Kontrollgruppe (Abbildung 4). Darüber hinaus ist dies mit erhöhten Konzentrationen von pro-inflammatorischen Zytokine (IL-1β, IL-6, TNF-α) (Abbildung 5) verbunden ist.
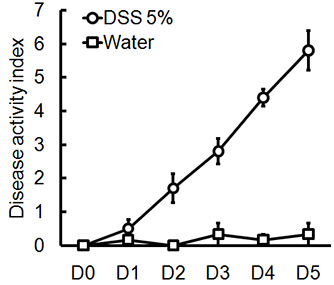
Abbildung 1. Männlich, wurden C57BL / 6 Mäusen 5% DSS im Trinkwasser über 5 Tage. DAI Scores wurden täglich für jedes Tier untersucht und waren pro Tag für jede Gruppe im Durchschnitt (Mittelwert ± SEM, n = 4 Mäuse / Gruppe).
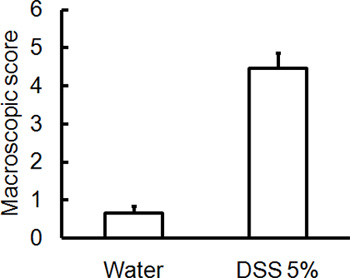
Abbildung 2. C57BL / 6 Mäuse wurden 5% DSS im Trinkwasser über 5 Tage. Kontrollmäuse erhielten Wasser ohne DSS. Makroskopische Schaden des Gastes / der Schwere der Erkrankung Scores wurden blind auf Tag 5 nach der DSS-induzierter Kolitis beurteilt. Doppelpunkte von Mäusen, die DSS erhalten isoliert haben höhere makroskopische Schädigung Scores (rektale Blutungen, Rektumprolaps, Durchfall, Blutungen Kolon), was größer ist die Schwere der Erkrankung (Mittelwert ± SEM, n = 4 Mäuse / Gruppe).
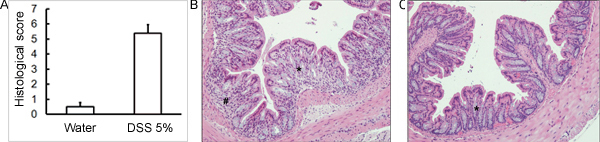
Abbildung 3. C57BL / 6 Mäuse wurden 5% DSS-Lösung im Trinkwasser gegeben, um Kolitis induzieren. Kontrollmäuse erhielt Wasser ohne DSS. (A) Histologische Scores wurden blind ausgewertet H & E gefärbten Kolon Gewebeschnitten am Tag 5 post-DSS Verwaltung gesammelt. (B) DSS-behandelten Proben zeigen mehr histologischen Schäden (mehr zellulärer Infiltration, mehr Becherzellen Zell-Depletion, größere Verzerrungen / Beschädigung Krypta Architektur) im Vergleich zu (C) Kontrollen (Mittelwert ± SEM, n = 4 Mäuse / Gruppe). In (B) und (C), zeigt Stern (*) Bereich der Kelch Zell-Depletion und Verzerrung der Krypta Architektur; Nummernzeichen (#) gibt zelluläre Infiltration.
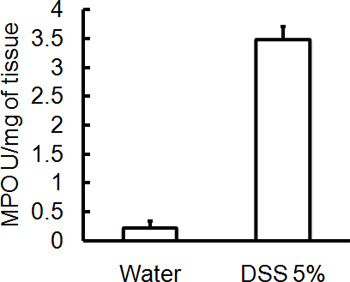
Abbildung 4. Alle Mäuse wurden am Tag 5 nach der Verabreichung von DSS und Kolon Gewebeproben geopfert wurden gesammelt, um MPO-Aktivität zu bewerten. Der Schweregrad der DSS-induzierte Colitis ist mit einem höheren MPO-Aktivität im Vergleich zur Kontrollgruppe (Mittelwert ± SEM, n = 4 Mäuse / Gruppe) verbunden sind.
_upload/3678/3678fig5.jpg "/>
Abbildung 5. Neben höheren MPO Ebenen, die Schwere der DSS-induzierte Colitis ist ebenso mit einem erhöhten Maß an pro-Entzündung Zytokine wie IL-1β, IL-6, TNF-α (Mittelwert ± SEM, n = 4 Mäusen assoziiert / Gruppe).
Tabelle 1. Makroskopische / Disease Severity Score
| Partitur | Rektale Blutungen | Rektumprolaps | Stuhlkonsistenz | Blut |
| 0 | Keiner | Keiner | Normal | Normal |
| 1 | Rot | Signs of Prolaps | Weich | Rot |
| 2 | Dark Red | Klare Prolaps | Sehr weich | Dunkelrot |
| 3 | Gross Blutungen | Umfangreiche Prolaps | Durchfall | Schwarz |
Diskussion
DSS Kolitis ist eine weit verbreitete chemisch induzierten Modell der Darmentzündung. In diesem Modell Mäuse sind Trinkwasser mit DSS, die dachten, dass sie giftig ist, Epithelzellen Darm und stören die Integrität der mukosalen Barriere ergänzt gegeben. 10 Administration von DSS induziert eine akute Kolitis, die von weichem Stuhl, Kot Blutungen gekennzeichnet ist, und Infiltration mit Granulozyten. 10 Während DSS Verwaltung ist ulcerosa in der Regel mit erheblichen Gewichtsverlust und Anwesen...
Offenlegungen
Keine Interessenskonflikte erklärt.
Danksagungen
Diese Arbeit wird durch Zuschüsse aus kanadischen Institutes of Health Research (CIHR) und Morbus Crohn und Colitis Foundation von Kanada (CCFC) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Ausstattung: | Firma | Katalog-Nummer | Kommentare |
| Eppendorf Safe-Lock Mikrozentrifugenröhrchen (2 mL) | eppendorf | 0030 120.094 | |
| Biotek EL808 Absorption Plattenlesegerät | Biotek | EL808 | |
| Dextransulfat Natriumsalz analysenreines (Molekulargewicht 36,000-50,000 Da) | MP Biomedicals | 160110 | |
| Gen5 (Software) | Biotek | Version 1.10.8 | |
| Hexadecyltrimethylammoniumbromid (HTAB) | Sigma-Aldrich | H5882-100G | |
| Wasserstoffperoxid, 30 Gew..% Ige Lösung in Wasser | Sigma-Aldrich | 216763 | Lagerung bei 2-8 ° C |
| Microtest plaß 96-well Flachboden | Sarstedt | 82,1581 | Nur zum einmaligen Gebrauch |
| o-Dianisidin | Sigma-Aldrich | D-3252 | Lichtempfindlich. Lagerung bei 2-8 ° C |
| Kaliumphosphat, zweibasische | Caledon | 6620-1 | |
| Kaliumphosphat, einbasischen | EMD Chemicals | PX1565-1 | |
| Protease-Inhibitor-Cocktail | Sigma-Aldrich | P8340 | Lagerung bei -20 ° C |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Hartmetall-Kugeln für Tissue Lyser II | QUIAGEN | 69997 |
Referenzen
- Sands, B. E. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology. 126, 1518-1532 (2004).
- Danese, S., Fiocchi, C. Etiopathogenesis of inflammatory bowel diseases. World J. Gastroenterol. 12, 4807-4812 (2006).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Axelsson, L. G., Landstrom, E., Goldschmidt, T. J., Gronberg, A., Bylund-Fellenius, A. C. Dextran sulfate sodium (DSS) induced experimental colitis in immunodeficient mice: effects in CD4(+)-cell depleted, athymic and NK-cell depleted SCID mice. Inflamm. Res. 45, 181-191 (1996).
- Egger, B., Bajaj-Elliott, M., MacDonald, T. T., Inglin, R., Eysselein, V. E., Büchler, M. W. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency. Digestion. 62, 240-248 (2000).
- Krawisz, J. E., Sharon, P., Stenson, W. F. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models. Gastroenterology. 87, 1344-1350 (1984).
- Cooper, H. S., Murthy, S. N., Shah, R. S., Sedergran, D. J. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab. Invest. 69, 238-249 (1993).
- Smith, J. W., Castro, G. A. Relation of peroxidase activity in gut mucosa to inflammation. Am. J. Physiol. 234, R72-R79 (1978).
- Ghia, J. E., Blennerhassett, P., Kumar-Ondiveeran, H., Verdu, E. F., Collins, S. M. The vagus nerve: a tonic inhibitory influence associated with inflammatory bowel disease in a murine model. Gastroenterology. 131, 1122-1130 (2006).
- Okayasu, I., Hatakeyama, S., Yamada, M., Ohkusa, T., Inagaki, Y., Nakaya, R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98, 694-702 (1990).
- Solomon, L., Mansor, S., Mallon, P., Donnelly, E., Hoper, M., Loughrey, M., Kirk, S., Gardiner, K. The dextran sulphate sodium (DSS) model of colitis: an overview. Comparative Clinical Pathology. 19, 235-239 (2010).
- Mähler, M., Bristol, I. J., Leiter, E. H., Workman, A. E., Birkenmeier, E. H., Elson, C. O., Sundberg, J. P. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, G544-G551 (1998).
- Hans, W., Scholmerich, J., Gross, V., Falk, W. The role of the resident intestinal flora in acute and chronic dextran sulfate sodium-induced colitis in mice. Eur. J. Gastroenterol. Hepatol. 12, 267-273 (2000).
- Rath, H. C., Schultz, M., Freitag, R., Dieleman, L. A., Li, F., Linde, H., Schölmerich, J., Sartor, R. B. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect. Immun. 69, 2277-2285 (2001).
- Ghia, J. E., Li, N., Wang, H., Collins, M., Deng, Y., El-Sharkawy, R. T., Côté, F., Mallet, J., Khan, W. I. Serotonin has a key role in pathogenesis of experimental colitis. Gastroenterology. 137, 1649-1660 (2009).
- Elson, C. O., Beagley, K. W., Sharmanov, A. T., Fujihashi, K., Kiyono, H., Tennyson, G. S., Cong, Y., Black, C. A., Ridwan, B. W., McGhee, J. R. Hapten-induced model of murine inflammatory bowel disease: mucosa immune responses and protection by tolerance. J. Immunol. 157, 2174-2185 (1996).
- Dieleman, L. A., Ridwan, B. U., Tennyson, G. S., Beagley, K. W., Bucy, R. P., Elson, C. O. Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 107, 1643-1652 (1994).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten