É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Investigando inflamação intestinal em DSS-induzida Modelo de IBD
Neste Artigo
Resumo
Modelos experimentais de doença inflamatória intestinal nos permitiram analisar a complexa inata e adaptativa respostas imunes associadas com a patogênese. Usando pontuação histológico, quantificação de citocinas pró-inflamatórias e atividade da mieloperoxidase, pode-se começar a avaliar essas respostas visto na doença inflamatória intestinal.
Resumo
Doença inflamatória intestinal (DII) engloba uma gama de patologias intestinais, o mais comum dos quais são a colite ulcerosa (UC) e Doença de Crohn (DC). Ambos UC e CD, quando presentes no cólon, gerar um perfil de sintomas similares que podem incluir sangramento, diarréia retal, dor abdominal e perda de peso. 1 Embora a patogênese da DII permanece desconhecida, é descrita como uma doença multifatorial que envolve tanto componentes genéticos e ambientais. 2
Existem inúmeros modelos animais e variável de inflamação do cólon que se assemelham a várias funcionalidades do IBD. Modelos animais de colite gama daqueles surge espontaneamente em estirpes sensíveis de certas espécies para aqueles que requerem a administração de concentrações específicas de colite indutores de produtos químicos, como dextran sulfato de sódio (DSS). Química induzida por modelos de inflamação intestinal são os modelos mais usados e melhor descrito de IBD. Adminidemonstração de DSS na água potável produz colite aguda ou crônica, dependendo do protocolo de administração. 3 Animais dada a perda de peso DSS exposição e sinais de fezes moles ou diarréia, às vezes com evidências de sangramento retal 4,5. Aqui, descrevemos os métodos pelos quais colite desenvolvimento ea resposta inflamatória pode ser caracterizado após a administração de DSS. Estes métodos incluem a análise histológica de hematoxilina / eosina seções cólon manchado, medição de citocinas pró-inflamatórias, e determinação de mieloperoxidase (MPO), atividade que pode ser usado como um marcador da inflamação 6.
A extensão da resposta inflamatória em estado de doença pode ser avaliada pela presença de sintomas clínicos ou por alteração na histologia nos tecidos da mucosa. Dano histológico do cólon é avaliado por meio de um sistema de pontuação que considera perda de cripta arquitetura, infiltração de células inflamatórias, músculo thickening, a depleção de células caliciformes, e cripta abscesso. 7 Quantitativamente, os níveis de citocinas pró-inflamatórias agudas inflamatórias, como a interleucina (IL)-1β, IL-6 e fator de necrose tumoral (TNF)-α, pode ser determinada usando métodos convencionais de ELISA. Além disso, a atividade de MPO pode ser mensurado através de um ensaio colorimétrico e usado como um índice de inflamação. 8
Na colite experimental, a gravidade da doença é muitas vezes relacionada com um aumento na atividade MPO e os níveis mais altos de citocinas pró-inflamatórias. Gravidade e colite associada à inflamação danos podem ser avaliados através da análise de consistência das fezes e sangramento, além de avaliar o estado histopatológico do intestino usando hematoxilina / eosina secções de tecido do cólon. Fragmentos de tecido do cólon pode ser usado para determinar a atividade MPO e produção de citocinas. Juntas, essas medidas podem ser utilizadas para avaliar a resposta inflamatória intestinal emmodelos animais de colite experimental.
Protocolo
1. Modelo murino de DSS-induzida colite aguda
- Adicionar dextran sulfato de sódio (DSS) para água potável autoclavado à concentração final desejada (1-5%) (wt / vol) (ie Para fazer uma solução de DSS 5%, adicionar 25 mg de pó de DSS para 500 ml de água esterilizada) . Solução estoque podem ser deixados em temperatura ambiente por até uma semana ou a 4 ° C até o uso.
- Em uma capa de biossegurança, despeje solução DSS estoque em 50 mL Falcon tubos (um necessário por gaiola). Manter a solução de ações para tubos de recarga, quando necessário.
- Substituir a água potável em cada gaiola do mouse com a solução de DSS (em 50 mL tubos Falcon) (A duração vai depender do regime de DSS que é usado. Por exemplo, usando de 6-8 semanas, do sexo masculino C57BL / 6 ratos, nós administrar um solução DSS 5% para um total de cinco dias). Camundongos não devem ter acesso a qualquer outra fonte de água. Camundongos de controle são dadas de água potável autoclavado sem DSS.
- Pesar ratos diariamente e registrar a quantidade de DSS consumidos por dia. Top cadagarrafa para 50 mL após a gravação níveis DSS. Isto é para medir o volume aproximado de DSS consumida por gaiola por rato durante toda a duração do experimento. Em nossos estudos, utilizamos uma solução DSS 5% durante 5 dias com machos C57BL / 6 ratos. Perda significativa de peso, consistência das fezes alterado e sinais de sangue nas fezes são vistos como 3 º dia usando este esquema DSS particular. Durante a administração DSS, os ratos apresentam acentuada perda de peso (cerca de 5-10% de seu peso inicial no dia 5) com perda de peso superior a 20% do peso inicial com desidratação e diarréia ser o indicador fisiológico significativo que um animal é igual ou próximo ponto final. Se o animal é dado acesso à água normal após os 5 dias de DSS 5%, ele vai se recuperar dentro de 7 dias. Todos os experimentos devem ser aprovados pela instituição de origem animal comitê de ética e estar em conformidade com o Protocolo aprovado Utilização de Animais (AUP).
- Durante a duração do experimento, um índice de atividade da doença (DAI)pontuação pode ser avaliado para avaliar a evolução clínica de colite. A DAI é a pontuação combinada de perda de peso em relação ao peso inicial, a consistência das fezes, e sangramento. Pontuações são definidos da seguinte forma: perda de peso: 0 (sem perda), 1 (1-5%), 2 (5-10%), 3 (10-20%) e 4 (> 20%); consistência das fezes: 0 (normal), 2 (fezes), e 4 (diarréia); e sangramento: 0 (sem sangue), 1 (Hemoccult positivo), 2 (Hemoccult positiva e visual sangramento pellet), e 4 (sangramento grave, sangue ao redor ânus). DAI pode ser marcado por dia durante a duração do tratamento DSS.
- No ponto de tempo de escolha, pesar e sacrifício camundongos. Ratos podem ser sacrificados por deslocamento cervical após a inalação de isoflurano ou por outro método aprovado pela instalação da instituição de origem animal.
2. Coletar amostras de tecido do cólon
- Expor o lado ventral do animal e molhar a área do abdômen com uma solução de etanol 70%. Neste ponto, consulte a Tabela 1 e anote umany sinais de sangramento retal (presença de sangue no orifício anal) ou prolapso retal em cada animal.
- Uso padrão tesouras de dissecação de inciso do abdômen, fazendo uma incisão mediana ventral.
- Localize os dois pontos e transecto do cólon tão perto da margem colorectal possível para libertar o cólon distal.
- Cuidadosa e lentamente puxe todo o cólon, destacando-o do mesentério circundante.
- Transecto os dois pontos na margem colonocecal para libertar a extremidade proximal do cólon. As fezes podem ser removidas por lavagem de cólon com PBS estéril usando uma agulha de gavage ligada a uma seringa de 3 mL ou 5 ou com cuidado apertando-lo usando um par de pinças dobrados / forceps. Usando todo o cólon, avaliar por danos (Veja Seção 3.1)
- Amostras de tecido para análise histológica e outros ensaios pode ser feito cortando 0,5 centímetros a 1,0 cm de comprimento de fragmentos do cólon fazendo notar que a área da amostra é de (ie proximal, médio ou distal).
- Amostras de tecidoa ser utilizado para os ensaios podem ser colocados individualmente em tubos de 1,5 mL eppendorf e congelados em nitrogênio líquido e armazenadas até utilização a -70 ° C.
3. Avaliação da gravidade da colite
- Escore de gravidade macroscópica ou doença terminal é avaliado por um observador imparcial utilizando um sistema de pontuação previamente publicados (Tabela 1). 9 A consistência das fezes pode ser avaliada usando um par de fórceps e pressionando as fezes para determinar a consistência. Para determinar a pontuação de sangue nas fezes, observe a cor das fezes (ou seja, fezes pretas versus luz fezes marrom) e validar ainda mais usando um teste Hemoccult. Usando o sistema de pontuação, determine uma pontuação para cada uma das condições. A pontuação final macroscópica para cada animal é a soma de cada pontuação individual.
- Para avaliar os danos histológicos de gravidade colite, corte um pequeno fragmento (0,5 cm) do cólon, coloque em um cassete de tecido e mergulhe numa solução formalina a 10%. Prepare 5parafina mM incorporados seções transversais e secções mancha com hematoxilina / eoxin (H & E), utilizando os procedimentos adequados. Fragmentos de cólon podem ser tomadas a partir da proximal, cólon médio, ou seção distal do cólon.
- H & E manchada secções de tecido do cólon são marcados por um observador cego usando um sistema previamente publicados para as seguintes medidas: cripta arquitetura (normal, 0 - distorção cripta grave com perda de criptas inteiro, 3), grau de infiltração de células inflamatórias (normal, 0 - denso infiltrado inflamatório, 3), espessamento do músculo (base da cripta fica na mucosa muscular, 0 - apresentam espessamento marcado muscular, 3), depleção de células caliciformes (ausente, 0 - presente, 1) e abscesso crypt (ausente, 0 - presentes , 1). 7 A pontuação dano histológico é a soma de cada pontuação individual. Deve-se notar que, ao contrário humana UC, abscessos da cripta não são características deste modelo e raramente são vistos; ulcerações microscópicas também são raras. Se seções cólon múltiplas forammanchado, escores histológicos entre as seções semelhantes devem ser usados para determinar a pontuação final para cada área (ou seja, pontuação histológica no cólon proximal contra pontuação histológica no cólon distal).
4. Preparar soluções estoque de reagentes para testes
- Prepare uma solução de 50 mM de tampão fosfato de potássio pela adição de solução B (K 2 HPO 4, 8,7 g de fosfato de potássio dibásico em 1 L de dH 2 O) para a solução A (KH 2 PO 4, 6,8 g de fosfato monobásico de potássio em 1L de dH 2 O) até que um pH de 6,0 é conseguido. Soluções restantes podem ser armazenados em geladeira (2-8 ° C) até o uso futuro.
- Prepare hexadeciltrimetilamônio brometo de buffer (HTAB) pela adição de 5 g HTAB em 1 L de tampão fosfato de potássio (50 mM, pH = 6,0). Aquecer lentamente para dissolver e armazenar de 2-8 ° C até o uso. Quando necessário, o calor para re-dissolver.
- Prepare tampão de lise para homogeneização de tecido para análise de proteínas poradição de 10 mL de ácido tris-1M clorídrico (pH = 8,0), 6 mL de cloreto de sódio 5M e 2 mL de Triton X-100-182 mL de água destilada esterilizada. Triton X-100 é muito viscoso à temperatura ambiente e, portanto, deve ser suavemente aquecido antes do uso. O tampão de lise preparado pode ser armazenado a -20 ° C até o uso.
5. Preparação de amostras para ensaios
- Preparação de amostras para análise MPO.
- Remover amostras de -70 ° C e colocar no gelo. Registre o peso de cada amostra após a remoção de qualquer fezes ou gordura visível usando um fórceps curvado / pinça e coloque em um tubo de microcentrífuga Eppendorf de 2mL Safe-Lock (ou qualquer tubo que pode ser usado com um homogeneizador). Amostras devem ser mantidas no gelo em todos os momentos. É importante notar que os fragmentos de cólon similares devem ser utilizados a partir de cada réplica biológica (ie seções distal seções somente ou apenas proximal).
- Adicionar homogeneizador bead a cada tubo de amostra.
- Adicionar a quantidade adequada de buf HTABfer acordo com o peso do tecido. Se o peso do tecido é inferior a 25 mg, adicionar o buffer em uma proporção de 12.5mg/mL; se o peso do tecido é entre 25-50, adicionar na proporção de 25mg/ml. Se o peso do tecido é maior do que 50, adicionar tampão na proporção de 50mg/ml.
- Homogeneizar com um homogeneizador de tecidos para 4 min a 30 Hz. Repita se o tecido não é totalmente homogeneizado.
- Remover homogeneizador bead e solução de centrífuga por 6 min (13.400 xg, 4 ° C).
- Recolher o sobrenadante e descartar o pellet resultante. Sobrenadante pode ser armazenada a -70 ° C até o uso.
- Preparação de amostras para análise de citocinas.
- Repita os passos 5.1.1. a 5.1.2.
- Adicionar 50 ul de inibidor de protease cocktail (PIC) para 10 mL de tampão de lise preparado.
- Adicionar 1 mL da PIC e solução tampão de lise para cada amostra independentemente do peso.
- Homogeneizar durante 5 min a 30 Hz. Repita se o tecido não é totalmente homogeneizado.
- Remover homogeneizador bead e centrifugar solutipor 5 min a 3300 x g.
- Recolher o sobrenadante e descartar o pellet resultante. Sobrenadante pode ser armazenada a -70 ° C até o uso.
6. Quantificação de marcadores inflamatórios
- Ensaio de atividade MPO
- Prepare o-dianisidina dicloridrato de solução (o-dianisidina) através da combinação de 16,7 mg de o-dianisidina dicloridrato, 90 mL de dH 2 O e 10 mL de tampão fosfato de potássio. Esta solução deve ser preparada para cada ensaio.
- Adicionar 7 mL de homogeneizado de tecido (preparado na seção 5.1) em triplicado em uma placa de 96 poços.
- Adicionar 50 mL da diluição H 2 O 2 (4 mL de 30% H 2 O 2 diluída em 96 mL de dH 2 O) à mistura o-dianisidina.
- Use uma pipeta multi-canal para adicionar 200 mL da mistura o-dianisidina contendo H 2 O 2 a cada um dos poços.
- Medir a absorvância a 450 nm usando um spectrophotómetros. Tome três leituras em intervalos de 30 segundos.
- Calcular a atividade MPO. Atividade de MPO é medido em unidades (U) de MPO / mg de tecido, onde uma unidade de MPO é definida como a quantidade necessária para degradar a 1 mmol de H 2 O 2 por minuto em temperatura ambiente. Considerando que uma unidade (U) da MPO = 1 mol de H 2 O 2 dividido e que 1 mmol de H 2 O 2 apresenta uma mudança de absorbância de 1,13 x 10 -2 nm / min, unidades de MPO em cada amostra é determinada como variação de absorvância [ΔA (t 2-t 1)] / Δmin x (1,13 x 10 -2). Para obter unidades por mg de tecido, use o tecido: a relação buffer. Por exemplo, se um tecido: relação de buffer de 50 mg / mL foi usado, em 7 mL de homogeneizado, não é de 0,35 mg de tecido. Portanto, para obter unidades por mg de tecido, dividir as unidades de MPO de 0,35. Um cálculo amostral utilizando valores de absorbância (nm) é incluída abaixo (assumindo que a amostra foi adicionado em triplicado):
| Amostra | Tempo 0 sec | Tempo de 30 seg | Tempo de 60 seg | ||||||
| A | 1 | 2 | 3 | 1 ' | 2 ' | 3 ' | 1 " | 2'' | 3 " |
| 0,048 | 0,048 | 0,051 | 0,061 | 0,061 | 0,065 | 0,074 | 0,073 | 0,078 | |
- Média em tempo de 0 seg = (0,048 + 0,048 + 0,051) / 3 = 0,049 nm
- Média no tempo de 30 seg = 0,0623 nm
- Média no tempo de 60 seg = 0,075 nm
- Variação de absorvância (ΔA) 0-30 tecido seg / mg (assumindo que 50 mg / mL de tecido: relação buffer) = [(0,0623-0,049) / (1,13 x 10 -2)] / 0,35 = 3,363
- Mudança em absorverdade (ΔA) 30-60 tecido seg / mg = 3,211
- * Atividade MPO (U / mg tecido) = média de ΔA (0-30) e ΔA (30-60) = 3,287
- Quantificação de citocinas pró-inflamatórias por ELISA
- Citocinas (IL-1β, IL-6 e TNF-α), os níveis são determinados utilizando comercialmente disponíveis de ensaio imunoenzimático (ELISA) kit (Quantikine murino; R & D Systems).
- Valores de absorbância de cada ELISA é normalizada utilizando um ensaio de proteína Bradford respectivos a cada amostra e é expressa em unidades de pg / mg de proteína.
7. Resultados representante
Administração de um esquema apropriado DSS irá induzir colite aguda em camundongos. Durante a duração do tratamento DSS, DAI pode ser usado para analisar e avaliar a evolução clínica da doença. Animais tratados com DSS irá mostrar perda de peso significativa em comparação com seus pesos iniciais, fezes moles e fecalsangramento (Figura 1). Após sacrifício e exame do cólon, a gravidade da colite é macroscopicamente marcou com base na redução do comprimento do cólon, sangramento do cólon, sangramento fecal, afrouxamento da consistência das fezes, e sinais de sangramento retal comparados aos controles tratados apenas com água (Figura 2 e Tabela 1). Seções transversais de amostras de tecido do cólon corado com H & E terá maiores escores histológicos para DSS-tratados dois pontos em relação a água tratada com controles (Figura 3). Para melhor caracterizar a extensão da inflamação em camundongos tratados com DSS, a atividade de MPO pode ser avaliado a partir de amostras de tecido do cólon homogeneizada. DSS-tratados dois pontos terá maior atividade MPO comparados aos controles (Figura 4). Além disso, esta está associada com níveis aumentados de citocinas pró-inflamatórias (IL-1β, IL-6, TNF-α) (Figura 5).
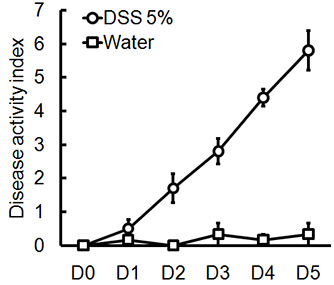
Figura 1. Male, camundongos C57BL / 6 receberam DSS 5% em água potável durante 5 dias. Pontuações DAI foram avaliados diariamente para cada animal e foram em média por dia para cada grupo (média ± SEM, n = 4 ratos / grupo).
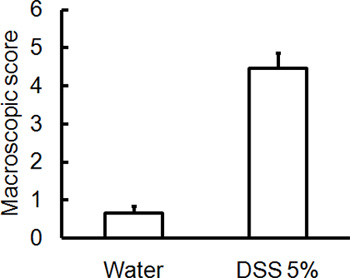
Camundongos figura 2. C57BL / 6 receberam DSS 5% em água potável durante 5 dias. Camundongos controle receberam água sem DSS. Macroscópica danos pontuação / pontuação da severidade da doença foram avaliados às cegas no dia 5 pós colite induzida por DSS. Dois pontos isolados de camundongos que receberam DSS têm escores mais elevados danos macroscópicos (sangramento retal, prolapso retal, diarréia, sangramento do cólon), indicando maior gravidade da doença (média ± SEM, n = 4 ratos / grupo).
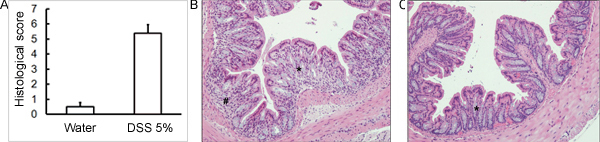
Figura 3. Camundongos C57BL / 6 receberam solução DSS 5% em água potável a fim de induzir colite. Camundongos de controle recebeu água sem DSS. (A) Escores histológicos foram cegamente registados com H & E manchada secções de tecido do cólon coletadas sobre a administração de 5 dias pós-DSS. (B) DSS-tratados amostras mostram mais danos histológicos (infiltração mais celulares, mais de depleção de células caliciformes, maior a distorção / danos à cripta arquitetura) em comparação com (C) controles (média ± SEM, n = 4 ratos / grupo). Em (B) e (C), asterisco (*) indica área de depleção de células caliciformes e distorção da arquitetura da cripta; sinal de número (#) indica infiltração celular.
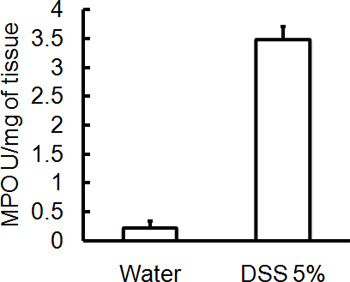
Figura 4. Todos os animais foram sacrificados no dia 5 após a administração da SAD e amostras de tecido do cólon foram coletados para avaliar a atividade MPO. Gravidade da colite induzida por DSS está associada com maiores níveis de atividade de MPO em relação aos controles (média ± SEM, n = 4 ratos / grupo).
_upload/3678/3678fig5.jpg "/>
Figura 5. Além de maiores níveis de MPO, gravidade da DSS-induzida colite também está associada com um aumento do nível de inflamação pró-citocinas como IL-1β, IL-6, TNF-α (média ± SEM, n = 4 ratos / grupo).
Tabela 1. Severity Score macroscópica / Doença
| Contagem | Sangramento retal | Prolapso retal | Consistência das fezes | Sangue |
| 0 | Nenhum | Nenhum | Normal | Normal |
| 1 | Vermelho | Sinais de prolapso | Suave | Vermelho |
| 2 | Vermelho Escuro | Prolapso clara | Muito suave | Vermelho escuro |
| 3 | Bleeding bruta | Prolapso extensa | Diarréia | Negro |
Discussão
DSS colite é um modelo amplamente utilizado induzido quimicamente de inflamação intestinal. Neste modelo, os camundongos são dadas de água potável suplementado com DSS, que é pensado para ser tóxico para células epiteliais do intestino e perturbar a integridade da barreira mucosa. 10 Administração da SAD induz uma colite aguda que se caracteriza por fezes, sangramento fecal, e infiltração com granulócitos. DSS 10 Durante a administração, colite é normalmente associada com perda de ...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho é suportado por concessões do Canadian Institutes of Health Research (CIHR) e por Crohn e Colite Fundação de Canadá (CCFC).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / equipamento: | Companhia | Número de catálogo | Comentários |
| Tubo de microcentrífuga Eppendorf Safe-Lock (2 ml) | eppendorf | 0030 120.094 | |
| Biotek EL808 leitor de placas de absorbância | Biotek | EL808 | |
| Dextran sulfato de sódio grau reagente sal (peso molecular 36,000-50,000 Da) | Biomedicals MP | 160110 | |
| Gen5 (software) | Biotek | Versão 1.10.8 | |
| Brometo de hexadeciltrimetilamônio (HTAB) | Sigma-Aldrich | H5882-100G | |
| Peróxido de hidrogênio, 30 wt solução.% Em água | Sigma-Aldrich | 216763 | Armazenar de 2-8 ° C |
| Microtest plcomeu de 96 poços de fundo plano | Sarstedt | 82,1581 | Para uso único |
| o-dianisidina | Sigma-Aldrich | D-3252 | Sensível à luz. Armazenar de 2-8 ° C |
| Fosfato de potássio dibásico | Caledon | 6620-1 | |
| Fosfato de potássio monobásico | Merck Química | PX1565-1 | |
| Protease cocktail inibidor | Sigma-Aldrich | P8340 | Armazenar a -20 ° C |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tungsten Carbide contas para Tissue Lyser II | QUIAGEN | 69997 |
Referências
- Sands, B. E. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology. 126, 1518-1532 (2004).
- Danese, S., Fiocchi, C. Etiopathogenesis of inflammatory bowel diseases. World J. Gastroenterol. 12, 4807-4812 (2006).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Axelsson, L. G., Landstrom, E., Goldschmidt, T. J., Gronberg, A., Bylund-Fellenius, A. C. Dextran sulfate sodium (DSS) induced experimental colitis in immunodeficient mice: effects in CD4(+)-cell depleted, athymic and NK-cell depleted SCID mice. Inflamm. Res. 45, 181-191 (1996).
- Egger, B., Bajaj-Elliott, M., MacDonald, T. T., Inglin, R., Eysselein, V. E., Büchler, M. W. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency. Digestion. 62, 240-248 (2000).
- Krawisz, J. E., Sharon, P., Stenson, W. F. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models. Gastroenterology. 87, 1344-1350 (1984).
- Cooper, H. S., Murthy, S. N., Shah, R. S., Sedergran, D. J. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab. Invest. 69, 238-249 (1993).
- Smith, J. W., Castro, G. A. Relation of peroxidase activity in gut mucosa to inflammation. Am. J. Physiol. 234, R72-R79 (1978).
- Ghia, J. E., Blennerhassett, P., Kumar-Ondiveeran, H., Verdu, E. F., Collins, S. M. The vagus nerve: a tonic inhibitory influence associated with inflammatory bowel disease in a murine model. Gastroenterology. 131, 1122-1130 (2006).
- Okayasu, I., Hatakeyama, S., Yamada, M., Ohkusa, T., Inagaki, Y., Nakaya, R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98, 694-702 (1990).
- Solomon, L., Mansor, S., Mallon, P., Donnelly, E., Hoper, M., Loughrey, M., Kirk, S., Gardiner, K. The dextran sulphate sodium (DSS) model of colitis: an overview. Comparative Clinical Pathology. 19, 235-239 (2010).
- Mähler, M., Bristol, I. J., Leiter, E. H., Workman, A. E., Birkenmeier, E. H., Elson, C. O., Sundberg, J. P. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, G544-G551 (1998).
- Hans, W., Scholmerich, J., Gross, V., Falk, W. The role of the resident intestinal flora in acute and chronic dextran sulfate sodium-induced colitis in mice. Eur. J. Gastroenterol. Hepatol. 12, 267-273 (2000).
- Rath, H. C., Schultz, M., Freitag, R., Dieleman, L. A., Li, F., Linde, H., Schölmerich, J., Sartor, R. B. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect. Immun. 69, 2277-2285 (2001).
- Ghia, J. E., Li, N., Wang, H., Collins, M., Deng, Y., El-Sharkawy, R. T., Côté, F., Mallet, J., Khan, W. I. Serotonin has a key role in pathogenesis of experimental colitis. Gastroenterology. 137, 1649-1660 (2009).
- Elson, C. O., Beagley, K. W., Sharmanov, A. T., Fujihashi, K., Kiyono, H., Tennyson, G. S., Cong, Y., Black, C. A., Ridwan, B. W., McGhee, J. R. Hapten-induced model of murine inflammatory bowel disease: mucosa immune responses and protection by tolerance. J. Immunol. 157, 2174-2185 (1996).
- Dieleman, L. A., Ridwan, B. U., Tennyson, G. S., Beagley, K. W., Bucy, R. P., Elson, C. O. Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 107, 1643-1652 (1994).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados