Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Исследование кишечного воспаления в DSS-индуцированной модели IBD
В этой статье
Резюме
Экспериментальные модели воспалительных заболеваний кишечника позволили нам изучить сложный врожденный и адаптивный иммунный ответ связана с патогенезом. Использование гистологического забил, количественное определение провоспалительных цитокинов и активность миелопероксидазы, можно приступить к оценке этих ответов видно при воспалительных заболеваниях кишечника.
Аннотация
Inflammatory bowel disease (IBD) encompasses a range of intestinal pathologies, the most common of which are ulcerative colitis (UC) and Crohn's Disease (CD). Both UC and CD, when present in the colon, generate a similar symptom profile which can include diarrhea, rectal bleeding, abdominal pain, and weight loss.1 Although the pathogenesis of IBD remains unknown, it is described as a multifactorial disease that involves both genetic and environmental components.2
There are numerous and variable animal models of colonic inflammation that resemble several features of IBD. Animal models of colitis range from those arising spontaneously in susceptible strains of certain species to those requiring administration of specific concentrations of colitis-inducing chemicals, such as dextran sulphate sodium (DSS). Chemical-induced models of gut inflammation are the most commonly used and best described models of IBD. Administration of DSS in drinking water produces acute or chronic colitis depending on the administration protocol.3 Animals given DSS exhibit weight loss and signs of loose stool or diarrhea, sometimes with evidence of rectal bleeding.4,5 Here, we describe the methods by which colitis development and the resulting inflammatory response can be characterized following administration of DSS. These methods include histological analysis of hematoxylin/eosin stained colon sections, measurement of pro-inflammatory cytokines, and determination of myeloperoxidase (MPO) activity, which can be used as a surrogate marker of inflammation.6
The extent of the inflammatory response in disease state can be assessed by the presence of clinical symptoms or by alteration in histology in mucosal tissue. Colonic histological damage is assessed by using a scoring system that considers loss of crypt architecture, inflammatory cell infiltration, muscle thickening, goblet cell depletion, and crypt abscess.7 Quantitatively, levels of pro-inflammatory cytokines with acute inflammatory properties, such as interleukin (IL)-1β, IL-6 and tumour necrosis factor (TNF)-α,can be determined using conventional ELISA methods. In addition, MPO activity can be measured using a colorimetric assay and used as an index of inflammation.8
In experimental colitis, disease severity is often correlated with an increase in MPO activity and higher levels of pro-inflammatory cytokines. Colitis severity and inflammation-associated damage can be assessed by examining stool consistency and bleeding, in addition to assessing the histopathological state of the intestine using hematoxylin/eosin stained colonic tissue sections. Colonic tissue fragments can be used to determine MPO activity and cytokine production. Taken together, these measures can be used to evaluate the intestinal inflammatory response in animal models of experimental colitis.
протокол
1. Мышиной модели DSS-индуцированного острого колита
- Добавить декстран сульфат натрия (DSS) для автоклавного питьевой водой желаемой конечной концентрации (1-5%) (вес / объем) (т. е. Для того, чтобы 5% DSS решение, добавьте 25 мг DSS порошка на 500 мл воды из автоклавного) . Маточный раствор можно оставить при комнатной температуре в течение одной недели или при температуре 4 ° С до использования.
- В капоте биобезопасности, залить маточного раствора DSS в 50 мл Сокол труб (один необходимый в каждой клетке). Хранить исходный раствор для пополнения трубы в случае необходимости.
- Замените питьевую воду в каждой мыши клетку с DSS решение (в 50 мл Сокол труб) (продолжительность будет зависеть от DSS режим, который используется. Например, при использовании 6-8 недели летний мужчина C57BL / 6 мышей, мы администрировать 5% DSS решение для всего пять дней). Мыши не должны иметь доступ к любому другому источнику воды. Контрольные мыши приведены автоклавного питьевой воды без DSS.
- Взвесьте мышей ежедневно и записывать количество потребляемой DSS в день. Топ каждогоБутылка до 50 мл после записи DSS уровнях. Это необходимо для приблизительного измерения объема потребляемой DSS в каждой клетке на мышь в течение всего срока эксперимента. В наших исследованиях мы используем 5% DSS решение в течение 5 дней с мужским C57BL / 6 мышей. Значительная потеря веса, изменения последовательности стуле и признаки кровь в кале видны уже в 3-й день использования данного режима DSS. Во время DSS администрации, мышей выставку выраженная потеря веса (около 5-10% от их исходного веса в день 5) с потерей веса более 20% от первоначального веса с обезвоживанием и диареей должны быть значительные физиологические показатель того, что животное находится на уровне или возле конечной точки. Если животное получает доступ к обычной водой после 5 дней в размере 5% DSS, он будет восстанавливаться в течение 7 дней. Все эксперименты должны быть одобрены животных учреждения комитета по этике и осуществляется в соответствии с утвержденным протоколом животных применения (АУП).
- Во время эксперимента, индекс активности заболевания (DAI)оценка может быть оценен оценить клиническое прогрессирование колита. DAI является комбинированный счет потери веса по сравнению с начальным весом, консистенции стула, и кровотечение. Результаты определяются следующим образом: потеря веса: 0 (без потерь), 1 (1-5%), 2 (5-10%), 3 (10-20%) и 4 (> 20%); консистенции стула: 0 (нормальное), 2 (жидкий стул), и 4 (понос), а также кровотечения: 0 (без крови), 1 (Hemoccult положительный), 2 (Hemoccult положительные и визуальные гранул кровотечения), и 4 (валовой кровотечение, кровь вокруг анус). DAI может быть засчитан в сутки в течение длительности лечения DSS.
- В то время точке выбора, взвесить и жертвы мышей. Мыши могут быть умерщвлены цервикальным сдвигом после ингаляции изофлюрана или другим методом, утвержденным животного объект учреждения.
2. Сбор образцов тканей толстой
- Expose брюшной стороне животного и мокрого живота с 70% раствором этанола. На данный момент, см. таблицу 1 и запишитепу признаки ректального кровотечения (кровь, присутствующих на анальное отверстие) или выпадения прямой кишки у каждого животного.
- Используйте стандартные рассечение ножницами надрезать брюшко, делая разрез вентральной срединной линии.
- Найдите толстой кишки и разреза толстой кишки как можно ближе к толстой маржи по возможности свободной дистальной толстой кишке.
- Аккуратно и медленно вытащить весь толстой кишки, отделяя ее от окружающих брыжейки.
- Трансекта толстой кишки на colonocecal маржу, чтобы освободить проксимального конца толстой кишки. Кал может быть удален путем промывки толстой кишки стерильной PBS с помощью желудочного зонда игла прилагается к 3 или 5 мл шприц, либо тщательно сжимая его с помощью пары изогнутых пинцетов / щипцами. Использование всей толстой кишки, оценка ущерба (см. раздел 3.1)
- Отбор проб ткани для гистологического анализа и другие анализы можно сделать за счет сокращения 0,5 см до 1,0 см в длину толстой фрагменты принятия к сведению, в каком районе пробы из (т.е. проксимальные, средней или дистальной).
- Образцы тканейкоторые будут использоваться для анализов могут быть индивидуально помещены в 1,5 мл труб Эппендорф и замораживали в жидком азоте и хранят до использования при -70 ° C.
3. Оценка степени тяжести колита
- Макроскопические или оценка тяжести заболевания оценивается неизлечимо от беспристрастного наблюдателя, используя ранее опубликованные балльной системе (табл. 1). 9 консистенции стула может быть оценено с помощью пара щипцов и нажав на кала, чтобы определить консистенцию. Чтобы определить рейтинг в крови в кале, обратите внимание на цвет кала (например, черный стул против светло-коричневый стул) и далее проверку с помощью Hemoccult тест. Использование балльной системы, определить балл по каждому из условий. Окончательный макроскопических оценка для каждого животного есть сумма каждого отдельного счета.
- Для оценки гистологического повреждения колит тяжести, вырезать небольшой фрагмент (0,5 см) толстой кишки, место в ткани кассету и погрузиться в буферном 10% раствором формалина. Подготовка 5мкм парафин сечений и пятна разделы гематоксилином / eoxin (H & E) при помощи соответствующих процедур. Колон фрагменты могут быть взяты из проксимального, среднего толстой кишки, или дистального отдела толстой кишки.
- H & E окрашенных толстой разделах ткани забил ослеплен наблюдателя, используя ранее опубликованные системы следующих мер: склеп архитектуры (нормальный, 0 - суровые склеп искажение с потерей всей склепы, 3), степень воспалительной инфильтрации (нормальный, 0 - плотных воспалительных инфильтратов, 3), мышечные утолщения (база склепа сидит на мышечной слизистой, 0 - отметил присутствующий утолщение мышц, 3), кубок ячейке истощения (отсутствует, 0 - по настоящее время, 1) и склеп абсцесс (отсутствует, 0 - по настоящее время , 1). 7 гистологические оценка ущерба сумма каждого отдельного счета. Следует отметить, что в отличие от человека UC, абсцессы крипт не характерны для этой модели и редко встречаются, микроскопические изъязвления также редки. Если несколько разделов толстой кишки былиокрашенных, гистологические счетов между подобные секции должны быть использованы для определения окончательной оценки для каждой области (т.е. гистологическое счет в проксимальных толстой кишки по сравнению с гистологическим счет в дистальной толстой кишки).
4. Подготовка растворы реактивов для анализов
- Подготовка 50 мМ раствора калий фосфатный буфер, добавив раствор B (K 2 HPO 4, 8,7 г двухосновный фосфат калия в 1 л дН 2 O), чтобы решение (KH 2 PO 4, 6,8 г однозамещенный фосфат калия в 1 л Д. Х. 2 O) до рН 6,0 достигается. Остальные решения можно хранить в холодильнике (2-8 ° С) до использования в будущем.
- Подготовка hexadecyltrimethylammonium бромид (HTAB) буфер добавлением 5 г HTAB в 1 л калий фосфатный буфер (50 мМ, рН = 6,0). Аккуратно тепла, чтобы растворить и храните при температуре 2-8 ° C до использования. При необходимости, тепло повторно раствориться.
- Подготовка буфера для лизиса ткани гомогенизации для белка анализадобавив 10 мл 1М Трис-соляной кислоты (рН = 8,0), 6 мл 5М хлорида натрия и 2 мл Тритон Х-100 до 182 мл стерилизованной дистиллированной водой. Тритон Х-100 является очень вязким при комнатной температуре и, следовательно, должны быть аккуратно нагревают до использования. Подготовленный буфер лизис можно хранить при температуре от -20 ° C до использования.
5. Подготовка проб для анализов
- Подготовка проб для анализа МПО.
- Удалить образцы от -70 ° C и место на льду. Запись вес каждого образца после удаления видимых калом или жира с помощью изогнутых forcep / пинцет и поместить в 2 мл Eppendorf Safe-Блокировка микроцентрифужных трубки (или любую трубку, которая может быть использована с гомогенизатор). Образцы следует хранить на льду во все времена. Важно отметить, что подобные фрагменты толстой кишки должны использоваться с каждой биологической репликации (то есть только в дистальных отделах или проксимальной разделы только).
- Добавить гомогенизатор бусинку к каждой пробе трубки.
- Добавить соответствующее количество HTAB буферефер по ткани весом. Если ткань весом меньше 25 мг, добавить буфера в соотношении 12.5mg/mL, если ткань вес составляет от 25-50, добавить в соотношении 25mg/mL. Если ткань весит больше 50, добавить буфера в соотношении 50мг/мл.
- Однородный с тканью гомогенизатора в течение 4 мин при 30 Гц. Повторите, если ткани не полностью гомогенизированных.
- Удалить гомогенизатор бисером и центрифуги решение в течение 6 мин (13 400 мкг, 4 ° С).
- Сбор супернатант и отбросить результате осадок. Supernatent может храниться при -70 ° C до использования.
- Подготовка проб для анализа цитокинов.
- Повторите шаги 5.1.1. на 5.1.2.
- Добавить 50 мкл ингибитора протеазы коктейль (ПОС) по 10 мл подготовленный буфер лизиса.
- Добавить 1 мл ПИК и лизис буферный раствор для каждого образца, независимо от веса.
- Однородный в течение 5 мин при 30 Гц. Повторите, если ткани не полностью гомогенизированных.
- Удалить гомогенизатор бисером и центрифуги solutiв течение 5 мин при 3300 х g.
- Сбор супернатант и отбросить результате осадок. Супернатант можно хранить при температуре -70 ° C до использования.
6. Количественная оценка воспалительных маркеров
- МПО анализа деятельности
- Подготовка-дианизидина дигидрохлорид (о-дианизидина) решение, объединив 16,7 мг-дианизидина дигидрохлорид, 90 мл дН 2 O и 10 мл калий фосфатный буфер. Это решение должно быть подготовлено свежей для каждого теста.
- Добавить 7 мкл гомогената ткани (подготовлен в разделе 5.1) в трех экземплярах в 96-луночного планшета.
- Добавить 50 мкл разбавленной H 2 O 2 (4 мкл 30% H 2 O 2, разведенного в 96 мкл дН 2 O) на о-дианизидина смеси.
- Использование многоканальной пипетки добавить 200 мкл-дианизидина смеси, содержащей H 2 O 2 на каждый из скважин.
- Мера абсорбцию при 450 нм, используя spectrophotometer. Возьмите трех чтениях на 30-секундным интервалом.
- Рассчитать МПО деятельности. МПО активность измеряется в единицах (У) MPO / мг ткани, где одна единица МПО определяется как сумма, необходимая для ухудшить 1 мкмоль H 2 O 2 в минуту при комнатной температуре. Учитывая, что одна единица (У) МПО = 1 мкмоль H 2 O 2 раскол и что 1 мкмоль H 2 O 2 дает изменение поглощения 1,13 х 10 -2 нм / мин, подразделения МПО в каждом образце определяется как изменение абсорбции [ΔA (T 2-T 1)] / Δmin х (1,13 х 10 -2). Чтобы получить единиц на мг ткани, использование тканей: буфер отношение. Например, если ткани: буфер соотношении 50 мг / мл была использована, в 7 мкл гомогената, есть 0,35 мг ткани. Поэтому, чтобы получить единиц на мг ткани, разделить единиц МПО на 0,35. Пример расчета с использованием значения абсорбции (нм) приведена ниже (при условии, что образец был добавлен в трех экземплярах):
| Образец | Время 0 сек | Время 30 сек | Время 60 сек | ||||||
| 1 | 2 | 3 | 1 ' | 2 ' | 3 ' | 1 " | 2'' | 3 " | |
| 0,048 | 0,048 | 0,051 | 0,061 | 0,061 | 0,065 | 0,074 | 0,073 | 0,078 | |
- Среднее время на 0 сек = (0,048 + 0,048 + 0,051) / 3 = 0,049 нм
- Среднее время на 30 сек = 0,0623 нм
- Среднее время на 60 сек = 0,075 нм
- Изменение абсорбции (ΔA) от 0 до 30 сек / мг ткани (при условии 50 мг / мл ткани: буфер коэффициент) = [(0.0623-0.049) / (1,13 х 10 -2)] / 0,35 = 3,363
- Изменение поглощенияAnce (ΔA) от 30 до 60 сек / мг ткани = 3,211
- * МПО деятельности (U / мг ткани) = средняя ΔA (0-30) и ΔA (30-60) = 3,287
- Количественная оценка провоспалительных цитокинов методом ИФА
- Цитокинов (ИЛ-1β, IL-6 и TNF-α) уровней определяются с помощью коммерчески доступных иммуноферментного анализа (ИФА) комплект (Quantikine мышей, R & D Systems).
- Поглощение значения из каждой ИФА нормирован использованием анализа Брэдфорда белка соответствующих для каждого образца и выражается в единицах пг / мг белка.
7. Представитель Результаты
Администрация соответствующего режима DSS будет вызывать острого колита у мышей. Во время длительность лечения DSS, DAI могут быть использованы для определения и оценки клинической прогрессии заболевания. Животных, получавших DSS покажет значительные потери веса по сравнению с их начальным весам, жидкий стул и фекальныекровотечения (рис. 1). По жертву и экспертиза толстой кишки, тяжесть колита макроскопически забил на основе сокращения толстой кишки длиной, толстой кровотечение, фекальные кровотечения, ослабление консистенции стула, и признаки ректального кровотечения по сравнению с контрольной обрабатывают водой только (рис. 2 и таблица 1). Сечения толстой образцы ткани окрашивали H & E будет иметь более высокие показатели для гистологического DSS обработанных двоеточия по сравнению с водой обработанные управления (рис. 3). Для дальнейшего характеризуют степень воспаления в DSS-мышей, МПО деятельности может быть оценена из толстой гомогенизированных образцов тканей. DSS обработанных двоеточия будет иметь более высокую МПО активностью по сравнению с контрольной группой (рис. 4). Кроме того, это связано с повышением уровня провоспалительных цитокинов (ИЛ-1β, IL-6, TNF-α) (рис. 5).
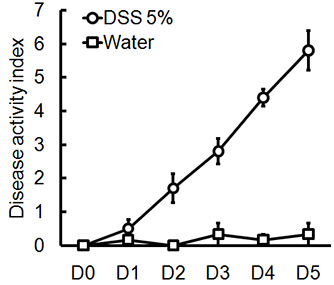
Рисунок 1. Мужчина, C57BL / 6 мышей давали 5% DSS в питьевой воде в течение 5 дней. DAI оценки были оценены в день на каждого животного и были усреднены в день для каждой группы (среднее ± SEM, п = 4 мышей / группы).
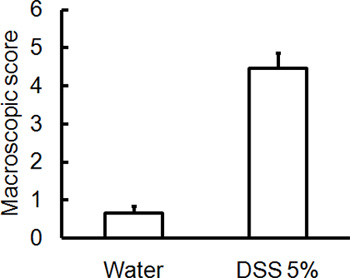
Рисунок 2. C57BL / 6 мышей давали 5% DSS в питьевой воде в течение 5 дней. Контрольные мыши получали воду без DSS. Макроскопическая оценка повреждения / заболевания оценки степени тяжести были слепо оценивается по 5-й день после DSS-индуцированной колит. Колоны изолирован от мышей, получавших DSS имеют высшее макроскопические повреждения баллов (ректальные кровотечения, выпадения прямой кишки, диарея, кровотечение толстой) с указанием большей тяжести заболевания (среднее ± SEM, п = 4 мышей / группы).
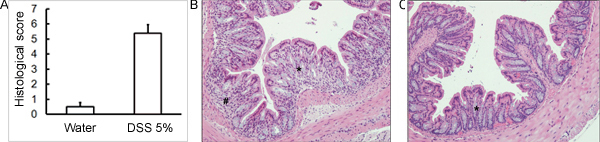
Рисунок 3. C57BL / 6 мышей давали 5% DSS решение в питьевой воде для того, чтобы вызвать колит. Контрольные мыши получали воду без DSS. (А) Гистологическое оценки были слепо забил использованием H & E окрашенных срезах тканей толстой собранных на 5 день после DSS администрации. (B) DSS обработанные образцы показывают более гистологического повреждения (более клеточной инфильтрации, более истощения кубок клетки, большее искажение / повреждения склеп архитектуры) по сравнению с (С) контрольной группы (среднее ± SEM, п = 4 мышей / группы). В (Б) и (С), звездочки (*) указывает область кубок истощение клеток и искажение склеп архитектуры; знак номера (#) указывает клеточной инфильтрации.
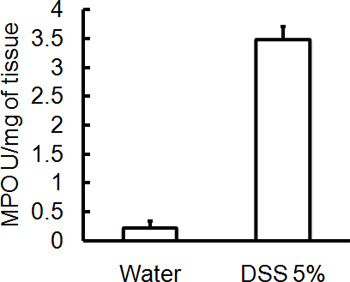
Рисунок 4. Все мыши были принесены в жертву на 5 день после введения DSS и толстой образцы ткани были собраны для оценки МПО деятельности. Тяжесть DSS индуцированной колит связан с более высоким уровнем МПО активностью по сравнению с контрольной группой (среднее ± SEM, п = 4 мышей / группы).
_upload/3678/3678fig5.jpg "/>
Рисунок 5. В дополнение к более высоким уровнем МПО, тяжести DSS-индуцированной колит также связано с повышенным уровнем про-воспаление цитокинов, таких как IL-1β, IL-6, TNF-α (среднее ± SEM, п = 4 мышей / группы).
Таблица 1. Макроскопические / Оценка тяжести заболевания
| Счет | Кровотечение из прямой кишки | Выпадения прямой кишки | Консистенции стула | Кровь |
| 0 | Ни один | Ни один | Нормальный | Нормальный |
| 1 | Красный | Признаки выпадения | Мягкий | Красный |
| 2 | Темно-красный | Очистить пролапс | Очень мягкая | Темно-красный |
| 3 | Валовой Кровотечение | Обширные пролапс | Понос | Черный |
Обсуждение
DSS колит широко используются химически индуцированных модель кишечного воспаления. В этой модели мышей приведены питьевой воды дополнена DSS, который, как полагают, быть токсичными для клеток эпителия кишечника и нарушают целостность слизистой оболочки барьер. 10 Администрации DSS ...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при поддержке грантов от канадского Института Здоровья Исследований (CIHR) и Крона и колит Фонд Канады (CCFC).
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента / оборудование: | Компания | Номер по каталогу | Комментарии |
| Эппендорф Безопасный-Lock Микроцентрифуга Тюбе (2 мл) | Эппендорф | 0030 120.094 | |
| Biotek EL808 Поглощение ридер | Биотек | EL808 | |
| Декстран сульфата натриевой соли реагента класса (молекулярный вес 36,000-50,000 Da) | MP Biomedicals | 160110 | |
| Gen5 (программное обеспечение) | Биотек | Версия 1.10.8 | |
| Hexadecyltrimethylammonium бромид (HTAB) | Sigma-Aldrich | H5882-100G | |
| Перекись водорода, 30 мас.% Раствора в воде | Sigma-Aldrich | 216763 | Хранить при температуре 2-8 ° C |
| Микротест плел 96-луночного плоским дном | Sarstedt | 82,1581 | Для однократного использования |
| -дианизидина | Sigma-Aldrich | D-3252 | Свет чувствительны. Хранить при температуре 2-8 ° C |
| Калий фосфат, двузамещенный | Каледон | 6620-1 | |
| Калия фосфат однозамещенный | EMD Химические вещества | PX1565-1 | |
| Ингибитор протеазы коктейль | Sigma-Aldrich | P8340 | Хранить при температуре от -20 ° C |
| Тритон Х-100 | Sigma-Aldrich | T8787 | |
| Карбид вольфрама шарики для тканей Lyser II | QUIAGEN | 69997 |
Ссылки
- Sands, B. E. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology. 126, 1518-1532 (2004).
- Danese, S., Fiocchi, C. Etiopathogenesis of inflammatory bowel diseases. World J. Gastroenterol. 12, 4807-4812 (2006).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Axelsson, L. G., Landstrom, E., Goldschmidt, T. J., Gronberg, A., Bylund-Fellenius, A. C. Dextran sulfate sodium (DSS) induced experimental colitis in immunodeficient mice: effects in CD4(+)-cell depleted, athymic and NK-cell depleted SCID mice. Inflamm. Res. 45, 181-191 (1996).
- Egger, B., Bajaj-Elliott, M., MacDonald, T. T., Inglin, R., Eysselein, V. E., Büchler, M. W. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency. Digestion. 62, 240-248 (2000).
- Krawisz, J. E., Sharon, P., Stenson, W. F. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models. Gastroenterology. 87, 1344-1350 (1984).
- Cooper, H. S., Murthy, S. N., Shah, R. S., Sedergran, D. J. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab. Invest. 69, 238-249 (1993).
- Smith, J. W., Castro, G. A. Relation of peroxidase activity in gut mucosa to inflammation. Am. J. Physiol. 234, R72-R79 (1978).
- Ghia, J. E., Blennerhassett, P., Kumar-Ondiveeran, H., Verdu, E. F., Collins, S. M. The vagus nerve: a tonic inhibitory influence associated with inflammatory bowel disease in a murine model. Gastroenterology. 131, 1122-1130 (2006).
- Okayasu, I., Hatakeyama, S., Yamada, M., Ohkusa, T., Inagaki, Y., Nakaya, R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98, 694-702 (1990).
- Solomon, L., Mansor, S., Mallon, P., Donnelly, E., Hoper, M., Loughrey, M., Kirk, S., Gardiner, K. The dextran sulphate sodium (DSS) model of colitis: an overview. Comparative Clinical Pathology. 19, 235-239 (2010).
- Mähler, M., Bristol, I. J., Leiter, E. H., Workman, A. E., Birkenmeier, E. H., Elson, C. O., Sundberg, J. P. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, G544-G551 (1998).
- Hans, W., Scholmerich, J., Gross, V., Falk, W. The role of the resident intestinal flora in acute and chronic dextran sulfate sodium-induced colitis in mice. Eur. J. Gastroenterol. Hepatol. 12, 267-273 (2000).
- Rath, H. C., Schultz, M., Freitag, R., Dieleman, L. A., Li, F., Linde, H., Schölmerich, J., Sartor, R. B. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect. Immun. 69, 2277-2285 (2001).
- Ghia, J. E., Li, N., Wang, H., Collins, M., Deng, Y., El-Sharkawy, R. T., Côté, F., Mallet, J., Khan, W. I. Serotonin has a key role in pathogenesis of experimental colitis. Gastroenterology. 137, 1649-1660 (2009).
- Elson, C. O., Beagley, K. W., Sharmanov, A. T., Fujihashi, K., Kiyono, H., Tennyson, G. S., Cong, Y., Black, C. A., Ridwan, B. W., McGhee, J. R. Hapten-induced model of murine inflammatory bowel disease: mucosa immune responses and protection by tolerance. J. Immunol. 157, 2174-2185 (1996).
- Dieleman, L. A., Ridwan, B. U., Tennyson, G. S., Beagley, K. W., Bucy, R. P., Elson, C. O. Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 107, 1643-1652 (1994).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены