JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
IBD의 DSS 유발 모델에서 창자 염증을 조사
요약
염증성 장 질환의 실험적 모델은 우리가 pathogenesis와 관련된 복잡한 본래과 적응 면역 반응을 조사 수 있습니다. histological 채점, 프로 - 염증 크린 시토킨 및 myeloperoxidase 활동 부량 사용하여, 하나는 염증성 장 질환에서 볼 이러한 반응을 평가하기 시작할 수 있습니다.
초록
염증성 장 질환 (IBD)은 장내 pathologies의 범위, 궤양 대장염 (UC) 및 Crohn의 질병 (CD)하는 가장 일반적인 구성되어 있습니다. UC와 CD, 모두 콜론에 존재하면, 설사, 직장 출혈, 복통 및 체중 감소를 포함시킬 수 있습니다 유사한 증상 프로필을 생성합니다. 1 IBD의 pathogenesis이 알려지지 않은 남아 있지만, 그것은 모두를 포함 multifactorial 질병으로 설명되어 있습니다 유전과 환경 요소 2.
IBD의 몇 가지 기능이 유사한 colonic 염증 수많은 변수와 변수의 동물 모델이 있습니다. 이러한 dextran 황산염 나트륨 (DSS)과 같은 대장염 - 유도 화학 물질의 특정 농도의 이러한 요구 관리 특정 종의 변종에 감염될 자발적으로 발생하는 사람의 대장염 범위의 동물 모델. 내장 염증의 화학 유도된 모델은 IBD의 가장 일반적으로 사용되는 최상의 설명 모델입니다. Admini마시는 물 속에 DSS의 stration이 관리 프로토콜에 따라 급성 또는 만성 대장염을 생산하고 있습니다. DSS 전시 체중 감소와 느슨한 대변 또는 설사의 증상 주어진 세 동물은, 때때로 직장 출혈의 증거. 여기 4,5를 우리는 방법을 설명하는 대장염 개발 및 결과 염증 반응은 DSS의 다음과 같은 관리를 특징하실 수 있습니다. 이러한 방법은 염증의 대리 마커로 사용할 수 histological hematoxylin / eosin 스테인드 결장 섹션의 분석, 프로 - 염증 크린 시토킨의 측정 및 myeloperoxidase의 결정 (MPO) 활동 6. 포함
질병 상태에있는 염증 반응의 정도는 임상 증상의 존재 또는 점막 조직의 조직학의 변경에 의해 평가하실 수 있습니다. Colonic histological 피해 지하실 건축, 염증 세포 침투, 근육 t의 손실을 고려 채점 시스템을 사용하여 평가됩니다hickening, 고블렛 셀 고갈, 그리고 토굴 농양. 양적 7과 같은 인터루킨 (IL) - 1β, IL - 6와 종양의 괴사 인자 (TNF) - α와 같은 급성 염증성 속성,와 프로 - 염증성 크린 시토킨 수준을 사용하여 확인할 수 있습니다 기존 엘리사 방법. 또한, MPO 활동은 colorimetric 분석을 사용하여 측정할 수 있으며 염증의 인덱스로 사용 8.
실험적 대장염에서 질병 심각도는 종종 MPO 활동 증가와 프로 염증 크린 시토킨 높은 수준의와 상관있다. 대장염의 심각 및 염증 - 관련 피해 hematoxylin / eosin 스테인드 colonic 조직 섹션을 사용하여 대장의 상태를 histopathological 평가 이외에, 대변 일관성과 출혈을 조사하여 평가하실 수 있습니다. Colonic 조직 조각은 MPO 활동 및 시토킨 생산을 결정하는 데 사용할 수 있습니다. 합쳐 놓으면, 이러한 조치는 장의 염증 반응을 평가하는 데 사용할 수 있습니다실험 대장염의 동물 모델.
프로토콜
1. DSS - 유도된 급성 대장염의 Murine 모델
- 원하는 최종 농도 (1-5%) (wt / 권) (즉, 5 % DSS 솔루션을 만들 autoclaved 물 500 ML에 DSS 분말 25 밀리그램을 추가하려면)에 autoclaved 식수로 dextran 황산염 나트륨 (DSS)을 추가 . 주식 솔루션은 ° C까지 사용을 한 주일 또는 4 실온에서 남아있을 수 있습니다.
- biosafety 후드에서 50 ML 팔콘 튜브 (케이지마다 필요 하나)로 재고 DSS 솔루션을 따라줘. 필요한 리필 튜브에 재고 솔루션을 유지.
- DSS 솔루션 (50 ML 팔콘 튜브)와 각 마우스 케이지에서 식수를 교체 (기간은 사용되는 DSS 처방에 따라 달라집니다. 예를 들어, 6-8주 오래된 남성 C57BL / 6 마우스를 사용하여, 우리가 관리를 5 일간의 총 5 %의 DSS 솔루션). 마우스는 다른 물 소스에 액세스할 수 없습니다. 컨트롤 마우스는 DSS없이 autoclaved 마시는 물을 주어집니다.
- 매일 쥐를 무게와 하루 소비하는 DSS의 양을 기록합니다. 각각의 상위DSS 수준을 기록 후 50 ML하는 병. 이것은 실험 기간 내내 마우스마다 케이지 당 소비 DSS의 대략적인 볼륨을 측정하는 것입니다. 우리의 연구에, 우리는 남성 C57BL / 6 마우스 5 일 동안 5 % DSS 솔루션을 사용합니다. 중요한 체중 감소, 변경 대변 일관성과 배설물 혈액의 흔적이 특정 DSS의 처방을 사용하여 3 일 빠르면 볼 수 있습니다. DSS 관리하는 동안 마우스는 동물하거나되는 중요한 생리적 지표로 탈수 및 설사와 체중 감소와 발음 체중 감소 (5 일 그들의 초기 무게의 50-10% 정도) 초기 체중의 20 % 이상을 전시 종점 근처. 동물 5 % DSS의 5 일 후에 정상적인 물에 액세스할 수있는 권한을 부여하는 경우, 그것은 7 일 이내에 회복됩니다. 모든 실험은 기관의 동물 윤리위원회의 승인 및 승인 동물 이용 프로토콜 (AUP)을 준수해야합니다.
- 실험, 질병 활동 색인 (다이)의 기간 동안점수는 대장염의 임상 진행을 평가하기위한 평가하실 수 있습니다. 다이는 초기 체중, 대변 일관성, 그리고 출혈에 비해 체중 감소의 결합 점수입니다. 점수는 다음과 같이 정의됩니다 : 체중 감소 : 0 (없음 손실), 1 (1~5%), 2 (5-10 %), 3 (10-20%), 4 (> 20 %), 대변 일관성을 : 0 (정상), 2 (느슨한 대변) 및 4 (설사) 및 출혈 : 0 (혈흔), 1 (Hemoccult 긍정), 2 (Hemoccult 긍정적인 시각 펠렛의 출혈) 및 4 (총 출혈, 혈액 주위 항문). 다이는 DSS 치료 기간 동안 매일 득점 수 있습니다.
- 선택의 시점에서, 무게와 생쥐를 희생. 생쥐는 기관의 동물 시설의 승인을 isoflurane 혹은 다른 방식의 흡입 다음과 같은 자궁 전위에 의해 euthanized 수 있습니다.
2. colonic 조직 샘플을 수집
- 동물의 복부 측면을 노출하고 70 % 에탄올 솔루션 복부 영역을 젖었어. 이 시점에서, 표 1을 참조하고 적어 둡니다직장 출혈 (항문 구멍에서 혈액 현재) 각 동물의 직장 탈출증의 뉴욕 신호.
- 복부 중간선 절개를하여 복부를 절개 표준 해부 가위를 사용하십시오.
- 콜론을 찾아 말초 콜론 자유 가능한 대장암 여백에 가까운 콜론을 가로로 쪼개다.
- 조심스럽게 천천히 주변 장간막에서 분리, 전체 결장 빼낸다.
- 콜론의 근위 끝 무료로 colonocecal 여백에 콜론을 가로로 쪼개다. 배설물은 신중하게 구부러진 핀셋 / 집게 한 켤레를 사용하여 착취하여 3 또는 5 ML 주사기 또는 부착된 gavage 바늘을 사용하여 멸균 PBS로 콜론을 rinsing하여 제거할 수 있습니다. 전체 콜론을 사용하여 (제 3.1 참조) 손상에 대한 평가
- histological 분석 및 기타 assays에 대한 조직 샘플링은 샘플에서 어떤 영역의 노트를 만들기 1.0 cm 길이 colonic 조각에 0.5 cm을 절단하여 수행할 수 있습니다 (예 : 근위, 중, 또는 말초).
- 조직 샘플assays가 개별적으로 1.5 ML eppendorf 튜브에 배치하고 액체 질소에 냉동 및 -70 ° C.에서 사용까지 저장할 수에 사용되는
3. 대장염의 심각 성의 평가
- 매크로 또는 질병 심각도 점수가 이전에 게시된 채점 시스템 (표 1)를 사용 편견 관찰자에 의해 말기 평가됩니다. 9 대변 일관성이 포셉 한 켤레를 사용하고 일관성을 확인하는 대변에 아래로 누르면 평가하실 수 있습니다. 배설물에 피를 점수를 확인하려면 대변의 색상을 참고 (즉, 검은 엉덩이 비해 밝은 갈색 의자)와 더욱 Hemoccult 검사를 사용하여 확인합니다. 채점 시스템을 사용하여 조건을 각각의 점수를 결정합니다. 각 동물에 대한 최종 매크로 점수는 각 개별 점수의 합계입니다.
- 대장염의 심각의 histological 손상을 평가하기 위해 버퍼 10% 포르말린 용액에있는 작은 콜론의 조각 (0.5 cm), 조직 카세트의 장소와 잠수함 잘라. 5 준비μm의 파라핀에 해당 절차를 사용하여 hematoxylin / eoxin (H & E)와 크로스 섹션과 얼룩 섹션을 내장. 콜론 조각은 근위, 중반 콜론, 또는 콜론의 말초 부분에서 취할 수 있습니다.
- H & E 스테인드 colonic 조직 섹션은 다음과 같은 조치에 대해 이전에 출판 시스템을 사용하여 눈을 멀게 관찰자에 의해 득점 있습니다 : (- 전체 종종 지하실이나 지하 묘지, 3의 손실과 함께 심각한 토굴 왜곡 정상, 0), 염증 세포 침투의 정도 (일반, 0 토굴 아키텍처 - 표시된 근육 농화 선물, 3), 고블렛 세포 고갈 (부재, 0 - - 현재, 1)과 토굴의 농양 (부재, 0 - 현재 밀도 염증은), 근육 농화을 (지하실 기지 muscularis mucosae, 0에 앉아 3 침투 1) 7. histological 손상 평가 점수는 각 개별 점수의 합계입니다. 그것은 인간의 UC 달리, 토굴에 농양이 모델의 특성되지 않으며 거의 본 적이있는 것으로 지적해야, 미세한 ulcerations도 드물다. 여러 개의 콜론 섹션이있다면유사한 섹션 사이의 스테인드, histological 점수는 각 영역에 대한 최종 점수 (말초 콜론에 histological 점수를 비교 근위 결장에서 즉 histological 점수)를 결정하는 데 사용해야합니다.
4. assays에 대한 시약의 재고 솔루션을 준비
- 솔루션 (K 2 HPO 4, DH 2 O 1 L에 이염 인산 칼륨의 8.7 g) 솔루션 B를 추가하여 인산 칼륨 버퍼의 50 MM 솔루션을 준비 (KH 2 PO 4, 1L에 일염기의 인산 칼륨의 6.8 g DH 2 O의)까지가 6.0의 산도가 이루어진다. 남은 솔루션은 나중에 사용하기 전까지 냉장고 (2-8 ° C)에 저장할 수 있습니다.
- 인산 칼륨 완충액 1 패 (50 MM, 산도 = 6.0)에 5g HTAB를 추가하여 hexadecyltrimethylammonium의 브로마이드 (HTAB) 버퍼를 준비합니다. 2-8에 용해하고 저장하기 위해 부드럽게 열 ° C까지 사용. 필요한 경우, 다시 디졸브로 가열.
- 하여 단백질 분석을위한 조직 균질에 대한 용해 버퍼를 준비1M 트리스 - 염산 (산도 = 8.0), 5M 나트륨 염화물 6 ML 및 소독 증류수의 트리톤 X - 100-182 ML 2 ML 10 ML을 추가. 트리톤 X - 100은 상온에서 매우 점성 때문에, 가볍게 사용하기 전에 따뜻하게해야합니다. 준비 용해 버퍼는 사용 전까지 -20 ° C에 저장할 수 있습니다.
5. assays를위한 샘플 준비
- MPO 분석을위한 샘플 준비.
- -70에서 샘플을 제거 얼음 ° C과 장소. 2mL Eppendorf 안전 잠금 microcentrifuge 튜브 (또는 균질 화기와 함께 사용할 수있는 튜브)에 구부러진 forcep / 트위터 및 장소를 사용하여 가시적인 대변이나 지방을 제거한 후에 각 시료의 무게를 기록합니다. 샘플은 항상 얼음에 보관해야합니다. 이와 비슷한 콜론 조각은 각각의 생물 학적 복제 (즉 말초 부분에만 또는 근위 부분에서만)에서 사용해야 참고하는 것이 중요합니다.
- 각 샘플 튜브에 균 질기 비드를 추가합니다.
- HTAB의 buf의 해당 금액을 추가조직 무게에 따라 그다지. 조직 무게 미만 25 MG 경우 12.5mg/mL의 비율로 버퍼를 추가, 조직 중량이 25-50 사이에있는 경우, 25mg/mL의 비율로 추가합니다. 조직 무게가 50보다 큰 경우, 50mg/mL의 비율로 버퍼를 추가합니다.
- 30 Hz에서 4 분 조직 균질 화기와 Homogenize. 조직이 완전히 균질하지 않은 경우 반복합니다.
- 균 질기 비드 6 분 (13,400 XG, 4 ° C)에 대한 원심 솔루션을 제거합니다.
- 뜨는를 수집하고 그 결과 펠렛을 삭제. Supernatent는 -70 ° C에서 사용까지 저장할 수 있습니다.
- 시토킨 분석을위한 샘플 준비.
- 반복 5.1.1 단계를 반복합니다. 5.1.2 수 있습니다.
- 준비 용해 버퍼의 10 ML에 테아제 억제제 칵테일 (PIC) 50 μl를 추가합니다.
- PIC와 상관없이 체중의 각 샘플에 용해 버퍼 용액 1 ML을 추가합니다.
- 30 Hz에서에서 5 분 Homogenize. 조직이 완전히 균질하지 않은 경우 반복합니다.
- 균 질기 비드와 원심 분리기 soluti를 제거3300 X G.에서 5 분 동안
- 뜨는를 수집하고 그 결과 펠렛을 삭제. 뜨는는 -70 ° C에서 사용까지 저장할 수 있습니다.
6. 염증 마커의 양을 정함
- MPO 활동 분석
- O - dianisidine dihydrochloride, DH 2 O의 90 ML, 그리고 인산 칼륨 완충액 10 ML의 16.7 MG를 결합하여 O - dianisidine의 dihydrochloride (O - dianisidine) 솔루션을 준비합니다. 이 솔루션은 모든 분석을위한 새로운 준비를해야합니다.
- 96 - 웰 플레이트에 세중의의 조직 homogenate (섹션 5.1에서 준비) 7 μL를 추가합니다.
- O - dianisidine 혼합물로 희석 H 2 O 2 (30 % DH 2 O 96 μL에 희석 H 2 O 2 4 μL) 50 μL를 추가합니다.
- 우물 각 H 2 O 2를 포함하고있는 O - dianisidine 혼합 200 μL를 추가하는 멀티 채널 피펫을 사용합니다.
- spectropho를 사용하여 450 nm의 흡광도를 측정에서tometer. 삼십초 간격으로 세 수치를 가져가라.
- MPO 활동을 계산합니다. MPO 활동 MPO 중 하나가 단위는 상온에서 분당 H 2 O 2 단계 중 1 μmoL을 저하하는 데 필요한 금액을 말합니다 MPO / MG 조직의 단위 (U) 단위로 측정됩니다. MPO 한 단위 (U)는 = 1 H 2 O 2 분할의 μmoL하고 H 2 O 2 단계 중 1 μmoL은 1.13 × 10 -2 NM / 분 흡광도의 변화를주는 것을 고려, 각 샘플에서 MPO 단위가 결정됩니다 흡광도의 변화로 [ΔA (T 2 - T 1)] / Δmin X (1.13 × 10 -2). 조직 MG 단위당를 얻으려면 조직을 사용하여 버퍼 비율을. 예를 들어, 조직이있는 경우 : 50 밀리그램 / ML의 버퍼의 비율이 사용된, homogenate 7 μL에서 조직의 0.35 MG있다. 따라서, MG 조직 단위당를 얻으려면, 0.35로 MPO의 단위를 나눕니다. 흡광도 값을 사용하여 샘플 계산 (NM)을 (샘플이 세중의에 추가되었다는 가정) 아래에 포함되어 있습니다 :
| 견본 | 시간 0 초 | 시간 30 초 | 시간 60 초 | ||||||
| 일 | 이 | 3 | 1 ' | 2 ' | 3 ' | 1 " | 이 ' | 3 " | |
| 0.048 | 0.048 | 0.051 | 0.061 | 0.061 | 0.065 | 0.074 | 0.073 | 0.078 | |
- 평균 시간에서 0 초 = (0.048 + 0.048 + 0.051) / 3 = 0.049 NM
- 평균 시간에서 30 초 = 0.0623 NM
- 시간 60 초에서 평균 = 0.075 NM
- 0에서 30 초 / MG 조직 (50 MG / 조직 ML 가정 : 버퍼 비율)로 흡광도 (ΔA)의 변경 = [(0.0623-0.049) / (1.13 × 10 -2)] / 0.35 = 3.363
- 흡수의 변화ance (ΔA) 30에서 60 초 / MG 조직 = 3.211
- * MPO 활동 (U / MG 조직) ΔA의 = 평균 (0-30)와 ΔA (30-60) = 3.287
- 엘리사에 의해 프로 염증성 크린 시토킨의 부량
- 시토킨 (IL - 1β, IL - 6와 TNF - α) 수준은 상용 효소 - 연결 면역 분석 (엘리사) 키트 (; R & D 시스템 Quantikine Murine)를 사용 결정됩니다.
- 각 엘리사의 흡광도 값은 각 샘플에 해당 브래드 포드 단백질 분석을 사용하여 정규화하고 단백질의 PG / MG 단위로 표시됩니다.
7. 대표 결과
해당 DSS의 섭생의 관리 생쥐의 급성 대장염을 일으킬 것입니다. DSS 치료 기간 동안 다이는 질병의 임상 진행을 평가하고 평가하는 데 사용할 수 있습니다. DSS로 치료 동물들은 초기 중량에 비해 상당한 체중 감소, 느슨하게 stools 및 배설물이 표시됩니다출혈 (그림 1). (그림 2 및 표 콜론의 희생과 심사시, 대장염의 심각는 macroscopically 대변 일관성의 느슨해진 결장의 길이, colonic 출혈, 지저분한 출혈의 단축에 따라 점수이며, 직장 출혈의 흔적은 물로 취급 컨트롤 비교 1). H & E와 함께 스테인드 colonic 조직 샘플의 크로스 섹션 물 처리 제어 대 DSS - 대우 콜론 (그림 3)에 대한 높은 점수를 histological됩니다. 추가 DSS - 취급 생쥐의 염증의 정도를 특성화, MPO 활동은 균질 colonic 조직 샘플에서 평가 수 있습니다. DSS - 처리 콜론 컨트롤 (그림 4)에 비해 높은 MPO 활동을해야합니다. 또한, 이것은 프로 - 염증성 크린 시토킨의 증가 수준 (IL - 1β, IL - 6, TNF - α) (그림 5)와 연결되어 있습니다.
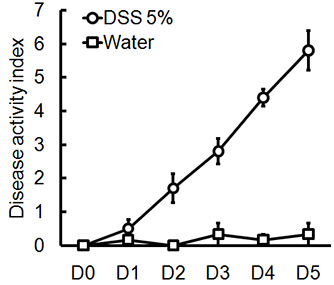
그림 1. 남성, C57BL / 6 생쥐은 5 일 동안 물을 마시는 5 %의 DSS를 부여했다. 다이 점수는 각 동물에 대해 매일 평가되었으며 (± SEM, N = 4 마우스 / 그룹을 의미) 각 그룹에 대해 하루 평균되었습니다.
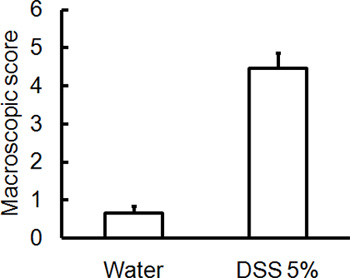
그림 2. C57BL / 6 생쥐은 5 일 동안 마시는 물에 5 % DSS를 부여했다. 컨트롤 마우스는 DSS없이 물을 받았다. 매크로 손상 점수 / 질병 심각도 점수는 맹목적 5 일 이후 DSS 유도된 대장염에 대한 평가했다. DSS를받은 생쥐로부터 격리 콜론 높은 매크로 손상 점수 (직장 출혈, 직장 탈출증, 설사, colonic 출혈)보다 질병 심각도 (± SEM, N = 4 마우스 / 그룹을 의미) 표시했습니다.
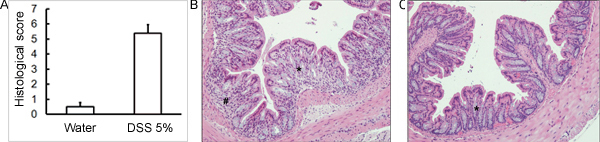
그림 3. C57BL / 6 마우스는 대장염을 유발하기 위해 마시는 물에 5 % DSS 솔루션을 제공했다. 제어 마우스 DSS없이 물을 받았다. (A) Histological 점수는 맹목적 5 일 이후 DSS 관리에 대한 수집 H & E 스테인드 colonic 조직 섹션을 사용하여 득점했다. (B) DSS - 처리된 샘플 (C) 컨트롤 (± SEM, N = 4 마우스 / 그룹을 의미)에 비해 더 많은 histological 손상 (자세한 세포 침투, 더 고블렛 셀 고갈, 큰 왜곡 / 토굴 아키텍처에 손상)를 보여줍니다. 년 (B)와 (C), 별표 (*) 고블렛 세포 고갈과 지하실 건축 왜곡의 영역을 나타냅니다, 숫자 기호 (#) 세포 침투를 나타냅니다.
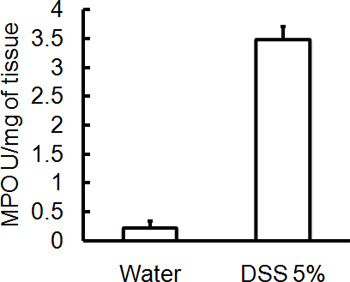
그림 4. 모든 마우스는 DSS와 colonic 조직 샘플 5 일 게시물 관리에 희생되었다는 MPO 활동을 평가하기 위해 수집되었다. DSS 유도된 대장염의 심각도는 컨트롤 (± SEM, N = 4 마우스 / 그룹 평균)에 비해 MPO 활동의 높은 수준과 관련있다.
_upload/3678/3678fig5.jpg "/>
그림 5. 높은 MPO 수준, DSS 유도된 대장염의 심각 이외에는 또한 IL - 1β, IL - 6, TNF - α와 같은 프로 염증의 크린 시토킨의 증가 수준 (± SEM, N = 4 쥐를 의미와 관련된 / 그룹).
표 1. 매크로 / 질병 심각도 점수
| 점수 | 직장의 출혈 | 직장 탈출증 | 대변 일관성 | 혈액 |
| 0 | 없음 | 없음 | 일반 | 일반 |
| 일 | 붉은 | 탈출증의 증상 | 부드러운 | 붉은 |
| 이 | 다크 레드 | 지우기 탈출 | 매우 부드러운 | 다크 레드 |
| 3 | 총의 출혈 | 광범위한 탈출 | 설사 | 검정 |
토론
DSS 대장염은 장의 염증의 널리 사용되는 화학적으로 유도된 모델입니다. 이 모델에서는, 마우스는 상피 세포를 직감하고 점막 장벽의 무결성을 방해하기 위해 독성 것으로 생각됩니다 DSS와 보충 식수 제공됩니다. DSS 10 관리가 느슨한 대변, 배설물 출혈이 특징입니다 급성 대장염을 유도, 그리고 granulocytes로 침투 10. DSS 관리하는 동안은 대장염은 일반적으로 배설물 잠혈 검사로 ?...
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
이 작품은 건강 연구의 캐나다 연구소에서 보조금 (CIHR)와 Crohn의과 캐나다의 대장염 재단 (CCFC)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약 / 장비의 이름 : | 회사 | 카탈로그 번호 | 댓글 |
| Eppendorf 안전 잠금 Microcentrifuge 튜브 (2mL) | eppendorf | 0030 120.094 | |
| Biotek EL808 흡광도 플레이트 리더 | Biotek | EL808 | |
| Dextran 황산염 나트륨 소금 시약 등급 (분자량 36,000-50,000 다) | MP의 Biomedicals | 160,110 | |
| Gen5 (소프트웨어) | Biotek | 버전 1.10.8 | |
| Hexadecyltrimethylammonium의 브로마이드 (HTAB) | 시그마 - 올드 리치 | H5882 - 100G | |
| 과산화수소, 물 30 wt. % 용액 | 시그마 - 올드 리치 | 216,763 | 2-8에 보관 ° C |
| Microtest PL96 - 웰 평면 바닥을 먹은 | Sarstedt | 82.1581 | 단일 목적으로만 사용 |
| O - Dianisidine | 시그마 - 올드 리치 | D - 3252 | 민감한 빛. 2-8에 보관 ° C |
| 인산 칼륨, 이염 | Caledon | 6620-1 | |
| 인산 칼륨, 일염기의 | EMD 화학 | PX1565 - 1 | |
| 테아제 억제제 칵테일 | 시그마 - 올드 리치 | P8340 | -20 ° C에 보관 |
| 트리톤 X - 100 | 시그마 - 올드 리치 | T8787 | |
| 조직 Lyser II에 대한 텅스텐 탄화물 비즈 | QUIAGEN | 69,997 |
참고문헌
- Sands, B. E. From symptom to diagnosis: clinical distinctions among various forms of intestinal inflammation. Gastroenterology. 126, 1518-1532 (2004).
- Danese, S., Fiocchi, C. Etiopathogenesis of inflammatory bowel diseases. World J. Gastroenterol. 12, 4807-4812 (2006).
- Wirtz, S., Neufert, C., Weigmann, B., Neurath, M. F. Chemically induced mouse models of intestinal inflammation. Nat. Protoc. 2, 541-546 (2007).
- Axelsson, L. G., Landstrom, E., Goldschmidt, T. J., Gronberg, A., Bylund-Fellenius, A. C. Dextran sulfate sodium (DSS) induced experimental colitis in immunodeficient mice: effects in CD4(+)-cell depleted, athymic and NK-cell depleted SCID mice. Inflamm. Res. 45, 181-191 (1996).
- Egger, B., Bajaj-Elliott, M., MacDonald, T. T., Inglin, R., Eysselein, V. E., Büchler, M. W. Characterisation of acute murine dextran sodium sulphate colitis: cytokine profile and dose dependency. Digestion. 62, 240-248 (2000).
- Krawisz, J. E., Sharon, P., Stenson, W. F. Quantitative assay for acute intestinal inflammation based on myeloperoxidase activity. Assessment of inflammation in rat and hamster models. Gastroenterology. 87, 1344-1350 (1984).
- Cooper, H. S., Murthy, S. N., Shah, R. S., Sedergran, D. J. Clinicopathologic study of dextran sulfate sodium experimental murine colitis. Lab. Invest. 69, 238-249 (1993).
- Smith, J. W., Castro, G. A. Relation of peroxidase activity in gut mucosa to inflammation. Am. J. Physiol. 234, R72-R79 (1978).
- Ghia, J. E., Blennerhassett, P., Kumar-Ondiveeran, H., Verdu, E. F., Collins, S. M. The vagus nerve: a tonic inhibitory influence associated with inflammatory bowel disease in a murine model. Gastroenterology. 131, 1122-1130 (2006).
- Okayasu, I., Hatakeyama, S., Yamada, M., Ohkusa, T., Inagaki, Y., Nakaya, R. A novel method in the induction of reliable experimental acute and chronic ulcerative colitis in mice. Gastroenterology. 98, 694-702 (1990).
- Solomon, L., Mansor, S., Mallon, P., Donnelly, E., Hoper, M., Loughrey, M., Kirk, S., Gardiner, K. The dextran sulphate sodium (DSS) model of colitis: an overview. Comparative Clinical Pathology. 19, 235-239 (2010).
- Mähler, M., Bristol, I. J., Leiter, E. H., Workman, A. E., Birkenmeier, E. H., Elson, C. O., Sundberg, J. P. Differential susceptibility of inbred mouse strains to dextran sulfate sodium-induced colitis. Am. J. Physiol. 274, G544-G551 (1998).
- Hans, W., Scholmerich, J., Gross, V., Falk, W. The role of the resident intestinal flora in acute and chronic dextran sulfate sodium-induced colitis in mice. Eur. J. Gastroenterol. Hepatol. 12, 267-273 (2000).
- Rath, H. C., Schultz, M., Freitag, R., Dieleman, L. A., Li, F., Linde, H., Schölmerich, J., Sartor, R. B. Different subsets of enteric bacteria induce and perpetuate experimental colitis in rats and mice. Infect. Immun. 69, 2277-2285 (2001).
- Ghia, J. E., Li, N., Wang, H., Collins, M., Deng, Y., El-Sharkawy, R. T., Côté, F., Mallet, J., Khan, W. I. Serotonin has a key role in pathogenesis of experimental colitis. Gastroenterology. 137, 1649-1660 (2009).
- Elson, C. O., Beagley, K. W., Sharmanov, A. T., Fujihashi, K., Kiyono, H., Tennyson, G. S., Cong, Y., Black, C. A., Ridwan, B. W., McGhee, J. R. Hapten-induced model of murine inflammatory bowel disease: mucosa immune responses and protection by tolerance. J. Immunol. 157, 2174-2185 (1996).
- Dieleman, L. A., Ridwan, B. U., Tennyson, G. S., Beagley, K. W., Bucy, R. P., Elson, C. O. Dextran sulfate sodium-induced colitis occurs in severe combined immunodeficient mice. Gastroenterology. 107, 1643-1652 (1994).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유