Method Article
Isolieren von Mesangiogenic Progenitorzellen (MPL) aus menschlichem Knochenmark
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Here we describe an optimized, highly reproducible protocol to isolate Mesodermal Progenitor Cells (MPCs) from human bone marrow (hBM). MPCs were characterized by flow cytometry and nestin expression. They showed the ability to give rise to exponentially growing MSC-like cell cultures while retaining their angiogenic potential.
Zusammenfassung
In a research study aimed to isolate human bone marrow (hBM)-derived Mesenchymal Stromal Cells (MSCs) for clinical applications, we identified a novel cell population specifically selected for growth in human serum supplemented medium. These cells are characterized by morphological, phenotypic, and molecular features distinct from MSCs and we named them Mesodermal Progenitor Cells (MPCs). MPCs are round, with a thick highly refringent core region; they show strong, trypsin resistant adherence to plastic. Failure to expand MPCs directly revealed that they are slow in cycling. This is as also suggested by Ki-67 negativity. On the other hand, culturing MPCs in standard medium designed for MSC expansion, gave rise to a population of exponentially growing MSC-like cells. Besides showing mesenchymal differentiation capacity MPCs retained angiogenic potential, confirming their multiple lineage progenitor nature. Here we describe an optimized highly reproducible protocol to isolate and characterize hBM-MPCs by flow cytometry (CD73, CD90, CD31, and CD45), nestin expression, and F-actin organization. Protocols for mesengenic and angiogenic differentiation of MPCs are also provided. Here we also suggest a more appropriate nomenclature for these cells, which has been re-named as "Mesangiogenic Progenitor Cells".
Einleitung
Mesenchymale Stromazellen (MSCs) sind von relevanten klinischen Wert für ihre Multilinien Differenzierungsfähigkeit und ihre Fähigkeit , die Blutbildung zu unterstützen, zu sezernieren Wachstumsfaktoren / Zytokine sowie eine Rolle in der Immunregulation 1 spielen. In der Definition von MSC-basierte Therapien Zellproduktion und Anwendung haben sich die Aufgabe gestellt umfangreichen klinischen und präklinischen Forschung 2, mit besonderem Augenmerk auf spezifische internationale Regelung für die Sicherheit und Wirksamkeit von zellbasierten Arzneimittel (CBMP) Behandlungen 3. Menschliche MSCs sind ausführlich in Medien kultiviert Ergänzungsmittel und Reagenzien von tierischen Ursprungs, wie fötalem Rinderserum (FBS) und Rinder-Trypsin enthält. Daher neben mit Infektionsrisiken im Zusammenhang mit Zellmanipulation, Patienten auch Prion-Exposition sowie immunologische Risiken im Zusammenhang mit Proteinen, Peptiden oder anderen Biomolekülen tierischen Ursprungs stellen, die nach der Zellernte und TRANS bestehen könntetation 4.
Um das Problem zu umgehen, kultiviert wir dem menschlichen Knochenmark (HBM) abgeleitetes MSCs in tierfreien Medium, ersetzt FBS mit gepoolten menschlichen Typ AB-Serum (PhAbs). Unter diesen Bedingungen neben wachsenden MSCs identifizierten wir eine neuartige Zellpopulation. Diese Zellen wurden morphologisch und phänotypisch unterschiedlich von MSCs und zeigte eine ausgeprägte Genexpressionsprofil sowie charakteristische Anbau / Haftungseigenschaften. Sie behielten beide mesengenic und angiogene Potential und wurden daher mesodermalen Progenitorzellen (MPL) 5 genannt. Anschließend konnten wir selektive und reproduzierbare Kulturbedingungen zu definieren MPCs bei hohen Grad von Reinheit 6 zu erzeugen.
Wir untersuchten weiter die morphologischen und biologischen Eigenschaften von MPL. Die MPL zeigte durch lange Telomere 5 gekennzeichnet Nestin-positiv, langsam im Radsport, Ki-67-negativ, und mit den Chromosomen zu sein. Sie drückten Pluripotency-assoziierten Transkriptionsfaktoren Oct-4 und Nanog statt MSC Master Regler Runx2 und Sox9 7. Phenotypisch, ausgedrückt MPCs Endoglin (CD105) auf einer niedrigeren Ebene als MSCs während mesenchymalen Marker CD73, CD90, CD166 fehlt. MPCs zeigte auch ein charakteristisches Muster von Adhäsionsmolekülen durch konsequente Expression von PECAM (CD31) , dadurch gekennzeichnet, Integrine & alpha; L (CD11a), & alpha; M (CD11b), & agr; X (CD11c) sowie Integrin β2 (CD18) , die podosome artige Strukturen spezifisch aufrecht 8 . Im Standard - MSC Expansion Medien, MPCs prompt in MSCs durch eine Zwischenstufe differenziert mit der Aktivierung von Wnt5 / Calmodulin Zellsignal 9. MPCs behielt auch angiogene Eigenschaften, wie durch ihre Fähigkeit unter Beweis gestellt von Sphäroiden in murine extrazellulären Matrix (ECM) Protein 3D-Kulturen zu sprießen. Die angiogene Potential wurde schnell nach MPC Differenzierung entlang der mesengenic Linie verloren.
Hier präsentieren wir proProtokolle optimiert zu isolieren und zu hochgereinigten MPCs von HBM Blutproben zu charakterisieren. Reproduzierbare Protokolle für MPC mesengenic und angiogene Differenzierung werden ebenfalls beschrieben.
Protokoll
HINWEIS: Nach der schriftlichen Zustimmung HBM Proben wurden während der orthopädischen Chirurgie für Hüftoperation erhalten. Unmittelbar nach dem Oberschenkelhals Osteotomie und vor femoralis eine 20-ml-Spritze, die 500 UI von Heparin Aufreiben, verwendet wurde frisch BM abzusaugen. Das Protokoll ist allgemein anwendbar auf jede BM Quelle betrachtet werden.
1. Isolierung von menschlichem Knochenmark mononukleären Zellen (HBM-MNU)
- Verdünnte von 5 bis 10 ml frischem BM bis 50 ml, Aufbringen Dulbeccos phosphatgepufferter Salzlösung (D-PBS) und durch Invertieren mischen. verteilen Ebenso 25 ml in zwei neue 50 ml konische Röhrchen, 25 ml D-PBS zu jedem Röhrchen und mischen durch Umdrehen.
- Ermöglichen die Röhrchen für 10 min bei Raumtemperatur stehen, zur Trennung mineralischer Knochenfragmenten und Fett aus der Lösung.
- Entfernen Sie vorsichtig mit einer sterilen Pasteur-Pipette und Filterzellsuspension durch 70 & mgr; m Filter ohne Störung des Mineralknochenfragment Pellet Floating Fett.
- Stellen Sie vier 50-ml-Röhrchen mit 15 ml Medium für diskontinuierliche Dichtegradientenzentrifugation (1,077 g / ml). Stellen Sie sicher, dass dieses Medium bei Raumtemperatur ist.
- Sanft legen 20 bis 25 ml verdünntem BM oben auf Dichtegradientenmedium. Diese Operation sorgfältig Zellsuspension trickle an den Rohrwänden zu lassen Mischungsschichten zu verhindern.
- Durchführung Dichtegradienten Zentrifugation bei 400 xg für 30 min bei Raumtemperatur mit Bremse deaktiviert.
- Sammeln Sie die weißlich Ring zwischen den beiden Phasen befindlichen Zellen mit einer sterilen Pasteurpipette und übertragen sie in ein frisches 50-ml-Tube.
- Wasche die Zellen mit frischem Kulturmedium: Phenolrot-frei, niedrige Glukose (1000 mg / l) nach Dulbecco modifiziertem Eagle-Medium (DMEM), 10% (v / v) gepooltem humanem AB-Typ-Serum (PhAbs), 2 mM L-Glutamin und Antibiotika (DMEM / 10% PhAbs). Zentrifuge bei 400 × g für 5 min.
- Überstand entfernen und wieder auszusetzen Pellet in 5-10 ml frischem DMEM / 10% PhAbs.
- Fahren Sie mit Zellzahl.Bestimmen Sie die Anzahl der weißen Blutkörperchen durch 1: 1-Verdünnung in Trypanblau. Wenden Sie diese auf die Zählkammer und beobachten unter einem Phasenkontrastmikroskop. Ausschließen klein und perfekt abgerundeten Erythrozyten und blau gefärbten toten Zellen aus der Zellzahl.
HINWEIS: Es wird dringend für ihre Leistung in MPC Recovery Bildschirm PhAbs Chargen empfohlen. PhAbs aus den USA Quellen haben die besten Ergebnisse, während die meisten Seren unterschiedlicher Herkunft in MPC Kulturen mit höheren Anteilen von MSC-ähnlichen Zellen resultierte gegeben.
2. Isolierung von MPL von HBM-MNU
- Set hydrophobe T-75 - Kolben mit 15 ml frischem DMEM / 10% PhAbs und lassen pH und Temperatur durch Vorinkubation in 5% CO 2 für 30 min bei 37 ° C äquilibrieren.
- Seed 4 - 6 x 10 7 HBM-MNU pro Kolben und Inkubieren bei 37 ° C in 5% CO 2 für 48 Stunden.
- Absaugen und Medium und nicht haftenden Zellen aus den Kolben zu verwerfen. 15 ml frischem DMEM / 10% PhAbs und Inkubation bei 37 ° Cin 5% CO 2. Pflegen Kulturen für 6 - 8 Tage Mediumwechsel alle 48 Stunden.
OPTIONAL: MPC Rendite, nicht haftenden Zellen von 2,3 zu erhöhen, erneut plattiert in einem neuen Kulturflasche und gepflegt für die Primärkulturen wie beschrieben werden könnte. - Absaugen und entsorgen Medium aus den Kolben, waschen mit frischem DMEM und 2 ml freier Protease Tier Ablösen Lösung. bei 37 ° C inkubieren 5 bis 15 min (Vermeidung längerer Inkubation).
- 10 ml frischem DMEM / 10% PhAbs absaugen Zellsuspension und Zentrifuge bei 400 xg für 5 min
- Absaugen und Überstand verwerfen und erneut zu suspendieren Pellet in 1 bis 2 ml frischem DMEM / 10% PhAbs. Fahren Sie mit Zellzahl, wie in Schritt 1.10 beschrieben.
HINWEIS: Verwenden Sie Trypsin / EDTA nicht als Reagenz löst. MPCs sind Trypsin resistent. Morphologische Screening der Kulturen, vor der Zellernte, wird dringend empfohlen, um das Vorhandensein von spindelförmigen MSC-ähnlichen Zellen zu bewerten. Im Falle beträchtliche Menge an MSC-ähnlichen Zellen sind detected, erhöhen die Reinheit des Zellprodukt durch selektives die verunreinigten Zellen zu entfernen. Dazu kann Trypsinverdaus vor durchgeführt werden, um MPC Ernte, durch Zugabe von 2 ml Trypsin / EDTA 0,05% für 2 min. Wasch Kulturen zweimal mit 5 ml DMEM / 10% PhAbs, dann gehen die Behandlung wie oben Protease ist.
3. Zell Characterization
- Durchflusszytometrie
- Einrichten Doppelproben von 10 5 frisch abgelösten Zellen in Waschlösung D-PBS ergänzt mit 0,5% (v / v) Rinderserumalbumin (BSA) und 0,02% (w / v) Natriumazid. Zentrifuge bei 400 × g für 5 min.
ACHTUNG: Natriumazid ist giftig. - Re-suspendieren Pellets in 200 ul Waschlösung und fügen anti-CD90, anti-CD45, anti-CD73 und anti-CD31-Antikörper, konjugiert mit fluoreszierendem Farbstoffen ( "Test"); parallel Isotypkontrollen einrichten ( "CTRL").
HINWEIS: Die Mengen Antikörper-Färbung sollte durch Titration oder accor bestimmt werdending den Anweisungen des Herstellers. - Inkubieren Proben bei 4 ° C für 30 min.
- Zentrifuge bei 400 × g für 5 min. Re-suspendieren Zellen in 500 & mgr; l Waschlösung und erwerben mindestens 5 x 10 4 Ereignissen auf Mehrfarben Durchflusszytometer 7 9 10.
- Analysieren Ergebnisse durch Dot-Plots und mit "CTRL" aufgezeichneten Ereignisse Quadranten zu setzen.
HINWEIS: Um die Kultur als MPC Kultur der Anteil der CD73 neg CD90 neg CD45 + CD31 + Zellen zu definieren , sollte mehr als 95% betragen. Für einige spezifische Anwendungen, dh Genexpressionsanalyse hat der Wiederherstellungs cut-off bis 97 erhöht werden - 98%.
- Einrichten Doppelproben von 10 5 frisch abgelösten Zellen in Waschlösung D-PBS ergänzt mit 0,5% (v / v) Rinderserumalbumin (BSA) und 0,02% (w / v) Natriumazid. Zentrifuge bei 400 × g für 5 min.
- Nestin Erkennung und F-Actin-Organisation Analyse
- Teller frisch isolierten MPCs auf Kulturkammer Dias (20.000 / cm 2). Erlauben Zellen durch Inkubation über Nacht bei 37 ° C in 5% CO 2 anhaften.
- Wash-Zellen in Waschlösung und fix in 4% (w / v) Paraformaldehyd bei Raumtemperatur für 15 min. Zum Entfernen Fixiermittel Waschlösung hinzufügen, Inkubation für 2 Minuten und gießen.
- Wiederholen Waschen zweimal.
- Permeabilisieren Zellen in D-PBS, supplementiert mit 0,05% (v / v) Triton X-100 für 15 min bei RT.
- Stopp-Reaktion durch Protein freien Signalverstärker (30 min bei RT) oder Standard-Blockierungslösung (D-PBS, ergänzt mit 3% (w / v) BSA).
- Entfernen Sie Signalverstärker / Blocking-Lösung.
- ADD 7 & mgr; g / ml (w / v) von anti-humanen Nestin primären Antikörper und Inkubieren bei 4 ° C über Nacht in einer befeuchteten Kammer. Parallel dazu verwenden Isotypiekontrolle Antikörper keine spezifischen Fluoreszenzsignale zu bewerten.
- Waschen Sie gleitet durch D-PBS Zugabe, lassen für 2 Minuten und gießen. Zweimal wiederholen.
- Fügen Sie 2 & mgr; g / ml (w / v) der Fluoreszenzfarbstoff konjugierten sekundären Antikörper und Inkubieren bei 4 ° C für 1 Stunde im Dunkeln.
- Wash gleitet wie oben.
- In fluoreszierenden Phalloidin (5 UI / ml), lassen bei RT für 30 min im Dunkeln und wasche 3mal in D-PBS.
- Entfernen Sie die Kammerwände und montieren Folien in wässrigen Eindeckmittel mit Antifade Reagenz ergänzt und 4 ', 6-diamidino-2-phenylindole (DAPI) für Kerne Erkennung. Gehen Sie 7 9 10 bis Bildgebung.
4. Mesengenic Differenzierung von MPL
- Plate 2 x 10 4 / cm 2 frisch isolierten MPCs in TC-behandelt T75 Kulturflaschen und lassen Zellen anhaften über Nacht in DMEM / 10% PhAbs bei 37 ° C in 5% CO 2.
- Ersetzen DMEM / 10% PhAbs mit Standard reduzierten Serummedium, etwa 200 & mgr; l / cm 2, bestimmt für mesenchymale Stromazellen Expansion (MSC-RS - Medium). Zellen wachsen zu Konfluenz (P1-MSCs), typischerweise von 7 bis 10 Tagen von der Induktion. Aktualisieren Medium alle 2 Tage.
- Absaugen und entsorgen Medium aus den Kolben, waschen mit frischem MSC-RS-Medium und 2 ml freier Protease Tier Ablösen Lösung. Inkubieren bei 3776; C für 5 bis 15 min (Vermeidung längerer Inkubation).
- 10 ml frisch MSC-RS Medium absaugen Zellsuspension und Zentrifuge bei 400 xg für 5 min
- Überstand entfernen und wieder auszusetzen Pellet in 1 bis 2 ml frischem MSC-RS Medium. Fahren Sie mit Zellzahl wie in Schritt 1.10
- Gehen Sie zur Subkultur sie durch Impfen von 3 bis 5 x 10 3 Zellen / cm 2. Wachsen Zellen bis zur Konfluenz (P2-MSCs).
- Ernten Sie die Zellen durch Protease Verdauung von Schritt beschrieben 4.3 4.5 zu Schritt und Charakterisierung gehen Sie wie in Abschnitt 3 beschrieben.
HINWEIS: Ein bestimmter Prozentsatz von CD73 + CD90 + CD45 neg CD31 neg Zellen weniger als 95% würden nur eine partielle Differenzierung zeigen und eine weitere Kulturpassage erfordern. - Platte P2-MSCs bei 2 x 10 4 / cm 2 in sechs gut TC-behandelten Platten und wachsen in MSC-RS - Medium bis zur Konfluenz.
- Mark zwei Brunnen als "No Diff" und aktualisieren Sie MSC-RS Medium.
- Mark zwei guts als "Osteo" und ersetzen Medium mit 200 & mgr; l / cm 2 von Standard osteogenen Medium, die speziell für die Differenzierung MSC konzipiert.
- Mark zwei Brunnen als "Adipo" und ersetzen Medium mit 200 & mgr; l / cm 2 von Standard adipogenetische Medium, das speziell für die MSC - Differenzierung.
- Pflegen Kulturen bei 37 ° C in 5% CO 2 von der gesamten Medien jede 48 Stunden ändern.
HINWEIS: Es ist sehr kommerziell erhältlichen Standard Differenzierungsmedien für Test Reproduzierbarkeit empfohlen zu verwenden. Nach 2/3 Wochen unter Differenzierungsbedingungen, erscheinen Kalziumablagerungen in den Kulturen osteogenen induziert, während die intrazelluläre Akkumulation Lipidtröpfchen in adipogenetische induzierten Zellen zu erkennen ist. - Absaugen und entsorgen Kulturmedien waschen dann mit D-PBS.
- Fix die Kulturen durch Zugabe von 1 ml von 4% (w / v) Paraformaldehyd für 15 min bei Raumtemperatur.
- Zum Entfernen Fixiermittel hinzufügen 2 min D-PBS, Inkubation und gießen. Wiederholen Waschenzweimal.
- Stain ein "Nein Diff" zusammen mit den beiden "Osteo" Brunnen markiert in Hydroxyapatit spezifische fluoreszierende Lösung und ein "Nein Diff" zusammen mit den beiden "Adipo" Brunnen markiert in 200 nM Nile Red-Lösung. Inkubieren für 30 Minuten bei Raumtemperatur 11,12.
- Entfernen Sie Lösungen Färbung und waschen in D-PBS zweimal.
- Entfernen D-PBS, fügen D-PBS , ergänzt mit 50% (v / v) Glycerin und fahren Sie mit Imaging - 7 9 10.
5. MPC Sphäroid Sprouting Assay
- Zur Herstellung von 3D - Sphäroiden, lag 20 ul Tropfen frisch isolierten MPC - Suspension (1,5 x 10 4 Zellen / Tropfen) auf der inneren Oberfläche der Petrischale mit Deckel.
HINWEIS: Handhabung Tropfen zu ihren Bruch führen könnten, ist es sehr empfehlenswert ist, sie über zu legen. - Verwenden Sie den Deckel vorsichtig eine Petrischale mit D-PBS zu rekapitulieren hängenden Tropfen Verdunstung zu verhindern. Inkubieren bei 37 ° C in 5% CO 2über Nacht Zellen zu ermöglichen in 3D Sphäroide zu aggregieren.
- Legen Sie ein dickes Gel von murinen extrazellulären Matrix (ECM) Proteine durch Zugabe von 300 ul Aliquots von Standard-ECM-Proteine in einem vorgekühlte 24-Well-Kulturplatte, und bei 37 ° C für 30 min.
- Vorsichtig die Schalendeckel Petri umkippen und sanft die Sphäroiden mit einer sterilen Pasteur-Pipette abholen.
- Lay Sphäroiden auf das ECM - Protein - Gel, fügen 700 ul Aliquots von Standard - VEGF-reiche endothelialen Zellwachstumsmedium und Inkubation bei 37 ° C in 5% CO 2.
- Nach 24 Stunden und 7 Tage der Kultur, machen Sie Fotos von der 3D-Kulturen bei Vergrösserungs 4X. Auswerten von Sphäroiden sprießen die Anwendung der Bildanalyse-Software durch den radialen Abstand zwischen dem letzten eindringenden Zelle und dem Sphäroid Kante zu messen. Wiederholungsmaßnahmen entlang mindestens 20 verschiedenen Richtungen. Der mittlere Abstand wird als positiv angesehen, wenn 50 & mgr; m oder mehr beträgt.
Ergebnisse
Die selektiven Kulturbedingungen hier beschrieben haben , die Isolierung eines neuartigen haftend und fast monomorphic Zellpopulation als 1,0% des HBM-MNU erlaubt (0,5-2,0 x 10 6 HBM-MNU von 5 bis 10 ml frischem BM Proben) 5,6 . Wir identifizierten diese große (40 - 60 & mgr; m im Durchmesser), gerundet, Ruhe, Ki-67-negativen Zellen als MPL 5. Morphologisch, werden sie durch eine ausgeprägte Spiegelei-Form mit einem dicken Kernbereich durch einen flachen , dünnen Rand zeigt viele Filopodien bei höheren Vergrößerungsleistung (weiße Pfeile in Abbildung 1 A.1) umgeben gekennzeichnet. Polar Dehnung der äußeren Zellgrenze wird häufig beobachtet (schwarze Pfeile in Abbildung 1 A.1). Solche Morphologie ist deutlich verschieden von der typischen spindelförmigen Aussehen mesenchymalen Stromazellen in Standard MSC Kulturen berichtet. Durchfluss-Zytometrie zeigte über 95% der frisch isolierten MPCs CD31 und CD45, während m auszudrückenesenchymal assoziierte Marker CD90 und CD73 13 waren nicht nachweisbar (Abbildung 1 A.2). Wir betrachten dies eingeschränkten Satz von vier Antigene für die MPL als Hinweis. Weitere Unterscheidungsmerkmale der MPCs sind punktierte F-Aktin Verteilung eine Anzahl von podosome artigen Strukturen (rot in Abbildung 1 A.3) und intensive Expression von Nestin (grün in Abbildung 1 A.3) offenbart, das nicht in den Zellen festgestellt wird gefärbt mit Isotypiekontrolle Antikörper (Daten nicht gezeigt).
Die Kultivierung MPCs in Standard - RS - Medium konzipiert für MSC Expansion führt zu einer schnellen Differenzierung in exponentiell wachsenden MSC-ähnlichen Zellen (Abbildung 1 B.1). Nach zwei Passagen Zellen schließlich ihren Phänotyp von CD73 neg CD90 neg CD45 + CD31 + CD73 + zu CD90 + CD45 neg CD31 neg (Abbildung 1 B.2) wechseln. In dem Prozess, MPCs Wieder organize F-Aktin in Stressfasern während nestin Ausdruck zu einigen seltenen Zellen (Abbildung 1 B.3) beschränkt wird. MPC mesengenic Differenzierung in eine bestimmte MSC-ähnlichen Phänotyp erfolgt durch zwei verschiedene Schritte, die von verschiedenen Zell Morphologien enthüllt. Nach einer Woche in MSC RS Medium eine Restpopulation von MPC-ähnlichen Zellen noch nachweisbar innerhalb einer konfluenten Schicht von flachen, polygonalen mehrfach verzweigten Zellen (P1-MSCs in Abbildung 2 A). Ein weiterer Durchgang erforderlich , um eine fast monomorphe Kultur von spindelförmigen MSC-ähnliche Zellen (P2-MSCs in Figur 2 A) zu erhalten. Diese exponentiell wachsende Zellen können leicht unterscheiden zu Osteoblasten oder Adipozyten wenn sie für mindestens 2 Wochen in Selektionsmedien überführt, wodurch deren MSC Art bestätigt. In osteogenen induzierten Kulturen, entweder durch kolorimetrische Alizarin-S - Färbung oder spezifische fluoreszierende Farbstoffe (grün in Abbildung 2 B) erfasst werden , um Ablagerungen Kalzium kann. Nach adipogenetische Induktions Zellenzeigen Lipidtröpfchen Akkumulation als entweder durch kolorimetrische Oil Red oder fluoreszierende Nile Red - Färbung (rot in Abbildung 2 B) ergab.
MPC Typisierung wurde durch Sprossung Angiogenese-Test bestätigt. MPCs zeigte ihre Fähigkeit , von 3D - Sphäroiden nach 24 Stunden VEGF-Stimulus (Abbildung 2 C) (mehr als 50 & mgr; m) murine ECM - Protein - Gel einzudringen. 600 & mgr; m Abstand - Nach einer Woche eindringenden Zellen wurden bei 300 festgestellt. Im Gegensatz dazu wurde Invasion Kapazität nach mesengenic Differenzierung in P2-MSCs verloren (Abbildung 2 D).
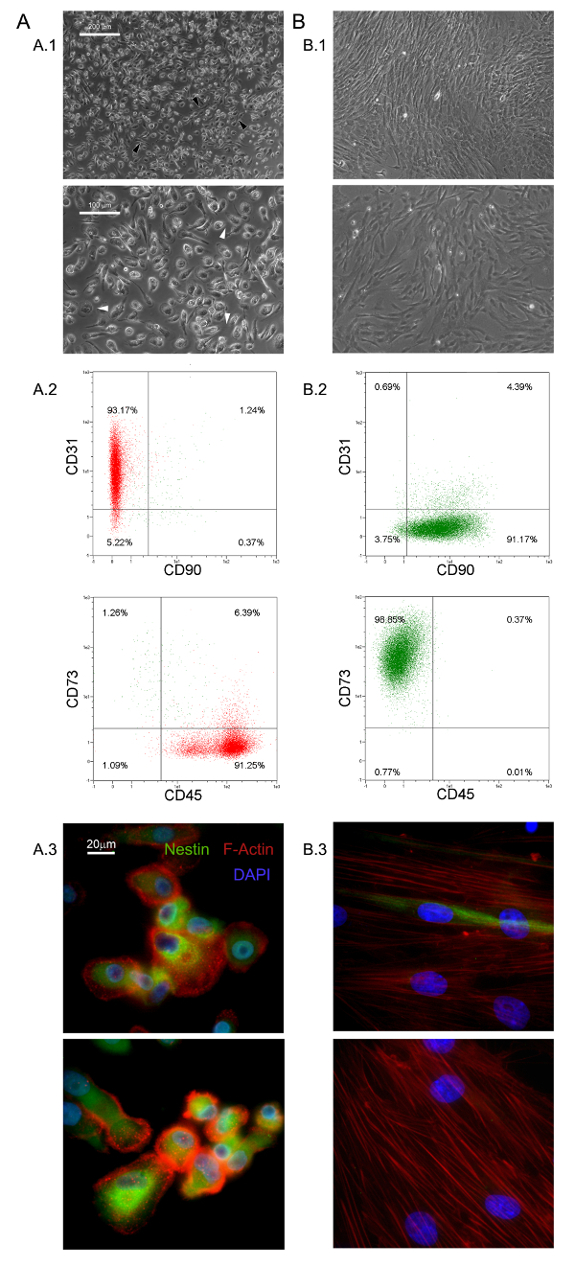
Abbildung 1. Frisch isolierte MPCs haben Besondere Merkmale. Die Anzucht HBM-MNU in DMEM / 10% PhAbs für sieben Tage gibt Anlass zu einer Bevölkerung von Ruhe MPL (A) leicht von MSCs (B) in Bezug auf die Morphologie (A.1, B.1, Maßstabsbalken = 100 & mgr; m), Phänotyp (A.2, B.2), F-Actin-Verteilung (rot in A.3, B.3) und nestin Ausdruck (grün in A.3, B.3, Maßstabsbalken = 20 & mgr; m). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
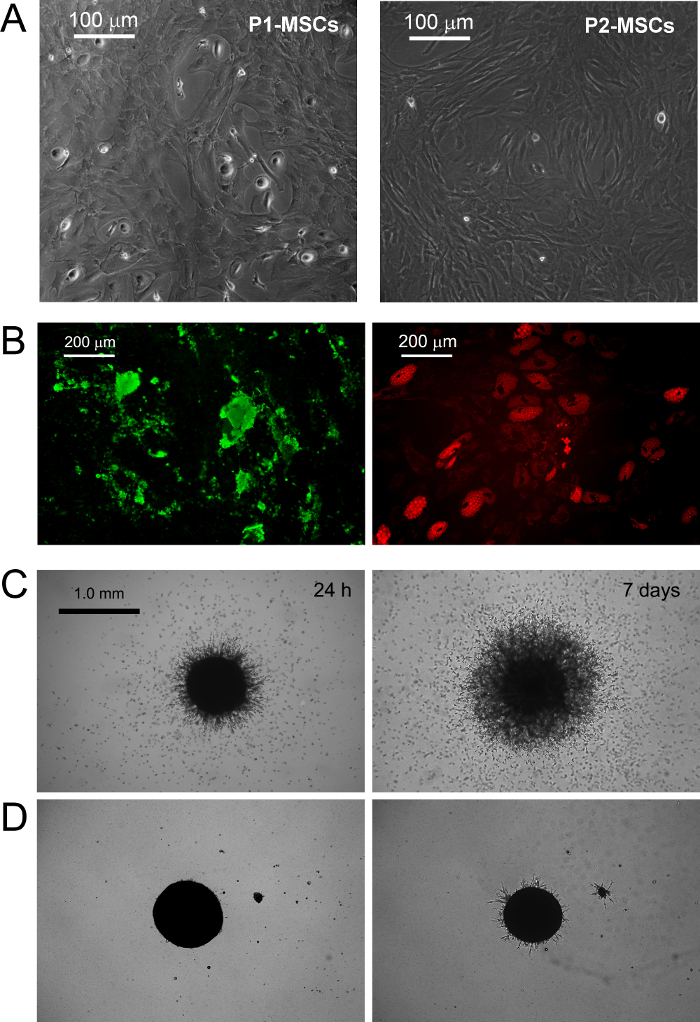
Abbildung 2. MPCs Differenzieren in Standard - MSCs und zeigen Sprießen Angiogenesis in vitro. Ersatz von DMEM / PhAbs mit handelsüblichen RS - Medium konzipiert für MSC Expansion löst mesengenic Induktion von MPL. Nach einer Woche in Kultur sind wenige Rest MPL noch nachweisbar (P1-MSCs) , während eine weitere Passage in MSC-RS Medium führt zu einer Population von konfluenten MSC-ähnlichen Zellen (P2-MSCs, ein Maßstabsbalken = 100 & mgr; m). P2-MSCs unterscheiden terminal in Osteozyten oder Adipozyten unter geeigneten Stimuli , wie durch Kalkablagerung (grün in B) und Lipidtröpfchen Ansammlung (Rot in B, Maßstabsbalken = 200 & mgr; m) ergab, respectively. MPCs zeigen konsistente Sprießen von Sphäroiden in murine ECM - Protein - Gel (C) bei einer Differenz mit P2-MSCs (D, Maßstabsbalken = 1,0 mm). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Diskussion
In the last decades, MSCs have been extensively researched and pre-clinically evaluated for possible application in the treatment of various bone/articular, immunological, neurological, cardiovascular, gastrointestinal and hematological disorders14,15. The easy and inexpensive isolation of multipotent MSCs, from many different tissues, together with their lack of significant immunogenicity16, contribute to make these cells one of the most interesting cell population to be applied in cell based therapies. Nonetheless, the very low frequency in the tissue of origin represents a great limitation to the MSCs application in clinics, forcing the expansion of these cells, in vitro, before the infusion or transplantation.
Expanded MSC cultures have revealed high grades of heterogeneity and variability17-19 making it difficult to reach a consensus about MSC production and characterization protocols. Moreover, recent investigations suggested the presence of multiple in vivo MSC ancestors in a wide range of tissues, which contribute to culture heterogeneity10,20. In fact, it has been proposed that particular culture conditions possibly select or simply promote specific sub-populations of MSCs progenitors present, in various percentages, in "crude" and unprocessed samples like bone marrow (hBM-MNCs) or adipose tissues (stromal vascular fraction)2. Thus, the variability in MSC-initiating cell populations together with the great number of different enrichment/isolation and culture protocols applied, represent a great obstacle to the definition of feasible MSC-based therapies.
A crucial factor affecting heterogeneity of MSC cultures is serum supplementation21. In our hands replacement of FBS with PhABS in primary cultures from hBM-MNCs, combined with high density seeding on hydrophobic plastics, led to the isolation of a novel highly adherent cell population with distinct biological features named MPCs5,6. We observed that the addition of small percentages of PhABS to FBS primary cultures also allowed MPC isolation, suggesting the presence of MPC inducing agents in the human serum6. At the moment, the MPC isolation/characterization protocol is a unique method available to obtain almost pure MPCs. The protocol has been carefully adjusted and it is highly reproducible for quality screening of MPC preparations before further applications.
MPCs could be used as a source for MSC production, thus limiting the variability introduced by use of unfractionated starting material. The precise definition of the multiple steps characterizing MPC mesengenic differentiation reported9 would allow synchronized mesenchymal cell expansion. Nonetheless, this latest condition could be realized exclusively applying highly purified MPC population, as a consequence the characterization of the cell products obtained by the protocol described here, results of crucial importance. This isolating method has been reported allowing MPC recovery with purity generally around 95%. However, donor/patient variability together with the variability related to the different batches of human pooled serum applied, could lead to a significant percentage of MSC-like cells co-isolated together with MPCs, under selective conditions.
It is not clear if these "contaminating" MSC-like cells could arise from the other different in vivo progenitors described in bone marrow22 or from uncontrolled and spontaneous MPC differentiation. In any case, a consistent percentage of MSC-like cells in the MPC products nullify the possibility to applying these cells as homogeneous starting material for the MSC expansion. Thus, here it has been suggested a simple and inexpensive method, based on the MPC resistance to trypsin digestion, increasing the purity of the MPC products. Similar or even better results in purifying MPC cultures could be achieved by fluorescent or magnetic cell sorting performing CD73 and/or CD90 depletion, but significantly prolonging the process time and increasing the costs.
Moreover, MPCs showed expression of pluripotency-associated markers and Nestin, all rapidly lost during mesengenic differentiation7. Sprouting assay revealed MPC ability to invade murine ECM protein gel. Taken together these results indicate that MPCs have to be considered a more immature progenitor, retaining angiogenic potential. Nonetheless, the initial enthusiasm about mesodermal differentiation potential of MPCs is actually waning. In fact, after more than 7 years of studies on MPCs, mesengenic and angiogenic potential have been extensively described5-9, but differentiation toward any other cells of mesodermal origin is still lacking. Thus, here we propose a new, and more rigorous, definition of these cells as "Mesangiogenic Progenitor Cells", maintaining the acronym MPCs.
We also believe that most controversies about MSC angiogenic potential could be related to the heterogeneous composition of expanded cultures consisting of sub-populations of MPCs and MSCs in variable percentages23.
Finally, MPCs could also play a crucial role for the implementation of CBMPs applicable for tissue reconstruction, as these cells could also support the neo-vascularization. In fact, future studies on regeneration should take in consideration that the newly formed tissue growth should be supported by concomitant neo-angiogenesis. The co-existence of mesengenic and angiogenic potential in MPCs could significantly improve the regeneration potential of new therapeutic approaches that involve these interesting cells.
Offenlegungen
The authors have no competing financial interests or other conflicts of interest.
Danksagungen
Die Autoren möchten sich besonders Dr. Paolo Parchi, Abteilung für Chirurgische, medizinische und molekulare Pathologie und Critical Care Medicine, Universität von Pisa, für die Bereitstellung von Knochenmarkproben und sein Know-how in der menschlichen Osteo-Vorläufern zu danken
Materialien
| Name | Company | Catalog Number | Comments |
| Matrigel Basement Membrane Matrix | BD Bioscience (San Jose, CA-USA) | 354230 | Murine ECM proteins Stock Concentration: 100% (9 - 12 mg/ml) Final Concentration: 100% |
| Dulbecco's Phosphate-Buffered Saline (D-PBS) | Sigma (St. Louis, MO, USA) | D8537 | |
| 70 μm Filters | Miltenyi Biotec (BergischGladbach, Germany) | 130-095-823 | |
| Ficoll-Paque PREMIUM | GE Healthcare (Uppsala, Sweden) | 17-5442-03 | medium for discontinuos density gradient centrifugation |
| Pooled human AB type serum (PhABS) | LONZA (Walkersville MD-USA) | 14-490E | Final Concentration: 10% |
| Glutamax-I | ThermoFisher (Waltham, MA USA) | 35050-038 | Stabilized L-Glutamine Stock Concentration: 100x Final Concentration: 2 mM |
| Bovine Serum Albumin (BSA) | Sigma (St. Louis, MO, USA) | A8412 | Stock Concentration: 7.5% Final Concentration: 0.5% |
| Sodium Azide | Sigma (St. Louis, MO, USA) | S8032 | Final Concentration: 0.02% |
| Penicillin/Streptomycin (Pen Strep) | Gibco (Grand Island, NY, USA) | 15070-063 | Antibiotics Stock Concentration: 5,000 UI/ml penicillin, 5,000 μg/ml Streptomycin Final Concentration: 50 UI/ml penicillin, 50 μg/ml Streptomycin |
| T-75 culture flask for suspension cultures | Greiner Bio-one (Frickenhausen, Germany) | 658 190 | |
| T-75 culture flask TC treated | Greiner Bio-one (Frickenhausen, Germany) | 658170 | |
| TrypLE Select | ThermoFisher (Waltham, MA USA) | 12563-011 | Animal-free proteases detaching solution Stock Concentration: 1x Final Concentration: 1x |
| Trypsin/EDTA | ThermoFisher (Waltham, MA USA) | 15400-054 | Phenol red free Stock Concentration: 0.5% Final Concentration: 0.25% |
| anti-CD90 APC antibody (CD90) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-402 | Final Concentration: 1:40 |
| anti-CD45 APC-Vio770 antibody (CD45) | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-609 | Final Concentration: 1:40 |
| anti-CD73 PE antibody (CD73) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-182 | Final Concentration: 1:40 |
| anti-CD31 PE Vio-770 antibody (CD31) | MiltenyiBiotec (BergischGladbach, Germany) | 130-105-260 | Final Concentration: 1:40 |
| Mouse IgG1 APC antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-846 | Final Concentration: 1:40 |
| Mouse IgG2a APC Vio770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-637 | Final Concentration: 1:40 |
| Mouse IgG1 PE antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-845 | Final Concentration: 1:40 |
| Mouse IgG1 PE Vio-770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-563 | Final Concentration: 1:40 |
| Low Glucose Dulbecco's Modified Eagle Medium (DMEM) | ThermoFisher (Waltham, MA USA) | 13-1331-82 | Phenol red-free minimal essential medium Stock Concentration: 1,000 mg/L glucose |
| Fetal Bovine Serum (FBS) | ThermoFisher (Waltham, MA USA) | 10500 | Stock Concentration:0.2 mg/ml Final Concentration: 2 μg/ml |
| Prolong Gold antifade reagent with 4’,6-diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | P-36931 | Aqueous mounting medium + DAPI Final Concentration: 1x |
| Paraformaldehyde | Sigma (St. Louis, MO, USA) | P6148 | Fixative Final Concentration: 4% |
| LAB-TEK two-well chamber slides | Sigma (St. Louis, MO, USA) | C6682 | |
| Anti-Nestin antibody [clone 10C2] | Abcam (Cambridge, UK) | ab2035 | Stock Concentration: 1 mg/ml Final Concentration: 7 μg/ml |
| Alexa Fluor 555 Phalloidin | ThermoFisher (Waltham, MA USA) | A34055 | Stock Concentration: 200 UI/ml Final Concentration: 5 UI/ml |
| Triton X-100 | Euroclone (Milan, Italy) | EMR237500 | Final Concentration: 0.05% |
| MesenPRO RS Medium (MSC-RS medium) | ThermoFisher (Waltham, MA USA) | 12746-012 | |
| Alexa Fluor 488 anti-mouse SFX kit | ThermoFisher (Waltham, MA USA) | A31619 | Goat anti-mouse secondary antibody + Signal enhancer Stock Concentration: 2 mg/ml Final Concentration: 2 μg/ml |
| Pasteur Pipette | Kartell Labware (Noviglio (MI), ITALY ) | 329 | |
| StemMACS AdipoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-679 | |
| StemMACS OsteoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-678 | |
| Osteoimage Bone mineralization Assay | LONZA (Walkersville MD-USA) | PA-1503 | Hydroxyapatite specific fluorescent staining solution |
| 50 ml Polystyrene conical tube | Greiner bio-one (Kremsmünster Austria) | 227261 | |
| Nile Red | ThermoFisher (Waltham, MA USA) | N1142 | Fluorescent staining solution for lipids Stock Concentration: 100 mM Final Concentration: 200 Nm |
| Glycerin | Sigma (St. Louis, MO, USA) | G2289 | Final Concentration: 50% |
| Polistirene Petri dishes | Sigma (St. Louis, MO, USA) | P5606 | |
| 24-well plates TC-treated | Greiner Bio-one GmbH (Frickenhausen, Germany) | 662160 | |
| Endothelial Growth Medium, EGM-2 BulletKit (EGM-2) | LONZA (Walkersville MD-USA) | CC-3162 | VEGF-rich endothelial cell growth medium |
| Leica Qwin Image Analisys Software | Leica (Wetzlar, Germany) | Image analysis software |
Referenzen
- Stoltz, J. F., et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015, 734731 (2015).
- Pacini, S. Deterministic and stochastic approaches in the clinical application of mesenchymal stromal cells (MSCs). Front Cell Dev Biol. 2, 50 (2014).
- Galvez, P., Clares, B., Hmadcha, A., Ruiz, A., Soria, B. Development of a cell-based medicinal product: regulatory structures in the European Union. Br Med Bull. 105, 85-105 (2013).
- Herberts, C. A., Kwa, M. S., Hermsen, H. P. Risk factors in the development of stem cell therapy. J Transl Med. 9, 29 (2011).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Pacini, S., et al. Constitutive expression of pluripotency-associated genes in mesodermal progenitor cells (MPCs). PLoS One. 5 (3), 9861 (2010).
- Pacini, S., et al. Specific integrin expression is associated with podosome-like structures on mesodermal progenitor cells. Stem Cells Dev. 22 (12), 1830-1838 (2013).
- Fazzi, R., et al. Mesodermal progenitor cells (MPCs) differentiate into mesenchymal stromal cells (MSCs) by activation of Wnt5/calmodulin signalling pathway. PLoS One. 6 (9), 25600 (2011).
- Tormin, A., et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood. 117 (19), 5067-5077 (2011).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Wang, Y. H., Liu, Y., Maye, P., Rowe, D. W. Examination of mineralized nodule formation in living osteoblastic cultures using fluorescent dyes. Biotechnol Prog. 22 (6), 1697-1701 (2006).
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7 (5), 393-395 (2005).
- Wang, S., Qu, X., Zhao, R. C. Clinical applications of mesenchymal stem cells. J Hematol Oncol. 5, 19 (2012).
- Si, Y. L., Zhao, Y. L., Hao, H. J., Fu, X. B., Han, W. D. MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Res Rev. 10 (1), 93-103 (2011).
- Le Blanc, K., Tammik, C., Rosendahl, K., Zetterberg, E., Ringden, O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 31 (10), 890-896 (2003).
- Phinney, D. G. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. 6 (23), 2884-2889 (2007).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Tolar, J., Le Blanc, K., Keating, A., Blazar, B. R. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 28 (8), 1446-1455 (2010).
- Corselli, M., et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 21 (8), 1299-1308 (2012).
- Bieback, K., et al. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. 27 (9), 2331-2341 (2009).
- Watson, L., Elliman, S. J., Coleman, C. M. From isolation to implantation: a concise review of mesenchymal stem cell therapy in bone fracture repair. Stem Cell Res Ther. 5 (2), 51 (2014).
- Pacini, S., Petrini, I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells. Front Cell Dev Biol. 2, 20 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten