Method Article
사람 골수에서 분리 Mesangiogenic 전구 세포 (MPC와)
요약
Here we describe an optimized, highly reproducible protocol to isolate Mesodermal Progenitor Cells (MPCs) from human bone marrow (hBM). MPCs were characterized by flow cytometry and nestin expression. They showed the ability to give rise to exponentially growing MSC-like cell cultures while retaining their angiogenic potential.
초록
In a research study aimed to isolate human bone marrow (hBM)-derived Mesenchymal Stromal Cells (MSCs) for clinical applications, we identified a novel cell population specifically selected for growth in human serum supplemented medium. These cells are characterized by morphological, phenotypic, and molecular features distinct from MSCs and we named them Mesodermal Progenitor Cells (MPCs). MPCs are round, with a thick highly refringent core region; they show strong, trypsin resistant adherence to plastic. Failure to expand MPCs directly revealed that they are slow in cycling. This is as also suggested by Ki-67 negativity. On the other hand, culturing MPCs in standard medium designed for MSC expansion, gave rise to a population of exponentially growing MSC-like cells. Besides showing mesenchymal differentiation capacity MPCs retained angiogenic potential, confirming their multiple lineage progenitor nature. Here we describe an optimized highly reproducible protocol to isolate and characterize hBM-MPCs by flow cytometry (CD73, CD90, CD31, and CD45), nestin expression, and F-actin organization. Protocols for mesengenic and angiogenic differentiation of MPCs are also provided. Here we also suggest a more appropriate nomenclature for these cells, which has been re-named as "Mesangiogenic Progenitor Cells".
서문
간엽 기질 세포 (MSC들)은 그들의 다중 계통 분화 능력과 성장 인자 / 사이토 카인을 분비 할뿐만 아니라 면역 조절 하나의 역할을하는 조혈을지지하는 그들의 능력에 대한 중요한 임상 적 가치가있다. MSC 기반 치료법 셀 생산 및 적용의 정의에서 의약품 (CBMP) 치료 3 계 전지의 안전성과 효능에 대해 특정 국제 규정에 특별한주의와 광범위한 임상 및 전임상 연구 (2)의 대상이되어왔다. 인간 중간 엽 줄기 세포는 태아 소 혈청 (FBS) 및 소 트립신으로 보충과 동물 기원의 시약을 포함하는 배지에서 광범위하게 배양. 따라서, 세포 조작과 관련된 감염 위험이 환자는 프리온에게 노출뿐만 아니라 단백질, 펩타이드 또는 동물 유래의 다른 생체 분자에 연결 면역 학적 위험에 직면 함께와 세포 수확 및 transplan 후 계속 수있는테이션 4.
이 문제를 회피하기 위해, 우리는 풀링 된 인간 AB 형 혈청 (PhABS)를 FBS를 대체 인간 골수 (HBM) 동물 배지에서 유래 중간 엽 줄기 세포를 배양 하였다. 이러한 조건에서 중간 엽 줄기 세포 성장과 함께, 우리는 새로운 세포 집단을 확인 하였다. 이러한 세포 형태학 및 중간 엽 줄기 세포에서 표현형 달랐다 독특한 유전자 발현 프로파일과 특성 성장 / 접착 성을 나타내었다. 그들은 유지 모두 mesengenic 및 잠재적 인 혈관 신생 따라서 선정됐다 중배엽 전구 세포 (MPC와) 5. 다음으로, 우리는 순도 6 높은 등급의 MPC를 생성하도록 선택적 및 재현성 배양 조건을 정의 할 수 있었다.
우리는 더 MPC와의 형태 학적 및 생물학적 특성을 조사 하였다. 된 MPC는 자전거에 긍정적 - 네 스틴 느린 것으로 보여, 기-67 음성, 긴 텔로미어 5 특징 염색체와. 그들은 plur 표현ipotency 관련 전사는 요인 10 월 4, Nanog를하기보다는 MSC 마스터 조절기 Runx2와 Sox9 7. 중간 엽 마커 CD73, CD90, CD166이 부족한 상태에서 표현형, MPC와는 중간 엽 줄기 세포보다 낮은 수준에서 endoglin (CD105)를 표명했다. MPC와는 구체적으로 podosome 같은 구조 팔을 지탱 접착 PECAM (CD31)의 일관된 표현을 특징으로 분자 인테그린 αL (CD11a에), αM (CD11b를) αX (중 CD11c)과 인테그린 β2 (CD18)의 독특한 패턴을 보여 주었다 . 표준 MSC 확장 미디어에서 MPC와 신속 9 신호 Wnt5 / 칼 모듈 린 세포의 활성화를 갖춘 중간 단계를 통해 중간 엽 줄기 세포로 분화. 쥐의 세포 외 기질 (ECM) 단백질의 3 차원 문화 회전 타원체에서 새싹 할 수있는 능력에 의해 입증으로하여 MPC는 또한, 혈관 신생 속성을 유지했다. 혈관 신생 가능성은 빠르게 mesengenic 혈통을 따라 MPC 분화 후 끊어졌습니다.
여기에서 우리는 프로 제시tocols은 분리 및 HBM 혈액 샘플로부터 고도로 정제 된 MPC의 특성을 최적화. MPC의 mesengenic 및 혈관 분화 재현 프로토콜도 설명되어 있습니다.
프로토콜
참고 : 서면 동의 후, HBM의 샘플 고관절 교체 정형 외과 수술 중 얻었다. 즉시 헤파린의 500 UI를 포함하는 20 ML의 주사기를 리밍 대퇴 경부 절골술 후 대퇴 전에, 새로운 BM을 흡인하는 데 사용되었다. 프로토콜은 BM 소스 널리 적용을 고려하여야한다.
사람 골수 단핵 세포의 1. 분리 (HBM-다국적 기업)
- 둘 베코 인산염 완충 식염수 (D-PBS)을인가 해, 50 ml의 신선한 BM 10 ㎖와 혼합하여 반전 - 5 희석. 마찬가지로, 두 개의 새로운 50 ML 원뿔 튜브에 25 ml의 배포 각각의 튜브에 D-PBS 25 ml에 추가하고 반전으로 섞는다.
- 튜브를 용액으로부터 광물 뼈 조각의 분리 및 지방 들어, 실온에서 10 분간 방치한다.
- 조심스럽게 미네랄 뼈 조각 펠렛을 방해하지 않고 70 μm의 필터를 통해 멸균 파스퇴르 피펫 및 필터 세포 현탁액에 떠있는 지방을 제거합니다. <리> 불연속 밀도 구배 원심 분리 배지 15 ㎖ (1.077 g / ml)로 4 개의 50 ㎖ 튜브를 설정한다. 이 매체는 실온에 있는지 확인합니다.
- 밀도 구배 배지 위에서 희석 BM 25 ㎖의 - 부드럽게 20 누워. 혼합 층을 방지하기 위해 튜브 벽에 세포 현탁액의 물방울셔서,주의 깊게이 작업을 수행합니다.
- 비활성화 브레이크 실온에서 30 분 동안 400 XG에서 밀도 구배 원심 분리를 수행한다.
- 멸균 파스퇴르 피펫을 사용하여 두 단계 사이에 위치하는 셀의 백탁 링 모아서 신선한 50 ㎖ 튜브에 옮긴다.
- 신선한 배지로 세포를 세척 : 페놀 레드가없는 저 글루코스 (1,000 ㎎ / ℓ) 둘 베코 변형 이글 중간 (DMEM), 10 % (v / v)로 풀링 된 인간 AB 형 혈청 (PhABS), 2 mM L- 글루타민 및 항생제 (DMEM / 10 % PhABS). 5 분 동안 400 XG에 원심 분리기.
- 신선한 DMEM 10 ㎖ / 10 % PhABS - 기음 뜨는 및 5 펠렛을 다시 일시 중지합니다.
- 세포 수를 진행합니다.트리 판 1 희석 (1)에 의한 백혈구의 수를 결정한다. 혈구이 적용하고, 위상차 현미경 하에서 관찰한다. 셀 수에서 작은 완벽하게 둥근 적혈구와 블루 스테인드 죽은 세포를 제외합니다.
주 : 매우 MPC 복구 성능을 위해 화면 PhABS 배치하는 것이 좋습니다. 다른 출처의 대부분의 혈청은 MSC와 같은 세포의 높은 비율과 MPC 문화 초래하면서 미국의 소스에서 PhABS 최상의 결과를 제공하고있다.
HBM-다국적 기업에서 MPC와의 2. 분리
- 신선한 DMEM / 10 % PhABS 15 ml의 소수성 T-75 플라스크를 설정하고 pH 및 온도는 30 분 동안, 5 % CO 2에서 37 ℃에서 미리 인큐베이션 평형하자.
- 시드 4 - 플라스크 당 6 × 10 7 HBM-다국적 기업과 48 시간 동안 5 % CO 2에서 37 ° C에서 품어.
- 기음과 플라스크에서 매체 및 비 부착 세포를 폐기합니다. 신선한 DMEM / 10 % PhABS의 15 ML을 추가하고 37 ° C에서 부화5 %의 CO 2. 매체마다 48 시간을 변경, 팔일 - 6 문화를 유지한다.
OPTIONAL : MPC 수율을 높이기 위해 2.3에서 비 부착 성 세포는 새로운 배양 플라스크에 다시 도금 일차 배양 기술 한 바와 같이 유지 될 수있다. - 대기음하고, 플라스크에서 배지를 버리고 신선한 DMEM으로 씻어 솔루션을 분리 동물 무료 프로테아제 2 ㎖를 추가합니다. 15 분 (장기간 배양을 방지) - (5) 37 ℃에서 인큐베이션.
- 5 분 동안 400 XG에 세포 현탁액을 원심 분리하고, 신선한 DMEM / 10 % PhABS 10ml의 추가 대기음
- 기음과 뜨는 버리고 1 펠렛을 다시 중단 - 신선한 DMEM 2 ㎖ / 10 % PhABS. 단계 1.10에 설명 된대로 세포 수를 진행합니다.
참고 : 시약을 분리으로 트립신 / EDTA를 사용하지 마십시오. MPC와 내성 트립신된다. 배양의 형태 학적 검사는, 세포를 수확하기 전에 높은 방추형 MSC 유사 세포의 존재를 평가하기 위해 추천된다. MSC와 같은 세포의 경우에는 상당한 양의 D에있다etected는 선택적으로 오염 된 세포를 제거함으로써 세포 생성물의 순도를 증가시킨다. 이를 위해 트립신 소화 2 분 동안 트립신 2 ㎖ / EDTA 0.05 %를 첨가하여, MPC 수확하기 전에 수행 될 수있다. 워시 문화를 두 번 DMEM / 10 % PhABS 5 ㎖로, 다음과 같은 이상 치료를 프로테아제로 진행합니다.
3. 세포의 특성 분석
- 유동 세포 계측법
- 세척 용액 105 새롭게 분리 된 세포 시료의 중복 설정 : D-PBS 0.5 % (v / v)의 소 혈청 알부민 (BSA)과 0.02 % (w / v)의 아 지드 화 나트륨으로 보충. 5 분 동안 400 XG에 원심 분리기.
주의 : 나트륨 아 지드 독성이다. - 세척 용액을 200 μL의 펠릿을 다시 중지 및 항 CD90, 항 CD45, 항 CD73과 형광 염료 ( "TEST")에 접합 된 항 CD31 항체를 추가; 병렬 아이소 타입 컨트롤 ( "CTRL")을 설정합니다.
참고 : 항체 염색의 금액이 적정 또는 코르에 의해 결정되어야한다제조업체의 지침에 땡. - 30 분 동안 4 ° C에서 샘플을 품어.
- 5 분 동안 400 XG에 원심 분리기. 세정액 500 ㎕의 세포를 다시 일시 7 9 10 사이토 다색 흐름을 적어도 5 × 104의 이벤트를 취득.
- 도트 플롯으로 결과를 분석하고 사분면을 설정하는 "CTRL"기록 된 이벤트를 사용합니다.
참고 : MPC 문화와 문화를 정의하기 위해 CD73 음수 CD90의 음수의 CD45 + CD31 + 세포의 비율이 95 % 이상이어야한다. 98 % - 일부 특정 애플리케이션의 경우, 즉, 유전자 발현 분석, 복구 차단 97로 증가되어야한다.
- 세척 용액 105 새롭게 분리 된 세포 시료의 중복 설정 : D-PBS 0.5 % (v / v)의 소 혈청 알부민 (BSA)과 0.02 % (w / v)의 아 지드 화 나트륨으로 보충. 5 분 동안 400 XG에 원심 분리기.
- 네 스틴 탐지 및 F - 굴지 조직 분석
- 문화 챔버 슬라이드 플레이트 갓 격리 된 MPC (20,000 / cm 2). 세포가 5 % CO 2, 37 ℃에서 하룻밤 배양하여 부착 할 수 있습니다.
- 세척 용액 Fi를에 세포를 씻으4 %의 X 15 분 동안 실온에서 (w / v)의 파라 포름 알데히드. 정착이, 세정액을 추가 2 분 동안 품어과 부어 제거합니다.
- 두 번 세척을 반복합니다.
- D-PBS에서 Permeabilize 하시려면 세포는 실온에서 15 분 동안 0.05 % (v / v) 트리톤 X-100을 보충.
- 단백질이없는 신호 인핸서 (RT에서 30 분) 또는 표준 블로킹 용액, 반응 정지 (D-PBS 3 %로 보충 (W / v)의 BSA).
- 솔루션을 차단 / 신호 증강을 제거합니다.
- 7 μg의 / ㎖를 추가 항 - 인간 스틴 차 항체 (V / w)와 가습 실에서 밤새 4 ° C에서 품어. 평행이 아닌 특정 형광 신호를 평가하는 제어 이소 타입 항체를 사용한다.
- D-PBS를 추가하여 슬라이드를 씻으, 2 분 동안 떠나 붓는다. 두 번 반복합니다.
- 2 μg의 / ㎖를 추가 형광 염료 복합 이차 항체 (V / w)와 어둠 속에서 1 시간 동안 4 ° C에서 품어.
- 워시는 위의 슬라이드.
- 형광 Phalloidin의 (5 UI / ㎖)를 추가, 30m RT에서 떠나그리고 어둠 속에서하는 D-PBS로 3 회 세척한다.
- 챔버 벽을 제거하고 핵을 검출 antifade 시약 4 ', 6-diamidino -2- 페닐 인돌 (DAPI)로 보충 수성 장착 매체에 슬라이드 마운트. 7 9 10 이미징로 이동합니다.
MPC와의 4 Mesengenic 차별화
- 플레이트 (2) × 104 / ㎠ TC 처리 T75 배양 플라스크에서 갓 격리 된 MPC 세포는 5 % CO 2에서 37 ° C에 DMEM / 10 % PhABS 밤새 부착하자.
- 중간 엽 기질 세포 확장 (MSC-RS 매체) 용으로 설계된 표준 감소 혈청 배지, 약 200 μL / cm 2로 DMEM / 10 % PhABS를 교체합니다. 유도에서 7 ~ 10 일에서 일반적으로 (P1-중간 엽 줄기 세포)를 합류하는 세포를 성장. 2 일마다 배지 새로 고칩니다.
- 대기음하고, 플라스크에서 배지를 버리고 신선한 MSC-RS 배지로 세척 및 솔루션을 분리 동물 무료 프로테아제 2 ㎖를 추가합니다. 37 품어76; 5 C - 15 분 (연장 보육을 방지).
- 5 분 동안 400 XG에 세포 현탁액을 원심 분리하고, 신선한 MSC-RS 배지 10 ㎖를 추가 대기음
- 신선한 MSC-RS 배지 2 ㎖ - 대기음 뜨는 및 1 펠렛을 다시 일시 중지합니다. 단계 1.10에 기재된 바와 같이 세포 수로 진행
- 5 × 103 세포 / cm 2-3를 파종하여 그 하위 문화로 넘어갑니다. (P2-중간 엽 줄기 세포)를 합류하는 세포를 성장.
- 4.5 단계 및 3 장에 설명 된대로 특성을 진행 단계 4.3에서 설명 된 바와 같이 단백질 분해 효소 소화에 의해 수확 세포.
주 : CD73 + CD90 + CD45 CD31 NEG의 NEG 세포의 비율 95 % 이상 만 편미분을 나타내며, 또 배양 통로를 요구한다. - 플레이트 P2-중간 엽 줄기 세포 2 × 여섯 잘 TC-처리 판 10 4 / cm 2 및 성장에는 MSC-RS 매체에 합류합니다.
- 마크 "아니오의 Diff"로 두 우물과는 MSC-RS 매체를 새로 고칩니다.
- 마크이 아니라"Osteo"특히 MSC 분화 용으로 설계된 200 μL / 표준 골 형성 매체의 cm 2와 매체를 교체 등의.
- 마크 두 개의 "Adipo"로 우물 특히 MSC 분화 용으로 설계된 200 μL / 표준 지방 세포 배지 cm 2와 매체를 교체하십시오.
- 전체 미디어 각 48 시간을 변경하여 5 % CO 2 37 ° C에서 문화를 유지한다.
참고 : 높은 시험 재현성 표준 상업적으로 이용 가능한 차별화 된 미디어를 사용하는 것이 좋습니다. 세포 내 지질 방울의 축적이 지방 세포에 의한 세포에서 분명하다 동안 차별화 된 조건에서 2/3 주 후, 칼슘 예금, 골 형성 유도 문화에 나타납니다. - 기음 문화 미디어 다음 D-PBS로 씻어 버리고.
- 실온에서 15 분 동안 파라 포름 알데히드 (/ V W) 4 % 1 ㎖를 첨가하여 배양을 수정.
- 정착이, D-PBS를 추가 2 분 동안 품어과 부어 제거합니다. 반복 세탁두번.
- 두 "Adipo는"200 nM의 나일 레드 솔루션에 우물을 표시와 함께 두 개의 "Osteo는"함께 하이드 록시 아파타이트 특정 형광 용액 일 "아니오의 Diff"에 우물을 표시와 함께 한 "아니오의 Diff"를 얼룩. 실온 (11, 12)에서 30 분 동안 인큐베이션.
- 솔루션을 염색 제거를 두 번 D-PBS로 씻는다.
- 추가, D-PBS를 제거 D-PBS는 50 % (v / v)의 글리세린 보충 및 이미징 (7) (9) (10)를 진행합니다.
5. MPC 회전 타원체 돋 분석
- 3D 회전 타원체를 생산하기 위해 페트리 접시 뚜껑의 내부 표면에 갓 격리 MPC 현탁액 (1.5 × 104 세포 / 드롭)의 20 μl의 방울을 배치합니다.
참고 : 취급 상품들이 파열로 이어질 수있는 바와 같이, 그것은 초과를 배치하는 것이 매우 추천입니다. - 조심스럽게 D-PBS가 걸려 증발을 삭제 방지하기 위해 포함 된 배양 접시를 정리해하기 위해 뚜껑을 사용합니다. CO 2 5 %에서 37 ° C에서 품어하룻밤 세포를 3 차원 회전 타원체에 통합 할 수 있습니다.
- 미리 냉각 24- 웰 배양 플레이트에 표준 ECM 단백질을 300 ㎕의 분취 량을 첨가하여 쥐의 세포 외 기질 (ECM) 단백질의 두꺼운 겔을 설정하고, 30 분 동안 37 ℃에서 배양한다.
- 조심스럽게 페트리 접시의 뚜껑을 뒤집어 부드럽게 멸균 파스퇴르 피펫을 사용하여 회전 타원체를 선택합니다.
- 상기 ECM 단백질 겔상에서 구 상체를 마련 표준 VEGF 풍부한 내피 세포 성장 배지 700 ㎕의 분취 액을 추가 5 % CO 2에서 37 ℃에서 배양한다.
- 24 시간 후와 문화 7 일에서 4 배 확대 배율에서 3D 문화의 사진을 찍을. 마지막 침입 셀 및 구형 에지 사이의 반경 방향 거리를 측정하여 화상 해석 소프트웨어를 적용 타원체 돋아 평가한다. 적어도 20 서로 다른 방향을 따라 반복 측정합니다. 평균 거리는 경우 50 μm의 이상 긍정적으로 간주된다.
결과
여기에서 설명한 선택적 배양 조건은 HBM-다국적 1.0 %의 신규 점착 거의 단형 세포군의 분리를 허용 할 (0.5-2.0 × 105 내지 6 HBM-다국적 - 신선한 BM 시료 10 mL) 중 5,6- . MPC와 5로, 대기, 기-67 음성 세포를 반올림, - 우리는이 큰 (60 μm의 직경 40)를 확인했다. 형태 학적으로, 그들은 (그림 1 A.1에 흰색 화살표)을 높은 배율 전력에서 filopodia을 많이 보여주는 평면 얇은 주변에 둘러싸여 두꺼운 핵심 영역과 특유의 기름에 튀긴 된 계란 모양을 특징으로한다. 외부 셀 경계 폴라 신도들은 (도 1에 검은 색 화살표 A.1)를 관찰한다. 이러한 형태는 표준 MSC 문화에보고 된 전형적인 방추형 중간 엽 기질 세포 모양에서 분명히 다르다. 유동 세포 계측법 m 동안 CD31과 CD45를 표현하는 갓 격리 된 MPC의 95 % 이상을 보여 주었다esenchymal 관련 마커 CD90 및 CD73 (13)는 탐지 (그림 1 A.2)이었다. 우리는 MPC와 네 항원이 제한 집합으로 나타내는 생각. MPC와의 또 다른 구별 특징은 세포에서 감지되지 않습니다 (그림 1 A.3 빨간색)을 podosome 같은 구조의 수를 공개 점 F-굴지의 유통 및 네 스틴의 강렬한 식 (그림 1 A.3 녹색)입니다 이소 타입 대조군 항체로 염색 (데이터는 보이지 않음).
표준 RS에서 배양 된 MPC는 매체 기하 급수적으로 증가 MSC와 같은 세포 (그림 1 B.1)에 급속한 분화 MSC 확장 결과를 디자인했다. 이 구절 후 세포는 마지막으로 CD73 + CD90 + CD45 음수 CD31의 NEG (그림 1 B.2)에 CD73 음수 CD90의 음수 CD45 + CD31 +에서 자신의 표현형을 전환합니다. 이 과정에서 MPC와 재 ORGA네 스틴 표현은 몇 가지 희귀 세포 (그림 1 B.3)에 국한된다 동안 nize 스트레스 섬유로 F는 액틴. 명확한 MSC와 같은 표현형에 MPC mesengenic 분화는 다른 세포의 형태학에 의해 밝혀 두 가지 단계를 통해 발생합니다. MSC RS 매체 일주 MPC 유사 세포의 잔류 인구 후에도 (도 2의 P1-MSC들) 평평한 다각형의 다 분지 셀 합류 층 내에서 검출된다. 추가의 통로 (도 2 (A)에 P2-MSC들) 방추형 MSC 유사 세포의 거의 단형 배양을 얻을 필요가있다. 따라서 자신의 MSC 자연을 확인, 최소 2 주 동안 선택적 미디어에 전송 할 때이 기하 급수적으로 증가 세포는 쉽게 조골 세포 나 지방 세포로 분화 할 수 있습니다. 골 형성 유도 배양 물에 칼슘 침착은 어느 비색 알리자린-S 염색 또는 특정 형광 염료 (도 2의 B 녹색)에 의해 검출 될 수있다. 지방 세포 유도 세포 후(그림 2 B 빨간색) 중 하나 비색 오일 레드 또는 형광 나일 레드 얼룩에 의해 계시 된 지질 축적을 보여줍니다.
MPC 입력은 혈관 신생 분석을 돋에 의해 확인되었다. MPC와는 24 시간 VEGF-자극 (그림 2 C) 후 3 차원 회전 타원체에서 쥐 ECM 단백질 젤 침공 (μm의 50 이상) 할 수있는 능력을 보여 주었다. 600 μm의 거리 - 일주 침입 세포 (300)에서 검출 한 후. 반대로, 침략 용량은 mesengenic 분화 (그림 2 D) 후 P2-중간 엽 줄기 세포에서 분실되었다.
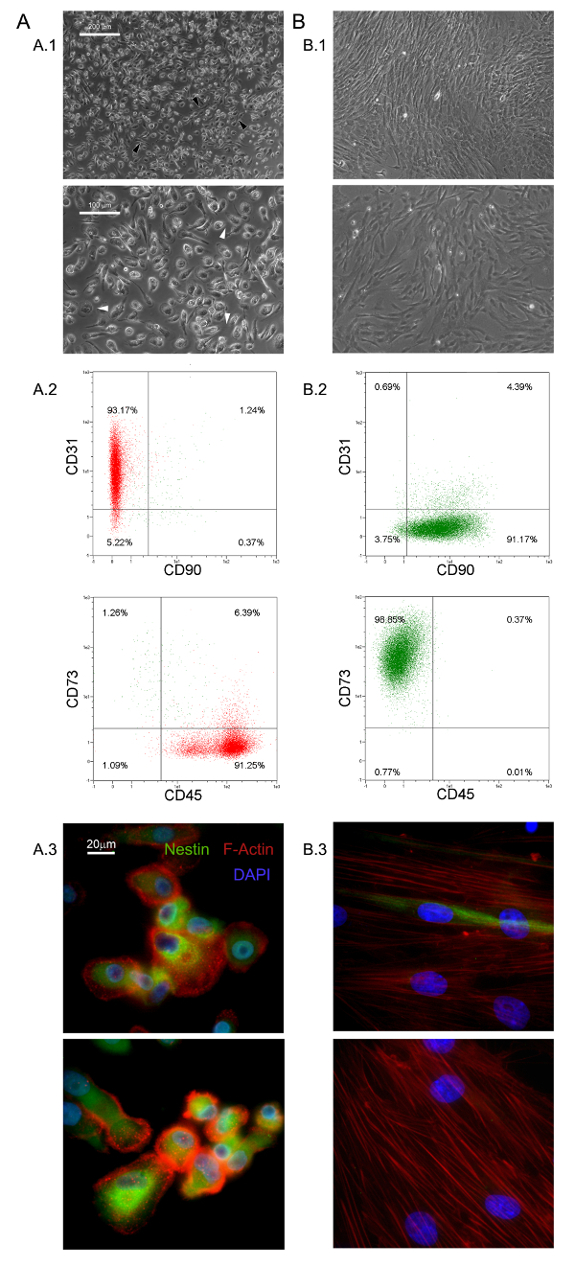
그림 1. 갓 고립 된 MPC는 독특한 특징을 가지고있다. DMEM / 10 % PhABS에서 배양 HBM-다국적 기업을 이레 동안은 중간 엽 줄기 세포와 쉽게 구별 정지 된 MPC (A)의 인구 (B)을 발생시킨다 형태의 점 (A.1, B.1, 스케일 바 = 100 μm의), 표현형 (A.2, B.2), F - 굴지 분포 (A.3 빨간색, B.3), 및 네 스틴 식 (A.3, B.3 녹색, 스케일 바는 20 μm의 =). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
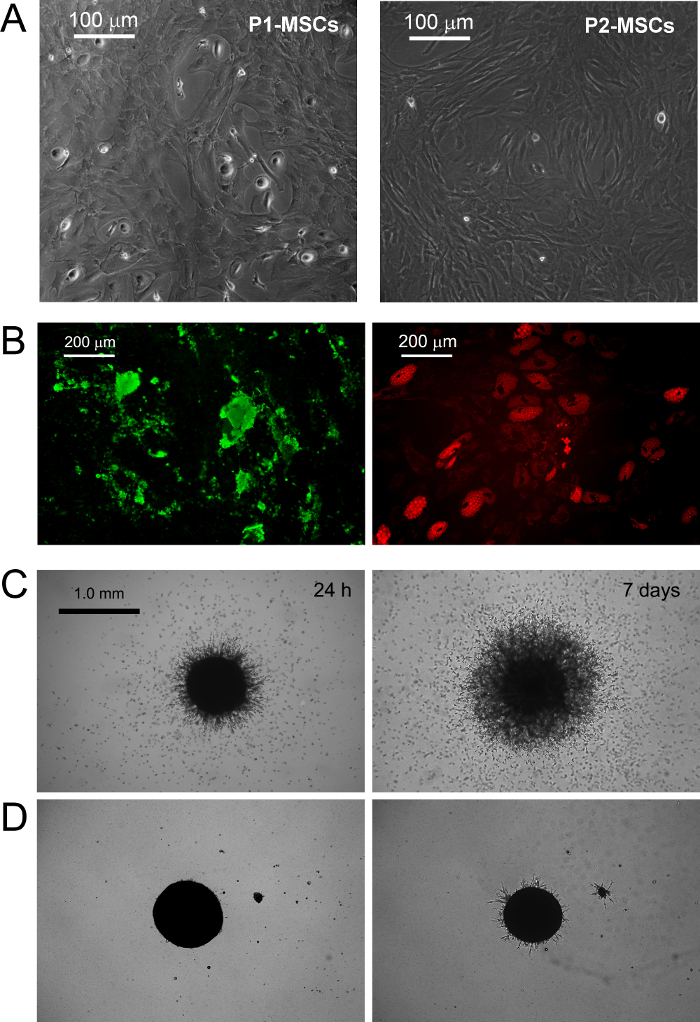
2. MPC와 중간 MSC 확장을 위해 설계 상업적으로 이용 가능한 RS와 DMEM / PhABS의 체외. 교체의 표준 중간 엽 줄기 세포 및 표시 돋 혈관으로 분화 그림 MPC와의 mesengenic 유도를 트리거합니다. 문화 일주 후 몇 잔류 된 MPC는 여전히 MSC-RS 매체에 추가 통로 합류 MSC와 같은 세포 집단 (P2-중간 엽 줄기 세포, 스케일 바 = 100 μm의)로 연결하는 동안 검출 (P1-중간 엽 줄기 세포)입니다. 피칼슘 침착 (B 녹색) 및 지질 축적 (B 빨간색, 스케일 바 = 200 μm의)에 의해 계시 된 2 중간 엽 줄기 세포는 말기 각각 적절한 자극에서 골 세포 나 지방 세포로 분화. MPC와는 P2-중간 엽 줄기 세포 (D, 스케일 바 = 1.0 mm)과의 차이에 쥐 ECM 단백질 겔 (C)의 회전 타원체에서 일관된 발아을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
In the last decades, MSCs have been extensively researched and pre-clinically evaluated for possible application in the treatment of various bone/articular, immunological, neurological, cardiovascular, gastrointestinal and hematological disorders14,15. The easy and inexpensive isolation of multipotent MSCs, from many different tissues, together with their lack of significant immunogenicity16, contribute to make these cells one of the most interesting cell population to be applied in cell based therapies. Nonetheless, the very low frequency in the tissue of origin represents a great limitation to the MSCs application in clinics, forcing the expansion of these cells, in vitro, before the infusion or transplantation.
Expanded MSC cultures have revealed high grades of heterogeneity and variability17-19 making it difficult to reach a consensus about MSC production and characterization protocols. Moreover, recent investigations suggested the presence of multiple in vivo MSC ancestors in a wide range of tissues, which contribute to culture heterogeneity10,20. In fact, it has been proposed that particular culture conditions possibly select or simply promote specific sub-populations of MSCs progenitors present, in various percentages, in "crude" and unprocessed samples like bone marrow (hBM-MNCs) or adipose tissues (stromal vascular fraction)2. Thus, the variability in MSC-initiating cell populations together with the great number of different enrichment/isolation and culture protocols applied, represent a great obstacle to the definition of feasible MSC-based therapies.
A crucial factor affecting heterogeneity of MSC cultures is serum supplementation21. In our hands replacement of FBS with PhABS in primary cultures from hBM-MNCs, combined with high density seeding on hydrophobic plastics, led to the isolation of a novel highly adherent cell population with distinct biological features named MPCs5,6. We observed that the addition of small percentages of PhABS to FBS primary cultures also allowed MPC isolation, suggesting the presence of MPC inducing agents in the human serum6. At the moment, the MPC isolation/characterization protocol is a unique method available to obtain almost pure MPCs. The protocol has been carefully adjusted and it is highly reproducible for quality screening of MPC preparations before further applications.
MPCs could be used as a source for MSC production, thus limiting the variability introduced by use of unfractionated starting material. The precise definition of the multiple steps characterizing MPC mesengenic differentiation reported9 would allow synchronized mesenchymal cell expansion. Nonetheless, this latest condition could be realized exclusively applying highly purified MPC population, as a consequence the characterization of the cell products obtained by the protocol described here, results of crucial importance. This isolating method has been reported allowing MPC recovery with purity generally around 95%. However, donor/patient variability together with the variability related to the different batches of human pooled serum applied, could lead to a significant percentage of MSC-like cells co-isolated together with MPCs, under selective conditions.
It is not clear if these "contaminating" MSC-like cells could arise from the other different in vivo progenitors described in bone marrow22 or from uncontrolled and spontaneous MPC differentiation. In any case, a consistent percentage of MSC-like cells in the MPC products nullify the possibility to applying these cells as homogeneous starting material for the MSC expansion. Thus, here it has been suggested a simple and inexpensive method, based on the MPC resistance to trypsin digestion, increasing the purity of the MPC products. Similar or even better results in purifying MPC cultures could be achieved by fluorescent or magnetic cell sorting performing CD73 and/or CD90 depletion, but significantly prolonging the process time and increasing the costs.
Moreover, MPCs showed expression of pluripotency-associated markers and Nestin, all rapidly lost during mesengenic differentiation7. Sprouting assay revealed MPC ability to invade murine ECM protein gel. Taken together these results indicate that MPCs have to be considered a more immature progenitor, retaining angiogenic potential. Nonetheless, the initial enthusiasm about mesodermal differentiation potential of MPCs is actually waning. In fact, after more than 7 years of studies on MPCs, mesengenic and angiogenic potential have been extensively described5-9, but differentiation toward any other cells of mesodermal origin is still lacking. Thus, here we propose a new, and more rigorous, definition of these cells as "Mesangiogenic Progenitor Cells", maintaining the acronym MPCs.
We also believe that most controversies about MSC angiogenic potential could be related to the heterogeneous composition of expanded cultures consisting of sub-populations of MPCs and MSCs in variable percentages23.
Finally, MPCs could also play a crucial role for the implementation of CBMPs applicable for tissue reconstruction, as these cells could also support the neo-vascularization. In fact, future studies on regeneration should take in consideration that the newly formed tissue growth should be supported by concomitant neo-angiogenesis. The co-existence of mesengenic and angiogenic potential in MPCs could significantly improve the regeneration potential of new therapeutic approaches that involve these interesting cells.
공개
The authors have no competing financial interests or other conflicts of interest.
감사의 말
저자는 특히 골수 샘플과 인간의 골관절염 조상에서 자신의 전문 지식을 제공하기 위해, 박사 파올로 Parchi, 외과의 부서, 의료 및 분자 병리학 및 중환자 의학, 피사의 대학을 감사드립니다
자료
| Name | Company | Catalog Number | Comments |
| Matrigel Basement Membrane Matrix | BD Bioscience (San Jose, CA-USA) | 354230 | Murine ECM proteins Stock Concentration: 100% (9 - 12 mg/ml) Final Concentration: 100% |
| Dulbecco's Phosphate-Buffered Saline (D-PBS) | Sigma (St. Louis, MO, USA) | D8537 | |
| 70 μm Filters | Miltenyi Biotec (BergischGladbach, Germany) | 130-095-823 | |
| Ficoll-Paque PREMIUM | GE Healthcare (Uppsala, Sweden) | 17-5442-03 | medium for discontinuos density gradient centrifugation |
| Pooled human AB type serum (PhABS) | LONZA (Walkersville MD-USA) | 14-490E | Final Concentration: 10% |
| Glutamax-I | ThermoFisher (Waltham, MA USA) | 35050-038 | Stabilized L-Glutamine Stock Concentration: 100x Final Concentration: 2 mM |
| Bovine Serum Albumin (BSA) | Sigma (St. Louis, MO, USA) | A8412 | Stock Concentration: 7.5% Final Concentration: 0.5% |
| Sodium Azide | Sigma (St. Louis, MO, USA) | S8032 | Final Concentration: 0.02% |
| Penicillin/Streptomycin (Pen Strep) | Gibco (Grand Island, NY, USA) | 15070-063 | Antibiotics Stock Concentration: 5,000 UI/ml penicillin, 5,000 μg/ml Streptomycin Final Concentration: 50 UI/ml penicillin, 50 μg/ml Streptomycin |
| T-75 culture flask for suspension cultures | Greiner Bio-one (Frickenhausen, Germany) | 658 190 | |
| T-75 culture flask TC treated | Greiner Bio-one (Frickenhausen, Germany) | 658170 | |
| TrypLE Select | ThermoFisher (Waltham, MA USA) | 12563-011 | Animal-free proteases detaching solution Stock Concentration: 1x Final Concentration: 1x |
| Trypsin/EDTA | ThermoFisher (Waltham, MA USA) | 15400-054 | Phenol red free Stock Concentration: 0.5% Final Concentration: 0.25% |
| anti-CD90 APC antibody (CD90) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-402 | Final Concentration: 1:40 |
| anti-CD45 APC-Vio770 antibody (CD45) | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-609 | Final Concentration: 1:40 |
| anti-CD73 PE antibody (CD73) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-182 | Final Concentration: 1:40 |
| anti-CD31 PE Vio-770 antibody (CD31) | MiltenyiBiotec (BergischGladbach, Germany) | 130-105-260 | Final Concentration: 1:40 |
| Mouse IgG1 APC antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-846 | Final Concentration: 1:40 |
| Mouse IgG2a APC Vio770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-637 | Final Concentration: 1:40 |
| Mouse IgG1 PE antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-845 | Final Concentration: 1:40 |
| Mouse IgG1 PE Vio-770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-563 | Final Concentration: 1:40 |
| Low Glucose Dulbecco's Modified Eagle Medium (DMEM) | ThermoFisher (Waltham, MA USA) | 13-1331-82 | Phenol red-free minimal essential medium Stock Concentration: 1,000 mg/L glucose |
| Fetal Bovine Serum (FBS) | ThermoFisher (Waltham, MA USA) | 10500 | Stock Concentration:0.2 mg/ml Final Concentration: 2 μg/ml |
| Prolong Gold antifade reagent with 4’,6-diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | P-36931 | Aqueous mounting medium + DAPI Final Concentration: 1x |
| Paraformaldehyde | Sigma (St. Louis, MO, USA) | P6148 | Fixative Final Concentration: 4% |
| LAB-TEK two-well chamber slides | Sigma (St. Louis, MO, USA) | C6682 | |
| Anti-Nestin antibody [clone 10C2] | Abcam (Cambridge, UK) | ab2035 | Stock Concentration: 1 mg/ml Final Concentration: 7 μg/ml |
| Alexa Fluor 555 Phalloidin | ThermoFisher (Waltham, MA USA) | A34055 | Stock Concentration: 200 UI/ml Final Concentration: 5 UI/ml |
| Triton X-100 | Euroclone (Milan, Italy) | EMR237500 | Final Concentration: 0.05% |
| MesenPRO RS Medium (MSC-RS medium) | ThermoFisher (Waltham, MA USA) | 12746-012 | |
| Alexa Fluor 488 anti-mouse SFX kit | ThermoFisher (Waltham, MA USA) | A31619 | Goat anti-mouse secondary antibody + Signal enhancer Stock Concentration: 2 mg/ml Final Concentration: 2 μg/ml |
| Pasteur Pipette | Kartell Labware (Noviglio (MI), ITALY ) | 329 | |
| StemMACS AdipoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-679 | |
| StemMACS OsteoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-678 | |
| Osteoimage Bone mineralization Assay | LONZA (Walkersville MD-USA) | PA-1503 | Hydroxyapatite specific fluorescent staining solution |
| 50 ml Polystyrene conical tube | Greiner bio-one (Kremsmünster Austria) | 227261 | |
| Nile Red | ThermoFisher (Waltham, MA USA) | N1142 | Fluorescent staining solution for lipids Stock Concentration: 100 mM Final Concentration: 200 Nm |
| Glycerin | Sigma (St. Louis, MO, USA) | G2289 | Final Concentration: 50% |
| Polistirene Petri dishes | Sigma (St. Louis, MO, USA) | P5606 | |
| 24-well plates TC-treated | Greiner Bio-one GmbH (Frickenhausen, Germany) | 662160 | |
| Endothelial Growth Medium, EGM-2 BulletKit (EGM-2) | LONZA (Walkersville MD-USA) | CC-3162 | VEGF-rich endothelial cell growth medium |
| Leica Qwin Image Analisys Software | Leica (Wetzlar, Germany) | Image analysis software |
참고문헌
- Stoltz, J. F., et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015, 734731 (2015).
- Pacini, S. Deterministic and stochastic approaches in the clinical application of mesenchymal stromal cells (MSCs). Front Cell Dev Biol. 2, 50 (2014).
- Galvez, P., Clares, B., Hmadcha, A., Ruiz, A., Soria, B. Development of a cell-based medicinal product: regulatory structures in the European Union. Br Med Bull. 105, 85-105 (2013).
- Herberts, C. A., Kwa, M. S., Hermsen, H. P. Risk factors in the development of stem cell therapy. J Transl Med. 9, 29 (2011).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Pacini, S., et al. Constitutive expression of pluripotency-associated genes in mesodermal progenitor cells (MPCs). PLoS One. 5 (3), 9861 (2010).
- Pacini, S., et al. Specific integrin expression is associated with podosome-like structures on mesodermal progenitor cells. Stem Cells Dev. 22 (12), 1830-1838 (2013).
- Fazzi, R., et al. Mesodermal progenitor cells (MPCs) differentiate into mesenchymal stromal cells (MSCs) by activation of Wnt5/calmodulin signalling pathway. PLoS One. 6 (9), 25600 (2011).
- Tormin, A., et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood. 117 (19), 5067-5077 (2011).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Wang, Y. H., Liu, Y., Maye, P., Rowe, D. W. Examination of mineralized nodule formation in living osteoblastic cultures using fluorescent dyes. Biotechnol Prog. 22 (6), 1697-1701 (2006).
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7 (5), 393-395 (2005).
- Wang, S., Qu, X., Zhao, R. C. Clinical applications of mesenchymal stem cells. J Hematol Oncol. 5, 19 (2012).
- Si, Y. L., Zhao, Y. L., Hao, H. J., Fu, X. B., Han, W. D. MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Res Rev. 10 (1), 93-103 (2011).
- Le Blanc, K., Tammik, C., Rosendahl, K., Zetterberg, E., Ringden, O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 31 (10), 890-896 (2003).
- Phinney, D. G. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. 6 (23), 2884-2889 (2007).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Tolar, J., Le Blanc, K., Keating, A., Blazar, B. R. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 28 (8), 1446-1455 (2010).
- Corselli, M., et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 21 (8), 1299-1308 (2012).
- Bieback, K., et al. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. 27 (9), 2331-2341 (2009).
- Watson, L., Elliman, S. J., Coleman, C. M. From isolation to implantation: a concise review of mesenchymal stem cell therapy in bone fracture repair. Stem Cell Res Ther. 5 (2), 51 (2014).
- Pacini, S., Petrini, I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells. Front Cell Dev Biol. 2, 20 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유