Method Article
Isolamento de células progenitoras Mesangiogenic (PPM) de humano Medula Óssea
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Here we describe an optimized, highly reproducible protocol to isolate Mesodermal Progenitor Cells (MPCs) from human bone marrow (hBM). MPCs were characterized by flow cytometry and nestin expression. They showed the ability to give rise to exponentially growing MSC-like cell cultures while retaining their angiogenic potential.
Resumo
In a research study aimed to isolate human bone marrow (hBM)-derived Mesenchymal Stromal Cells (MSCs) for clinical applications, we identified a novel cell population specifically selected for growth in human serum supplemented medium. These cells are characterized by morphological, phenotypic, and molecular features distinct from MSCs and we named them Mesodermal Progenitor Cells (MPCs). MPCs are round, with a thick highly refringent core region; they show strong, trypsin resistant adherence to plastic. Failure to expand MPCs directly revealed that they are slow in cycling. This is as also suggested by Ki-67 negativity. On the other hand, culturing MPCs in standard medium designed for MSC expansion, gave rise to a population of exponentially growing MSC-like cells. Besides showing mesenchymal differentiation capacity MPCs retained angiogenic potential, confirming their multiple lineage progenitor nature. Here we describe an optimized highly reproducible protocol to isolate and characterize hBM-MPCs by flow cytometry (CD73, CD90, CD31, and CD45), nestin expression, and F-actin organization. Protocols for mesengenic and angiogenic differentiation of MPCs are also provided. Here we also suggest a more appropriate nomenclature for these cells, which has been re-named as "Mesangiogenic Progenitor Cells".
Introdução
Células estromais mesenquimais (MSCs) são de valor clínicas relevantes para a sua capacidade de diferenciação multi-linhagem e sua capacidade para suportar hematopoiese, para secretar factores de crescimento / citocinas, bem como para desempenhar um papel na imunorregulação 1. Na definição de produção de células de terapias à base de MSC e aplicação têm sido objeto de extensa pesquisa clínica e pré-clínica 2, com particular atenção à regulamentação internacional específica para a segurança e eficácia do medicamento celular (CBMP) tratamentos 3 base. MSCs humanas são extensivamente cultivadas em meios contendo suplementos e reagentes de origem animal, tais como soro fetal bovino (FBS) e tripsina bovina. Portanto, ao lado com os riscos infecciosos associados à manipulação de células, os pacientes também enfrentam prion exposição, bem como os riscos imunológicos ligados a proteínas, peptídeos ou outras biomoléculas de origem animal que podem persistir após a colheita de células e transplantaçãotação 4.
Para contornar o problema, foi realizada cultura de medula óssea humana (HBM) MSCs -derived em meio livre de animal, substituindo FBS com pool humano do tipo AB de soro (PhABS). Sob estas condições, juntamente com as MSCs que crescem identificamos uma população de células novo. Estas células eram morfologicamente e fenotipicamente diferente do MSC e mostrou um perfil de expressão do gene distinto, bem como propriedades de crescimento / aderência característicos. Eles mantiveram ambos os mesengenic e angiogénicos potencial e, portanto, foram nomeados células progenitoras Mesodérmico (PPM) 5. Posteriormente, fomos capazes de definir as condições de cultura seletivos e reprodutíveis para gerar PPM com alto grau de pureza 6.
Investigamos ainda mais as propriedades morfológicas e biológicas dos PPM. Os PPM mostrou ser nestina-positivas, lento no ciclismo, Ki-67 negativo e com cromossomos caracterizadas por longos telômeros 5. Eles expressaram plurtranscrição ipotency-fatores associados master reguladores MSC Runx2 e Sox9 7 Oct-4 e Nanog, em vez de. Fenotipicamente, PPM expressa endoglin (CD105) no nível mais baixo do que MSCs ao faltar marcadores mesenquimais CD73, CD90, CD166. PPM também mostrou um padrão distinto de moléculas de adesão, caracterizado por expressão consistente de PECAM (CD31), as integrinas aL (CD11a), αM (CD11b), αX (CD11c), bem como integrina β2 (CD18) que sustenta especificamente estruturas podosome semelhante 8 . Nos meios de comunicação de expansão MSC standard, PPM prontamente diferenciado em MSCs por um estágio intermediário com a ativação de células Wnt5 / calmodulina sinalização 9. PPM também manteve propriedades angiogênicos, como demonstrado pela sua capacidade de brotar esferóides em murino matriz extracelular (ECM) culturas proteína 3D. O potencial angiogênico foi rapidamente perdido após MPC diferenciação ao longo da linhagem mesengenic.
Aqui nós apresentamos proprotocolos otimizados para isolar e caracterizar PPM altamente purificados a partir de amostras de sangue HBM. protocolos reprodutível para MPC mesengenic e diferenciação angiogénica também são descritos.
Protocolo
NOTA: Após consentimento por escrito, as amostras HBM foram obtidos durante a cirurgia ortopédica para substituição da anca. Imediatamente após a osteotomia do colo do fémur e antes femoral mandrilagem uma seringa de 20 ml que contém 500 UI de heparina, foi utilizada para aspirar BM fresco. O protocolo é para ser considerada amplamente aplicáveis a qualquer fonte de BM.
1. Isolamento de osso humano células da medula mononucleares (HBM-PTM)
- Diluir 5 - 10 ml de BM fresco a 50 ml, aplicar solução salina tamponada com fosfato de Dulbecco (D-PBS) e misturar por inversão. Igualmente distribuir 25 ml em dois novos tubos de 50 mL cónico, juntar 25 ml de D-PBS a cada tubo e misturar por inversão.
- Permitir que os tubos repousar durante 10 min à temperatura ambiente, para a separação de fragmentos de osso minerais e gordura a partir da solução.
- Cuidadosamente remover a gordura flutuante com uma suspensão de células pipeta e filtro de Pasteur estéril através de 70 mm filtros sem perturbar o fragmento pellet óssea mineral.
- Ajuste quatro tubos de 50 ml com 15 ml de meio por centrifugação descontínua de gradiente de densidade (1,077 g / ml). Certifique-se de que este meio é a temperatura ambiente.
- Cuidadosamente, coloque 20 - 25 ml da BM diluída em cima do meio de gradiente de densidade. Executar esta operação com cuidado, deixando trickle suspensão de células nas paredes do tubo para evitar camadas de mistura.
- Realizar centrifugação em gradiente de densidade a 400 xg durante 30 min à temperatura ambiente com freio desativados.
- Recolhe-se o anel esbranquiçado de células localizadas entre as duas fases utilizando uma pipeta de Pasteur estéril e transferi-lo para um tubo fresco de 50 mL.
- as células com meio de cultura fresco Lavar: fenol livre de vermelho, baixo teor de glucose (1000 mg / L) de Dulbecco Modified Eagle Médium (DMEM), 10% (v / v) reunidas tipo AB de soro humano (PhABS), 2 mM de L-glutamina e antibióticos (DMEM / 10% PhABS). Centrifugar a 400 xg durante 5 min.
- Aspirar o sobrenadante e re-suspensão da pelota em 5 - 10 ml de DMEM fresco / 10% PhABS.
- Prossiga para a contagem de células.Determinar o número de glóbulos brancos por diluição 1: 1 de tripano. Aplicar isso ao hemocitômetro, e observar em um microscópio de contraste de fase. Excluir pequenas e perfeitamente arredondados eritrócitos e células mortas coradas de azul a partir da contagem de células.
NOTA: É altamente recomendável para PhABS tela lotes por seu desempenho na recuperação MPC. PhABS de fontes EUA têm dado melhores resultados, enquanto a maioria dos soros de origem diferente resultou em culturas MPC com percentagens mais elevadas de células MSC-like.
2. Isolamento de PPM da HBM-PTM
- Definir hidrofóbicos frascos T-75 com 15 ml de DMEM / 10% PhABS frescos e deixar equilibrar o pH e temperatura por pré-incubação a 37 ° C em 5% de CO 2 durante 30 min.
- Semente 4-6 x 10 7 HBM-MNCs por frasco e incubar a 37 ° C em 5% de CO 2 durante 48 horas.
- Aspirar e descartar células médio e não aderentes a partir de frascos. Adicionar 15 ml de DMEM / 10% de PhABS fresco e incuba-se a 37 ° Cem 5% de CO 2. Manter culturas durante 6 - 8 dias, a mudança média a cada 48 horas.
Opcional: Para aumentar o rendimento da MPC, as células não aderentes de 2,3 poderia ser re-plaqueadas em um novo frasco de cultura e mantidas como descrito para as culturas primárias. - Aspirar e descarte médio de frascos, lavar com DMEM fresco e adicionar 2 ml de protease livre animais solução destacando. Incubar a 37 ° C durante 5-15 min (evitar incubação prolongada).
- Adicionar 10 ml de DMEM fresco PhABS / 10%, aspirar a suspensão celular e centrifugue a 400 xg durante 5 min
- Aspirar e elimine o sobrenadante e re-suspensão sedimento em 1 - 2 ml de DMEM fresco / 10% PhABS. Avance para contagem de células, tal como descrito no passo 1.10.
NOTA: Não use tripsina / EDTA como separar reagente. PPM tripsina são resistentes. rastreio morfológica das culturas, antes da colheita das células, é altamente recomendada a fim de avaliar a presença de células-MSC como fusiformes. No caso de quantidade considerável de células MSC-like são detected, aumentar a pureza do produto por remoção selectiva de células as células contaminadas. Para fazê-lo, a digestão com tripsina pode ser levada a cabo antes da colheita MPC, por adição de 2 ml de tripsina / EDTA a 0,05%, durante 2 min. culturas de lavagem duas vezes com 5 ml de DMEM / 10% PhABS, em seguida, proceder à protease tratamento como acima.
Caracterização 3. celular
- Citometria de fluxo
- Defina-se amostras duplicadas de 10 5 células recentemente isoladas em solução de lavagem: D-PBS suplementado com 0,5% (v / v) de albumina de soro bovino (BSA) e 0,02% (w / v) de azida de sódio. Centrifugar a 400 xg durante 5 min.
CUIDADO: A azida sódica é tóxica. - Re-suspender pelotas em 200 ul de solução de lavagem e adicionar anti-CD90, anti-CD45, anti-CD73 e anticorpos anti-CD31 conjugados com corantes fluorescentes ( "test"); em paralelo configurar os controles isotípicos ( "Ctrl").
NOTA: Os valores de coloração de anticorpos deve ser determinada por titulação ou According as instruções do fabricante. - Incubar as amostras a 4 ° C durante 30 min.
- Centrifugar a 400 xg durante 5 min. Células em 500 mL de solução de lavagem Re-suspender e adquirir pelo menos 5 x 10 4 eventos fluxo multicolor citômetro 7 9 10.
- Analisar os resultados por dot-plots e usar "Ctrl" eventos registrados para definir quadrantes.
NOTA: De modo a definir a cultura como cultura MPC a percentagem de CD73 CD90 NEG NEG CD45 + CD31 + células deve ser superior a 95%. Para algumas aplicações específicas, isto é, a análise da expressão de genes, a recuperação de corte tem de ser aumentada para 97-98%.
- Defina-se amostras duplicadas de 10 5 células recentemente isoladas em solução de lavagem: D-PBS suplementado com 0,5% (v / v) de albumina de soro bovino (BSA) e 0,02% (w / v) de azida de sódio. Centrifugar a 400 xg durante 5 min.
- detecção e análise nestina organização F-actina
- Placa PPM recentemente isoladas em lâminas de câmara de cultura (20.000 / cm 2). Permitir que as células aderir por incubação durante a noite a 37 ° C em 5% de CO 2.
- Lave as células na solução de lavagem e fiX em 4% (w / v) de para-formaldeído à temperatura ambiente durante 15 min. Para remover fixador adicionar solução de lavagem, incubar por 2 min e despeje.
- Repetir a lavagem duas vezes.
- Permeabilizar as células em D-PBS suplementado com 0,05% (v / v) de Triton X-100 durante 15 min à TA.
- Pare reacção por potenciador de proteína livre de sinal (30 min à temperatura ambiente) ou solução padrão de bloqueio (D-PBS suplementado com 3% (w / v) de BSA).
- Remover intensificador de sinal / solução de bloqueio.
- Adicionar 7 ug / ml (w / v) de anticorpo primário anti-humano nestina e incubar a 4 ° C durante a noite numa câmara humidificada. Em paralelo, utilizar anticorpos de controlo isotípicos para avaliar sinais de fluorescência não específicas.
- Lavagem das lâminas através da adição de D-PBS, deixe por 2 minutos e despeje. Repita duas vezes.
- Adicionar 2 ug / ml (w / v) de anticorpo secundário conjugado com corante fluorescente e incubar a 4 ° C durante 1 h no escuro.
- Lavagem das lâminas como acima.
- Adicionar faloidina fluorescente (5 UI / ml), deixar à temperatura ambiente durante 30 mem no escuro e lava-se 3 vezes em D-PBS.
- Remover as paredes da câmara e montar as lâminas em meio de montagem aquoso suplementado com antifade reagente e 4 ', 6-diamidino-2-fenilindole (DAPI) para a detecção de núcleos. Avance para imagiologia 7 9 10.
4. Mesengenic Diferenciação de PPM
- Placa de 2 x 10 4 / cm 2 PPM isolados de fresco em frascos de cultura T75-tratados TC e deixar as células aderir durante a noite em DMEM / 10% PhABS a 37 ° C em 5% de CO 2.
- Substituir DMEM / 10% PhABS com meio padrão de soro reduzida, cerca de 200 ul / cm 2, concebido para a expansão das células do mesênquima do estroma (meio de MSC-RS). Crescer as células até à confluência (P1-MSC), tipicamente de 7 a 10 dias após a indução. Atualizar média a cada 2 dias.
- Aspirar e descarte médio a partir de frascos, lave com meio MSC-RS fresco e adicionar 2 ml de protease livre animais solução destacando. Incubar a 3776; C por 5-15 min (evitar a incubação prolongada).
- Adicionam-se 10 ml de meio fresco MSC-RS, aspirar a suspensão celular e centrifugue a 400 xg durante 5 min
- Aspirar o sobrenadante e re-suspensão da pelota em 1-2 ml de meio fresco MSC-RS. Avance para contagem de células, tal como descrito no passo 1.10
- Avance para o sub-cultura los por sementeira 3-5 x 10 3 células / cm2. Crescer as células até à confluência (P2-MSC).
- Células colheita por digestão protease como descrito a partir do passo 4.3 para a etapa 4.5 e proceder à caracterização como descrito na seção 3.
NOTA: A percentagem de células CD31 neg neg CD73 + CD90 + CD45 inferior a 95% indicaria única diferenciação parcial e requer uma nova passagem de cultura. - Placa P2-MSCs a 2 x 10 4 / cm 2 em placas de seis poços TC-tratada e crescer até à confluência em meio de MSC-RS.
- Mark dois poços como "Não Diff" e atualizar meio MSC-RS.
- Mark duas bems como "Osteo" e substituir médio com 200 ul / cm 2 de meio osteogénico padrão, projetado especificamente para a diferenciação MSC.
- Mark dois poços como "Adipo" e substituir o meio com 200 ul / cm 2 de meio adipogênica padrão, projetado especificamente para a diferenciação MSC.
- Manter as culturas a 37 ° C em 5% de CO 2, mudando inteiros os meios de comunicação a cada 48 h.
NOTA: É altamente recomendável usar a mídia de diferenciação disponíveis comercialmente padrão para a reprodutibilidade teste. Depois de 2/3 semanas sob condições de diferenciação, depósitos de cálcio aparecem em culturas osteogênicas induzido, enquanto a acumulação de gotículas lipídicas intracelulares é evidente em células adipog�icas induzido. - Aspirar e descartar meios de cultura, em seguida, lavar com D-PBS.
- Fixar as culturas por adição de 1 ml de 4% (w / v) de paraf ormaldeido durante 15 minutos à temperatura ambiente.
- Para remover fixador adicionar D-PBS, incubar durante 2 min e verter. lavagem Repetirduas vezes.
- Manchar uma "No Diff", juntamente com os dois "Osteo" marcou poços na solução fluorescente específica hidroxiapatita e um "Não Diff", juntamente com os dois "Adipo" marcou poços em 200 solução nM Vermelho do Nilo. Incubar durante 30 minutos à temperatura ambiente 11,12.
- Remover manchas soluções e lave em D-PBS duas vezes.
- Remover D-PBS, adicionar D-PBS suplementado com 50% (v / v) de glicerina e continuar a imagiologia 7 9 10.
5. MPC Spheroid Sprouting Assay
- Para produzir esferóides 3D, colocar 20 gotas ul de suspensão MPC isolada de fresco (1,5 x 10 4 células / gota) na superfície interior de uma tampa de placa de Petri.
NOTA: Como gotas de manipulação poderia levar à sua ruptura, é altamente recomendável para colocá-los em excesso. - usar cuidadosamente a tampa para recapitular uma placa de Petri contendo D-PBS para evitar gotas de suspensão de evaporação. Incubar a 37 ° C em 5% de CO 2durante a noite para permitir que as células se agregar em esferóides 3D.
- Definir um gel espesso de proteínas murinas matriz extracelular (ECM) por adição de alíquotas de 300 ul de proteínas de ECM padrão em uma placa de cultura de pré-refrigerado de 24 poços, e incuba-se a 37 ° C durante 30 min.
- Cuidadosamente tombar a tampa placa de Petri e gentilmente pegar os esferóides utilizando uma pipeta Pasteur estéril.
- Lay esferóides sobre o gel proteína da MEC, adicionar 700 mL alíquotas de meio de crescimento de células endoteliais ricas de VEGF-padrão e incubar a 37 ° C em 5% de CO 2.
- Depois de 24 horas e aos 7 dias de cultura, tirar fotos das culturas 3D em 4X poder de ampliação. Avaliar brotando esferóides imagem Aplicando o software de análise medindo a distância radial entre a última célula invasora ea borda esferóide. medidas repetidas ao longo de pelo menos 20 direções diferentes. Distância média é considerado como positivo quando 50 mm ou mais.
Resultados
As condições de cultura seletivos aqui descritas permitiram o isolamento de um romance população de células aderentes e quase monomorphic como 1,0% do HBM-PTM (0,5 - 2,0 x 10 6 HBM-as multinacionais a partir de 5 - 10 ml de amostras BM frescos) 5,6 . Foram identificados estes grande (40 - 60 um de diâmetro), arredondado, as células quiescentes, Ki-67-negativas como PPM 5. Morfologicamente, eles são caracterizados por um ovo frito-forma característica, com uma região central rodeada por uma espessura fina periferia plana mostrando lotes de filopios em maior poder de ampliação (setas brancas na Figura 1 A.1). Alongamento Polar do limite da célula externa é muitas vezes observado (setas pretas na Figura 1 A.1). Tal morfologia é claramente diferente da aparência típica em forma de fuso celular de estroma mesenquimal relatado em culturas de MSC padrão. Fluxo mostrou citometria de mais de 95% dos PPM recentemente isolados para expressar CD31 e CD45, enquanto mesenchymal marcadores associados CD90 e CD73 foram indetectáveis 13 (Figura 1 A.2). Consideramos esse conjunto restrito de quatro antígenos como indicativo para PPM. Outras características distintivas de PPM são pontilhada distribuição F-actina revelando um número de estruturas podosome-like (vermelho na Figura 1 A.3) e a expressão intensa de nestina (verde na Figura 1 A.3), o que não é detectada nas células coradas com anticorpo de controlo isotípico (dados não mostrados).
PPM cultura in RS padrão médio projetado para o MSC expansão resulta em rápida diferenciação em crescimento exponencial células MSC-like (Figura 1 b.1). Após duas passagens células finalmente mudar seu fenótipo de CD73 CD90 neg neg CD45 + CD31 + para CD73 + CD90 + CD45 CD31 neg neg (Figura 1 B.2). No processo, PPM re-Organize F-actina em fibras de stress, enquanto expressão nestin torna-se confinado a poucas células raras (Figura 1 b.3). MPC diferenciação mesengenic num fenótipo MSC como definido ocorre por meio de dois passos distintos reveladas por diferentes morfologias celulares. Após uma semana em meio de MSC RS uma população residual de células MPC-como ainda é detectável dentro de uma camada confluente de apartamento, as células multi-ramificados poligonais (P1-MSCs na Figura 2 A). Uma outra passagem é necessária para obter uma cultura quase monomorphic de fusiformes células MSC-like (P2-MSCs na Figura 2 A). Estas células em crescimento exponencial pode facilmente diferenciar-se em osteoblastos ou adipócitos quando transferido para o meio selectivo para, pelo menos, 2 semanas, confirmando assim a sua natureza MSC. Osteogénicos em culturas induzidas, depósitos de cálcio pode ser detectado por qualquer mancha de Alizarina S-colorimétrico ou corantes fluorescentes específicos (verdes na Figura 2 B). Após as células de indução adipog�icasmostram um acúmulo de gotículas de gordura, como revelado por qualquer colorimétrico Red Oil ou fluorescente mancha Nile Red (vermelho na Figura 2 B).
MPC digitação foi confirmada por brotando ensaio de angiogénese. PPM mostraram a sua capacidade para invadir (mais de 50 mm) de gel de proteínas de ECM de murino a partir de esferóides 3D após 24 h de VEGF-estímulo (Figura 2 C). Após uma semana as células invasoras foram detectados a 300-600 uM distância. Por outro lado, a capacidade de invasão foi perdido em P2-MSCs após a diferenciação mesengenic (Figura 2 D).
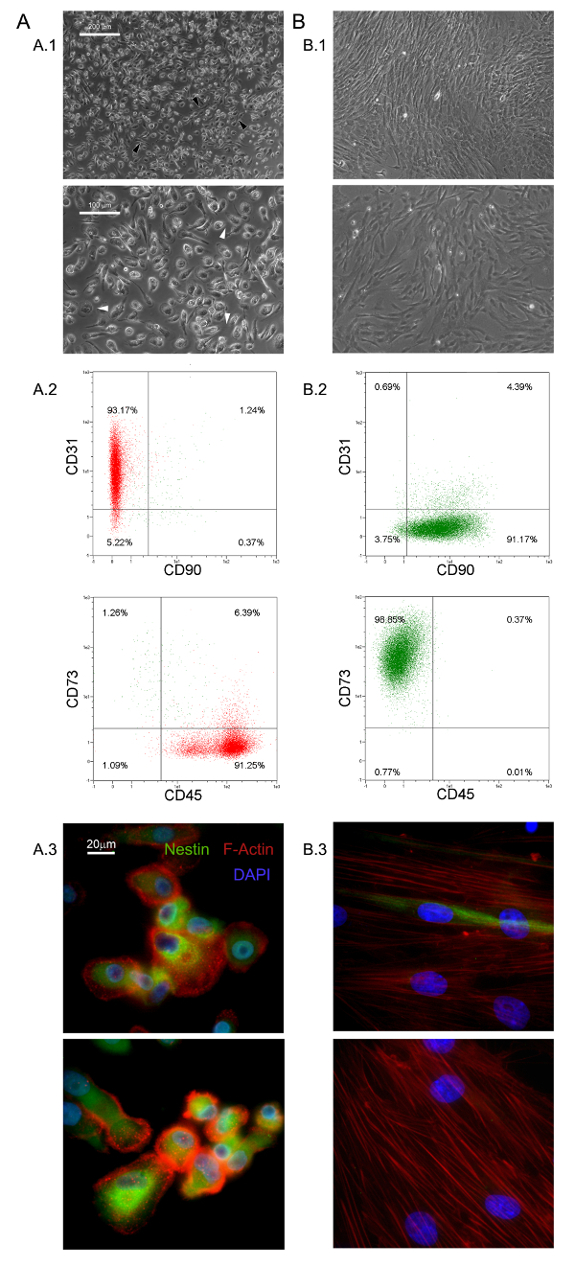
Figura 1. PPM recentemente isolados têm características distintivas. A cultura HBM-PTM em DMEM / 10% PhABS por sete dias dá origem a uma população de PPM de repouso (A) facilmente distinguível de MSCs (B) em termos de morfologia (A.1, B.1, barras de escala = 100 mm), fenótipo (A.2, B.2), F-actina de distribuição (vermelho em A.3, B.3), e expressão nestin (verde em A.3, B.3, barras de escala = 20 mm). por favor clique aqui para ver uma versão maior desta figura.
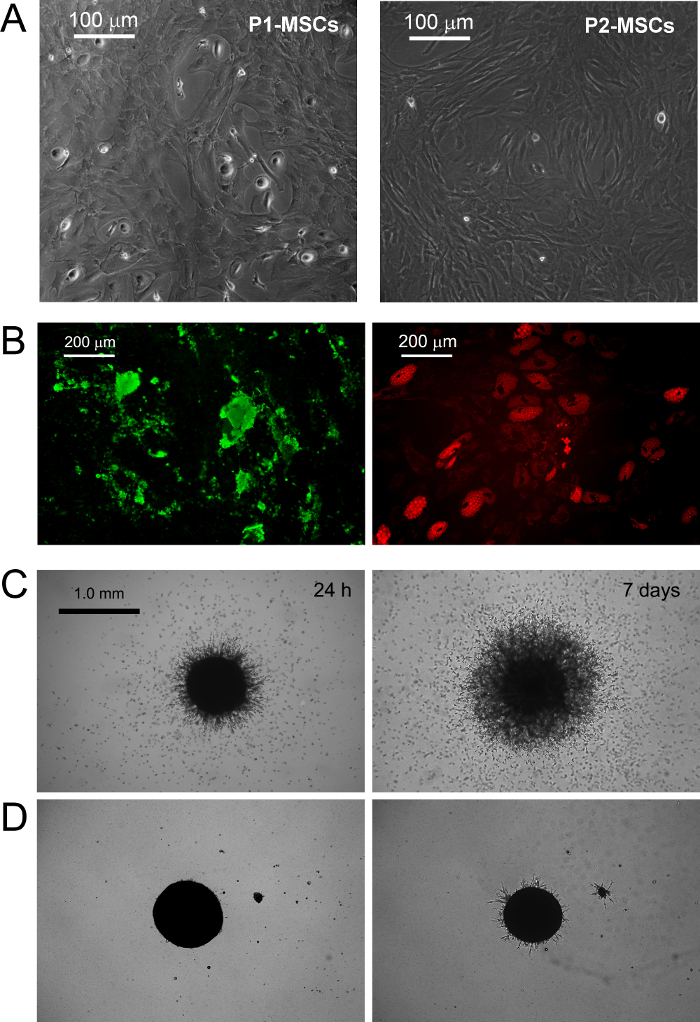
Figura 2. PPM diferenciar em MSCs Standard e Mostrar Sprouting Angiogenesis in vitro. Substituição de DMEM / PhABS com RS disponíveis comercialmente médio projetado para a expansão MSC provoca indução mesengenic de PPM. Depois de uma semana em cultura poucas PPM residuais são ainda detectáveis (P1-MSC), enquanto uma outra passagem em meio de MSC-RS leva a uma população de células confluentes, como MSC (P2-MSC, A barra de escala = 100 pm). P2-MSCs diferenciam terminalmente em osteócitos ou adipócitos sob estímulos adequados como revelado por deposição de cálcio (verde no B) e acúmulo de gotículas de gordura (vermelho em B, barras de escala = 200 mm), respectivamente. PPM mostrar surgimento consistente de esferóides em gel de proteína ECM murino (C) com uma diferença com P2-MSCs (D, barras de escala = 1,0 mm). Por favor clique aqui para ver uma versão maior desta figura.
Discussão
In the last decades, MSCs have been extensively researched and pre-clinically evaluated for possible application in the treatment of various bone/articular, immunological, neurological, cardiovascular, gastrointestinal and hematological disorders14,15. The easy and inexpensive isolation of multipotent MSCs, from many different tissues, together with their lack of significant immunogenicity16, contribute to make these cells one of the most interesting cell population to be applied in cell based therapies. Nonetheless, the very low frequency in the tissue of origin represents a great limitation to the MSCs application in clinics, forcing the expansion of these cells, in vitro, before the infusion or transplantation.
Expanded MSC cultures have revealed high grades of heterogeneity and variability17-19 making it difficult to reach a consensus about MSC production and characterization protocols. Moreover, recent investigations suggested the presence of multiple in vivo MSC ancestors in a wide range of tissues, which contribute to culture heterogeneity10,20. In fact, it has been proposed that particular culture conditions possibly select or simply promote specific sub-populations of MSCs progenitors present, in various percentages, in "crude" and unprocessed samples like bone marrow (hBM-MNCs) or adipose tissues (stromal vascular fraction)2. Thus, the variability in MSC-initiating cell populations together with the great number of different enrichment/isolation and culture protocols applied, represent a great obstacle to the definition of feasible MSC-based therapies.
A crucial factor affecting heterogeneity of MSC cultures is serum supplementation21. In our hands replacement of FBS with PhABS in primary cultures from hBM-MNCs, combined with high density seeding on hydrophobic plastics, led to the isolation of a novel highly adherent cell population with distinct biological features named MPCs5,6. We observed that the addition of small percentages of PhABS to FBS primary cultures also allowed MPC isolation, suggesting the presence of MPC inducing agents in the human serum6. At the moment, the MPC isolation/characterization protocol is a unique method available to obtain almost pure MPCs. The protocol has been carefully adjusted and it is highly reproducible for quality screening of MPC preparations before further applications.
MPCs could be used as a source for MSC production, thus limiting the variability introduced by use of unfractionated starting material. The precise definition of the multiple steps characterizing MPC mesengenic differentiation reported9 would allow synchronized mesenchymal cell expansion. Nonetheless, this latest condition could be realized exclusively applying highly purified MPC population, as a consequence the characterization of the cell products obtained by the protocol described here, results of crucial importance. This isolating method has been reported allowing MPC recovery with purity generally around 95%. However, donor/patient variability together with the variability related to the different batches of human pooled serum applied, could lead to a significant percentage of MSC-like cells co-isolated together with MPCs, under selective conditions.
It is not clear if these "contaminating" MSC-like cells could arise from the other different in vivo progenitors described in bone marrow22 or from uncontrolled and spontaneous MPC differentiation. In any case, a consistent percentage of MSC-like cells in the MPC products nullify the possibility to applying these cells as homogeneous starting material for the MSC expansion. Thus, here it has been suggested a simple and inexpensive method, based on the MPC resistance to trypsin digestion, increasing the purity of the MPC products. Similar or even better results in purifying MPC cultures could be achieved by fluorescent or magnetic cell sorting performing CD73 and/or CD90 depletion, but significantly prolonging the process time and increasing the costs.
Moreover, MPCs showed expression of pluripotency-associated markers and Nestin, all rapidly lost during mesengenic differentiation7. Sprouting assay revealed MPC ability to invade murine ECM protein gel. Taken together these results indicate that MPCs have to be considered a more immature progenitor, retaining angiogenic potential. Nonetheless, the initial enthusiasm about mesodermal differentiation potential of MPCs is actually waning. In fact, after more than 7 years of studies on MPCs, mesengenic and angiogenic potential have been extensively described5-9, but differentiation toward any other cells of mesodermal origin is still lacking. Thus, here we propose a new, and more rigorous, definition of these cells as "Mesangiogenic Progenitor Cells", maintaining the acronym MPCs.
We also believe that most controversies about MSC angiogenic potential could be related to the heterogeneous composition of expanded cultures consisting of sub-populations of MPCs and MSCs in variable percentages23.
Finally, MPCs could also play a crucial role for the implementation of CBMPs applicable for tissue reconstruction, as these cells could also support the neo-vascularization. In fact, future studies on regeneration should take in consideration that the newly formed tissue growth should be supported by concomitant neo-angiogenesis. The co-existence of mesengenic and angiogenic potential in MPCs could significantly improve the regeneration potential of new therapeutic approaches that involve these interesting cells.
Divulgações
The authors have no competing financial interests or other conflicts of interest.
Agradecimentos
Os Autores Em particular, gostaria de agradecer ao Dr. Paolo Parchi, departamento de cirurgia, médicos e Patologia Molecular e Critical Care Medicine, da Universidade de Pisa, para fornecer amostras de medula óssea e sua experiência em osteo-progenitores humanos
Materiais
| Name | Company | Catalog Number | Comments |
| Matrigel Basement Membrane Matrix | BD Bioscience (San Jose, CA-USA) | 354230 | Murine ECM proteins Stock Concentration: 100% (9 - 12 mg/ml) Final Concentration: 100% |
| Dulbecco's Phosphate-Buffered Saline (D-PBS) | Sigma (St. Louis, MO, USA) | D8537 | |
| 70 μm Filters | Miltenyi Biotec (BergischGladbach, Germany) | 130-095-823 | |
| Ficoll-Paque PREMIUM | GE Healthcare (Uppsala, Sweden) | 17-5442-03 | medium for discontinuos density gradient centrifugation |
| Pooled human AB type serum (PhABS) | LONZA (Walkersville MD-USA) | 14-490E | Final Concentration: 10% |
| Glutamax-I | ThermoFisher (Waltham, MA USA) | 35050-038 | Stabilized L-Glutamine Stock Concentration: 100x Final Concentration: 2 mM |
| Bovine Serum Albumin (BSA) | Sigma (St. Louis, MO, USA) | A8412 | Stock Concentration: 7.5% Final Concentration: 0.5% |
| Sodium Azide | Sigma (St. Louis, MO, USA) | S8032 | Final Concentration: 0.02% |
| Penicillin/Streptomycin (Pen Strep) | Gibco (Grand Island, NY, USA) | 15070-063 | Antibiotics Stock Concentration: 5,000 UI/ml penicillin, 5,000 μg/ml Streptomycin Final Concentration: 50 UI/ml penicillin, 50 μg/ml Streptomycin |
| T-75 culture flask for suspension cultures | Greiner Bio-one (Frickenhausen, Germany) | 658 190 | |
| T-75 culture flask TC treated | Greiner Bio-one (Frickenhausen, Germany) | 658170 | |
| TrypLE Select | ThermoFisher (Waltham, MA USA) | 12563-011 | Animal-free proteases detaching solution Stock Concentration: 1x Final Concentration: 1x |
| Trypsin/EDTA | ThermoFisher (Waltham, MA USA) | 15400-054 | Phenol red free Stock Concentration: 0.5% Final Concentration: 0.25% |
| anti-CD90 APC antibody (CD90) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-402 | Final Concentration: 1:40 |
| anti-CD45 APC-Vio770 antibody (CD45) | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-609 | Final Concentration: 1:40 |
| anti-CD73 PE antibody (CD73) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-182 | Final Concentration: 1:40 |
| anti-CD31 PE Vio-770 antibody (CD31) | MiltenyiBiotec (BergischGladbach, Germany) | 130-105-260 | Final Concentration: 1:40 |
| Mouse IgG1 APC antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-846 | Final Concentration: 1:40 |
| Mouse IgG2a APC Vio770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-637 | Final Concentration: 1:40 |
| Mouse IgG1 PE antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-845 | Final Concentration: 1:40 |
| Mouse IgG1 PE Vio-770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-563 | Final Concentration: 1:40 |
| Low Glucose Dulbecco's Modified Eagle Medium (DMEM) | ThermoFisher (Waltham, MA USA) | 13-1331-82 | Phenol red-free minimal essential medium Stock Concentration: 1,000 mg/L glucose |
| Fetal Bovine Serum (FBS) | ThermoFisher (Waltham, MA USA) | 10500 | Stock Concentration:0.2 mg/ml Final Concentration: 2 μg/ml |
| Prolong Gold antifade reagent with 4’,6-diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | P-36931 | Aqueous mounting medium + DAPI Final Concentration: 1x |
| Paraformaldehyde | Sigma (St. Louis, MO, USA) | P6148 | Fixative Final Concentration: 4% |
| LAB-TEK two-well chamber slides | Sigma (St. Louis, MO, USA) | C6682 | |
| Anti-Nestin antibody [clone 10C2] | Abcam (Cambridge, UK) | ab2035 | Stock Concentration: 1 mg/ml Final Concentration: 7 μg/ml |
| Alexa Fluor 555 Phalloidin | ThermoFisher (Waltham, MA USA) | A34055 | Stock Concentration: 200 UI/ml Final Concentration: 5 UI/ml |
| Triton X-100 | Euroclone (Milan, Italy) | EMR237500 | Final Concentration: 0.05% |
| MesenPRO RS Medium (MSC-RS medium) | ThermoFisher (Waltham, MA USA) | 12746-012 | |
| Alexa Fluor 488 anti-mouse SFX kit | ThermoFisher (Waltham, MA USA) | A31619 | Goat anti-mouse secondary antibody + Signal enhancer Stock Concentration: 2 mg/ml Final Concentration: 2 μg/ml |
| Pasteur Pipette | Kartell Labware (Noviglio (MI), ITALY ) | 329 | |
| StemMACS AdipoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-679 | |
| StemMACS OsteoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-678 | |
| Osteoimage Bone mineralization Assay | LONZA (Walkersville MD-USA) | PA-1503 | Hydroxyapatite specific fluorescent staining solution |
| 50 ml Polystyrene conical tube | Greiner bio-one (Kremsmünster Austria) | 227261 | |
| Nile Red | ThermoFisher (Waltham, MA USA) | N1142 | Fluorescent staining solution for lipids Stock Concentration: 100 mM Final Concentration: 200 Nm |
| Glycerin | Sigma (St. Louis, MO, USA) | G2289 | Final Concentration: 50% |
| Polistirene Petri dishes | Sigma (St. Louis, MO, USA) | P5606 | |
| 24-well plates TC-treated | Greiner Bio-one GmbH (Frickenhausen, Germany) | 662160 | |
| Endothelial Growth Medium, EGM-2 BulletKit (EGM-2) | LONZA (Walkersville MD-USA) | CC-3162 | VEGF-rich endothelial cell growth medium |
| Leica Qwin Image Analisys Software | Leica (Wetzlar, Germany) | Image analysis software |
Referências
- Stoltz, J. F., et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015, 734731 (2015).
- Pacini, S. Deterministic and stochastic approaches in the clinical application of mesenchymal stromal cells (MSCs). Front Cell Dev Biol. 2, 50 (2014).
- Galvez, P., Clares, B., Hmadcha, A., Ruiz, A., Soria, B. Development of a cell-based medicinal product: regulatory structures in the European Union. Br Med Bull. 105, 85-105 (2013).
- Herberts, C. A., Kwa, M. S., Hermsen, H. P. Risk factors in the development of stem cell therapy. J Transl Med. 9, 29 (2011).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Pacini, S., et al. Constitutive expression of pluripotency-associated genes in mesodermal progenitor cells (MPCs). PLoS One. 5 (3), 9861 (2010).
- Pacini, S., et al. Specific integrin expression is associated with podosome-like structures on mesodermal progenitor cells. Stem Cells Dev. 22 (12), 1830-1838 (2013).
- Fazzi, R., et al. Mesodermal progenitor cells (MPCs) differentiate into mesenchymal stromal cells (MSCs) by activation of Wnt5/calmodulin signalling pathway. PLoS One. 6 (9), 25600 (2011).
- Tormin, A., et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood. 117 (19), 5067-5077 (2011).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Wang, Y. H., Liu, Y., Maye, P., Rowe, D. W. Examination of mineralized nodule formation in living osteoblastic cultures using fluorescent dyes. Biotechnol Prog. 22 (6), 1697-1701 (2006).
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7 (5), 393-395 (2005).
- Wang, S., Qu, X., Zhao, R. C. Clinical applications of mesenchymal stem cells. J Hematol Oncol. 5, 19 (2012).
- Si, Y. L., Zhao, Y. L., Hao, H. J., Fu, X. B., Han, W. D. MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Res Rev. 10 (1), 93-103 (2011).
- Le Blanc, K., Tammik, C., Rosendahl, K., Zetterberg, E., Ringden, O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 31 (10), 890-896 (2003).
- Phinney, D. G. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. 6 (23), 2884-2889 (2007).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Tolar, J., Le Blanc, K., Keating, A., Blazar, B. R. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 28 (8), 1446-1455 (2010).
- Corselli, M., et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 21 (8), 1299-1308 (2012).
- Bieback, K., et al. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. 27 (9), 2331-2341 (2009).
- Watson, L., Elliman, S. J., Coleman, C. M. From isolation to implantation: a concise review of mesenchymal stem cell therapy in bone fracture repair. Stem Cell Res Ther. 5 (2), 51 (2014).
- Pacini, S., Petrini, I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells. Front Cell Dev Biol. 2, 20 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados