Method Article
Isolare le cellule progenitrici Mesangiogenic (PPM) da midollo osseo umano
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Here we describe an optimized, highly reproducible protocol to isolate Mesodermal Progenitor Cells (MPCs) from human bone marrow (hBM). MPCs were characterized by flow cytometry and nestin expression. They showed the ability to give rise to exponentially growing MSC-like cell cultures while retaining their angiogenic potential.
Abstract
In a research study aimed to isolate human bone marrow (hBM)-derived Mesenchymal Stromal Cells (MSCs) for clinical applications, we identified a novel cell population specifically selected for growth in human serum supplemented medium. These cells are characterized by morphological, phenotypic, and molecular features distinct from MSCs and we named them Mesodermal Progenitor Cells (MPCs). MPCs are round, with a thick highly refringent core region; they show strong, trypsin resistant adherence to plastic. Failure to expand MPCs directly revealed that they are slow in cycling. This is as also suggested by Ki-67 negativity. On the other hand, culturing MPCs in standard medium designed for MSC expansion, gave rise to a population of exponentially growing MSC-like cells. Besides showing mesenchymal differentiation capacity MPCs retained angiogenic potential, confirming their multiple lineage progenitor nature. Here we describe an optimized highly reproducible protocol to isolate and characterize hBM-MPCs by flow cytometry (CD73, CD90, CD31, and CD45), nestin expression, and F-actin organization. Protocols for mesengenic and angiogenic differentiation of MPCs are also provided. Here we also suggest a more appropriate nomenclature for these cells, which has been re-named as "Mesangiogenic Progenitor Cells".
Introduzione
Cellule stromali mesenchimali (MSC) sono di valore clinico rilevante per la loro capacità di differenziazione multi-lignaggio e la loro capacità di sostenere emopoiesi, di secernere fattori di crescita / citochine, nonché a svolgere un ruolo nella immunoregolazione 1. Nella definizione di produzione di celle terapie MSC-based e l'applicazione sono stati oggetto di numerose ricerche cliniche e pre-clinica 2, con particolare attenzione alle specifiche normative internazionali per la sicurezza e l'efficacia di cellula medicinale (CBMP) trattamenti 3 based. MSC umane sono ampiamente coltivate in terreni contenenti integratori e reagenti di origine animale, come il siero fetale bovino (FBS) e tripsina bovina. Pertanto, insieme con i rischi infettive legate alla manipolazione cellulare, i pazienti devono affrontare anche prione esposizione così come i rischi immunologici legati alle proteine, peptidi o altre biomolecole di origine animale che potrebbero persistere dopo la raccolta delle cellule e Transplanzione 4.
Per aggirare il problema, abbiamo colto midollo osseo umano (HBM) MSC -derived in terreno privo di animali, sostituendo FBS con pool umana di tipo AB di siero (PhABS). In queste condizioni, insieme a MSC crescenti abbiamo identificato una popolazione di cellule romanzo. Queste cellule erano morfologicamente e fenotipicamente diverso da cellule staminali mesenchimali e hanno mostrato un profilo di espressione genica distintivo e caratteristico proprietà crescita / adesione. Hanno mantenuto entrambe le celle mesengenic e potenziale angiogenici e, pertanto, sono stati nominati mesodermiche progenitrici (PPM) 5. Successivamente, siamo stati in grado di definire le condizioni di coltura selettive e riproducibili per generare PPM ad alto grado di purezza 6.
Abbiamo studiato ulteriormente le proprietà morfologiche e biologiche di PPM. I PPM hanno dimostrato di essere nestina-positivi, lento nel ciclismo, Ki-67-negativi, e con i cromosomi caratterizzate da lunghi telomeri 5. Hanno espresso plurI fattori di trascrizione ipotency-associata MSC Master regolatori Runx2 e SOX9 7 ottobre-4 e Nanog, piuttosto che. Fenotipicamente, PPM espresso endoglina (CD105) a livello inferiore rispetto MSC mentre manca marcatori mesenchimali CD73, CD90, CD166. MPC ha anche mostrato un modello distintivo di molecole di adesione caratterizzate da espressione coerente di PECAM (CD31), integrine αL (CD11a), αM (CD11b), αX (CD11c), così come integrina β2 (CD18) che sostiene in particolare le strutture podosome simile 8 . In mezzi espansione MSC standard PPM prontamente differenziate in cellule staminali mesenchimali attraverso uno stadio intermedio con l'attivazione di cellule Wnt5 / Calmodulina segnalazione 9. PPM anche mantenuto angiogeniche, come dimostrato dalla loro capacità di germogliare da sferoidi a murini matrice extracellulare (ECM) culture proteine 3D. Il potenziale angiogenico è stato rapidamente perso dopo la differenziazione MPC lungo il lignaggio mesengenic.
Qui vi presentiamo proprotocolli ottimizzati per isolare e caratterizzare PPM altamente purificati da campioni di sangue HBM. protocolli riproducibili per MPC mesengenic e differenziazione angiogenici sono anche descritti.
Protocollo
NOTA: dopo il consenso scritto, campioni HBM sono stati ottenuti durante l'intervento chirurgico ortopedico per protesi d'anca. Subito dopo femorale osteotomia collo e prima femorale alesatura una siringa da 20 ml contenente 500 UI di eparina, è stato utilizzato per aspirare BM fresco. Il protocollo è da considerarsi ampiamente applicabile a qualsiasi fonte BM.
1. Isolamento dell'osso umano cellule del midollo mononucleate (HBM-MNC)
- Diluire 5 - 10 ml di BM fresco a 50 ml, l'applicazione di una soluzione salina tamponata con fosfato Dulbecco (D-PBS) e mescolare per inversione. Altrettanto distribuire 25 ml in due nuove provette da 50 ml coniche, aggiungere 25 ml di D-PBS in ogni provetta e miscelare per inversione.
- Lasciare le provette riposare per 10 min a temperatura ambiente, per la separazione di frammenti ossei minerali e grasso dalla soluzione.
- Rimuovere con attenzione il grasso galleggiante con una pipetta e filtro sospensione cellulare Pasteur sterile attraverso 70 micron filtri senza disturbare il frammento pellet minerale ossea.
- Imposta quattro 50 ml provette con 15 ml di terreno per discontinua centrifugazione in gradiente di densità (1.077 g / ml). Assicurarsi che questo mezzo è a temperatura ambiente.
- Delicatamente lay 20 - 25 ml di diluito BM sulla parte superiore del gradiente di densità media. Eseguire questa operazione con attenzione, lasciando gocciolare sospensione cellulare sulle pareti dei tubi per evitare strati di miscelazione.
- Effettuare gradiente di densità centrifugazione a 400 xg per 30 min a temperatura ambiente con freno disattivato.
- Raccogliere l'anello biancastro di cellule situate tra le due fasi usando una pipetta Pasteur sterile e trasferirlo in una nuova provetta 50 ml.
- Lavare le cellule con mezzo di coltura fresco: rosso fenolo-libero, basso livello di glucosio (1.000 mg / l) Dulbecco Modified Eagle Medium (DMEM), 10% (v / v) pool di tipo AB siero umano (PhABS), 2 mM L-glutammina e antibiotici (/ 10% PhABS DMEM). Centrifugare a 400 xg per 5 min.
- Aspirare il surnatante e risospendere pellet in 5 - 10 ml di DMEM fresco / 10% PhABS.
- Procedere alla conta delle cellule.Determinare il numero di globuli bianchi da 1: 1 diluizione trypan. Applicare questo al emocitometro, e osservare al microscopio a contrasto di fase. Escludere le piccole e perfettamente arrotondati eritrociti e cellule morte blu macchiato dalla conta delle cellule.
NOTA: Si raccomanda di PhABS schermo lotti per le loro prestazioni nel recupero MPC. PhABS da fonti USA hanno dato i migliori risultati, mentre la maggior parte sieri di diversa origine ha provocato culture MPC con percentuali più elevate di cellule MSC-like.
2. Isolamento di PPM da HBM-multinazionali
- Impostare idrofobiche T-75 beute da 15 ml di DMEM fresco / 10% PhABS e lasciate pH e la temperatura si equilibrano pre-incubazione a 37 ° C in 5% CO 2 per 30 min.
- Seed 4-6 x 10 7 HBM-multinazionali per pallone e incubare a 37 ° C in 5% di CO 2 per 48 ore.
- Aspirare ed eliminare le cellule medie e non aderenti da fiaschi. Aggiungere 15 ml di fresca DMEM / 10% PhABS e incubare a 37 ° Cnel 5% di CO 2. Mantenere le culture per 6 - 8 giorni, il cambio medio ogni 48 ore.
Facoltativo: per aumentare la resa MPC, le cellule non aderenti da 2.3 potrebbero essere ri-placcato in un nuovo pallone di coltura e mantenute come descritto per le colture primarie. - Aspirare e scartare media da fiaschi, lavare con DMEM fresco e aggiungere 2 ml di animale proteasi distacco soluzione. Incubare a 37 ° C per 5 - 15 minuti (evitare di incubazione prolungata).
- Aggiungere 10 ml di fresca DMEM / 10% PhABS, aspirare la sospensione cellulare e centrifugare a 400 xg per 5 min
- Aspirare e scartare il surnatante e risospendere pellet in 1 - 2 ml di DMEM fresco / 10% PhABS. Procedere alla conta delle cellule come descritto al punto 1.10.
NOTA: non utilizzare tripsina / EDTA come distacco reagente. PPM sono tripsina resistente. proiezione morfologica delle culture, prima raccolta di cellule, è consigliabile per valutare la presenza di cellule MSC-like fusiformi. In caso notevole quantità di cellule MSC-simili sono detected, aumentare la purezza del prodotto cellulare rimuovendo selettivamente le cellule contaminati. Per fare ciò, tripsina digestione può essere effettuata prima MPC raccolta, aggiungendo 2 ml di tripsina / EDTA 0,05% per 2 min. culture lavare due volte con 5 ml di DMEM / 10% PhABS, quindi procedere alla proteasi trattamento come sopra.
3. Caratterizzazione delle cellule
- Citometria a flusso
- Impostare campioni duplicati di 10 5 cellule appena staccati in soluzione di lavaggio: D-PBS integrato con 0,5% (v / v) di siero albumina bovina (BSA) e 0,02% (w / v) di sodio azide. Centrifugare a 400 xg per 5 min.
ATTENZIONE: sodio azide è tossica. - Risospendere pellet in 200 ml di soluzione di lavaggio e aggiungere anti-CD90, anti-CD45, anti-CD73 e gli anticorpi anti-CD31 coniugati con coloranti fluorescenti ( "test"); in parallelo istituito controlli isotipo ( "CTRL").
NOTA: Le quantità di colorazione anticorpi dovrebbero essere determinati per titolazione o According le istruzioni del produttore. - Incubare i campioni a 4 ° C per 30 min.
- Centrifugare a 400 xg per 5 min. Risospendere le cellule in 500 ml di soluzione di lavaggio e di acquisire almeno 5 x 10 4 eventi in flusso multicolore citometro 7 9 10.
- Analizzare i risultati di dot-trame e usare "CTRL" eventi registrati per impostare quadranti.
NOTA: Al fine di definire la cultura come la cultura MPC la percentuale di CD73 neg CD90 neg CD45 + cellule CD31 + dovrebbe essere oltre il 95%. Per alcune applicazioni specifiche, cioè, analisi di espressione genica, il recupero cut-off deve essere aumentata a 97 - 98%.
- Impostare campioni duplicati di 10 5 cellule appena staccati in soluzione di lavaggio: D-PBS integrato con 0,5% (v / v) di siero albumina bovina (BSA) e 0,02% (w / v) di sodio azide. Centrifugare a 400 xg per 5 min.
- il rilevamento e l'analisi Nestin organizzazione F-actina
- Piastra PPM di fresco isolato su slitte camera di cultura (20.000 / cm 2). Consentono alle cellule di aderire mediante incubazione overnight a 37 ° C in 5% CO 2.
- Lavare le cellule in soluzione di lavaggio e fix a 4% (w / v) para-formaldeide a temperatura ambiente per 15 min. Per rimuovere fissativo aggiungere soluzione di lavaggio, incubare per 2 minuti e versare.
- Ripetere l'operazione di lavaggio due volte.
- Permeabilize cellule in D-PBS integrato con 0,05% (v / v) Triton X-100 per 15 minuti a RT.
- Arrestare reazione da proteine enhancer connessione di segnale (30 min a RT) o soluzione di saturazione standard (D-PBS integrato con 3% (w / v) BSA).
- Rimuovere potenziatore di segnale / soluzione bloccante.
- Aggiungere 7 pg / ml (w / v) di anticorpo primario nestin anti-umana e incubare a 4 ° C per una notte in una camera umidificata. In parallelo, usare gli anticorpi controllo isotipico per valutare segnali di fluorescenza non specifici.
- Lavare i vetrini con l'aggiunta di D-PBS, lasciare per 2 minuti e versare. Ripetere due volte.
- Aggiungere 2 ug / ml (w / v) di colorante fluorescente anticorpo secondario coniugato e incubare a 4 ° C per 1 ora al buio.
- Lavare i vetrini come sopra.
- Aggiungi falloidina fluorescente (5 UI / ml), lasciare a temperatura ambiente per 30 min al buio e lavare 3 volte in D-PBS.
- Rimuovere le pareti della camera e montare le diapositive in mezzo di montaggio acquoso integrato con antifade reagente e 4 ', 6-diamidino-2-phenylindole (DAPI) per il rilevamento di nuclei. Procedere al di imaging 7 9 10.
4. Mesengenic Differenziazione di PPM
- Piastra 2 x 10 4 / cm 2 PPM appena isolate in fiasche di coltura T75 TC-trattati e lasciare che le cellule aderiscono durante la notte in DMEM / 10% PhABS a 37 ° C in 5% di CO 2.
- Sostituire DMEM / 10% PhABS con medie standard ridotta siero, circa 200 ml / cm 2, progettato per l'espansione delle cellule mesenchimali stromali (media MSC-RS). Crescere le cellule a confluenza (P1-MSC), tipicamente da 7 a 10 giorni dalla induzione. Refresh media ogni 2 giorni.
- Aspirare e scartare media da fiaschi, lavare con media MSC-RS fresca e aggiungere 2 ml di animale proteasi distacco soluzione. Incubare a 3776; C per 5 - 15 minuti (evitare di incubazione prolungata).
- Aggiungere 10 ml di terreno MSC-RS fresco, aspirare la sospensione cellulare e centrifugare a 400 xg per 5 min
- Aspirare il surnatante e risospendere pellet in 1 - 2 ml di mezzo MSC-RS fresco. Procedere alla conta delle cellule come descritto al punto 1.10
- Procedere alla sub-cultura loro da semina 3-5 x 10 3 cellule / cm 2. Crescere le cellule a confluenza (P2-MSC).
- Celle di raccolta di proteasi digestione come descritto dal punto 4.3 al punto 4.5 e procedere alla caratterizzazione come descritto nel paragrafo 3.
NOTA: Una percentuale di cellule CD31 neg neg CD73 + CD90 + CD45 inferiore al 95% indicherebbe solo parziale differenziazione e richiedono un ulteriore passaggio cultura. - Piastra P2-MSC a 2 x 10 4 / cm 2 in sei piatti ben TC-trattati e crescere fino a confluenza in media MSC-RS.
- Mark due pozzi come "No Diff" e rinfrescare medio MSC-RS.
- Mark due bens come "Osteo" e sostituire media con 200 pl / cm 2 di media osteogenico norma, specificamente progettato per la differenziazione MSC.
- Mark due pozzi come "Adipo" e sostituire media con 200 pl / cm 2 di media adipogenico norma, specificamente progettato per la differenziazione MSC.
- Mantenere le culture a 37 ° C in 5% di CO 2 modificando tutto il supporto ogni 48 ore.
NOTA: Si consiglia di utilizzare supporti di differenziazione disponibili in commercio standard, per la prova di riproducibilità. Dopo 2/3 settimane in condizioni di differenziazione, depositi di calcio appaiono in osteogeniche indotta culture, mentre intracellulari gocce lipidiche accumulo è evidente nelle cellule adipogenici indotta. - Aspirare e scartare terreni di coltura poi lavare con D-PBS.
- Fissare le culture aggiungendo 1 ml di 4% (w / v) para-formaldeide per 15 min a temperatura ambiente.
- Per rimuovere fissativo aggiungere D-PBS, incubare per 2 minuti e versare. Ripetere il lavaggiodue volte.
- Macchia un "No Diff" insieme con i due "Osteo" segnato pozzi in soluzione fluorescente specifica idrossiapatite e uno "No Diff" insieme con i due "Adipo" segnato pozzi a 200 nM soluzione Nile Red. Incubare per 30 minuti a temperatura ambiente 11,12.
- Rimuovere la colorazione soluzioni e lavare in D-PBS due volte.
- Rimuovere D-PBS, aggiungere D-PBS integrato con il 50% (v / v) glicerina e procedere all'imaging 7 9 10.
5. MPC Spheroid Cavolo Assay
- Per produrre sferoidi 3D, lay 20 gocce microlitri di sospensione MPC fresco isolato (1,5 x 10 4 cellule / drop) sulla superficie interna di un coperchio piatto Petri.
NOTA: Come gocce di gestione potrebbe portare alla loro rottura, è altamente raccomandabile per disporle in eccesso. - usare con cautela il coperchio per ricapitolare una capsula di Petri contenente D-PBS per evitare appeso gocce evaporazione. Incubare a 37 ° C in 5% di CO 2durante la notte per consentire alle cellule di aggregare in sferoidi 3D.
- Impostare una spessa gel di proteine murine matrice extracellulare (ECM) aggiungendo 300 microlitri aliquote di proteine ECM standard, in una piastra pre-refrigerato coltura da 24 pozzetti e incubare a 37 ° C per 30 min.
- facendo attenzione sopra il coperchio piastra di Petri e delicatamente raccogliere i sferoidi utilizzando una pipetta Pasteur sterile.
- Posare sferoidi sul gel di proteine ECM, aggiungere 700 microlitri aliquote del mezzo di crescita delle cellule endoteliali ricchi di VEGF standard ed incubare a 37 ° C in 5% di CO 2.
- Dopo 24 ore e a 7 giorni di coltura, scattare foto delle culture 3D 4x potere di ingrandimento. Valutare spuntano da sferoidi applicano immagine software di analisi misurando la distanza radiale tra ultima cella che invade e il bordo sferoide. misure ripetute lungo almeno 20 diverse direzioni. Distanza media è considerato come positivo quando il 50 micron o sopra.
Risultati
Le condizioni di coltura selettivi qui descritte hanno permesso l'isolamento di un romanzo popolazione di cellule aderenti e quasi monomorfe come 1.0% del HBM-multinazionali (0,5 - 2,0 x 10 6 HBM-MNC da 5 - 10 ml di campioni di BM freschi) 5,6 . Abbiamo identificato questi grandi (40 - 60 micron di diametro), arrotondato, le cellule, Ki-67-negativi quiescenti come PPM 5. Morfologicamente, sono caratterizzati da un uovo fritto forma distintiva con una regione di nucleo denso circondato da una periferia sottile piatta mostrando un sacco di filopodia a più alto potere di ingrandimento (frecce bianche in figura 1 A.1). L'allungamento polare del confine cellulare esterna è spesso osservato (frecce nere in figura 1 A.1). Tale morfologia è chiaramente diverso dal tipico aspetto mesenchimali cellule stromali a forma di fuso riportato nelle culture MSC standard. Citometria a flusso ha mostrato oltre il 95% di PPM appena isolate per esprimere CD31 e CD45, mentre mesenchymal marcatori associati CD90 e CD73 13 erano non rilevabili (Figura 1 A.2). Consideriamo questo ristretto insieme di quattro antigeni come indicativo per PPM. Ulteriori caratteristiche distintive di PPM sono la distribuzione tratteggiata F-actina rivelando un certo numero di strutture podosome-like (rosso nella figura 1 A.3) e intensa espressione di nestina (verde nella figura 1 A.3), che non viene rilevata nelle cellule macchiato con l'anticorpo controllo isotipico (dati non riportati).
PPM coltura in RS standard di media progettati per MSC risultati espansione nella differenziazione rapida in cellule MSC-like in crescita esponenziale (figura 1 B.1). Dopo due passaggi cellule finalmente passare il loro fenotipo da CD73 neg CD90 neg CD45 + CD31 + CD73 + CD90 a + CD45 neg CD31 neg (Figura 1 B.2). Nel processo, PPM ri-orgascere F-actina in fibre di stress mentre l'espressione nestina viene confinato in poche cellule rare (Figura 1 B.3). MPC differenziazione mesengenic in un fenotipo MSC-come definito avviene attraverso due fasi distinte rivelate da diverse morfologie di cellule. Dopo una settimana in media MSC RS una popolazione residua di cellule MPC-like è ancora rilevabile all'interno di uno strato confluente di appartamento, celle multi-ramificati poligonali (P1-MSC in Figura 2 A). Un ulteriore passaggio è necessaria per ottenere una cultura quasi monomorfa di fusiformi cellule MSC-like (P2-MSC nella Figura 2). Queste cellule in crescita esponenziale possono facilmente differenziarsi in osteoblasti o adipociti quando vengono trasferiti in terreni selettivi per almeno 2 settimane, confermando in tal modo la loro natura MSC. In osteogeniche indotta culture, depositi di calcio possono essere rilevate da una macchia colorimetrico Alizarina-S o coloranti fluorescenti specifici (verde nella figura 2 B). Dopo che le cellule induzione adipogenicimostrare l'accumulo di goccioline di lipidi, come rivelato da uno colorimetrica Oil Red o fluorescente Nile Red macchia (rosso nella figura 2 B).
MPC battitura è stato confermato da germinazione dosaggio angiogenesi. PPM hanno dimostrato la loro capacità di invadere (oltre 50 micron) gel proteina murina ECM da sferoidi 3D dopo 24 ore VEGF-stimolo (Figura 2 C). Dopo che le cellule che invadono una settimana sono stati rilevati a 300-600 micron di distanza. Al contrario, la capacità di invasione è stato perso in P2-MSC dopo la differenziazione mesengenic (Figura 2 D).
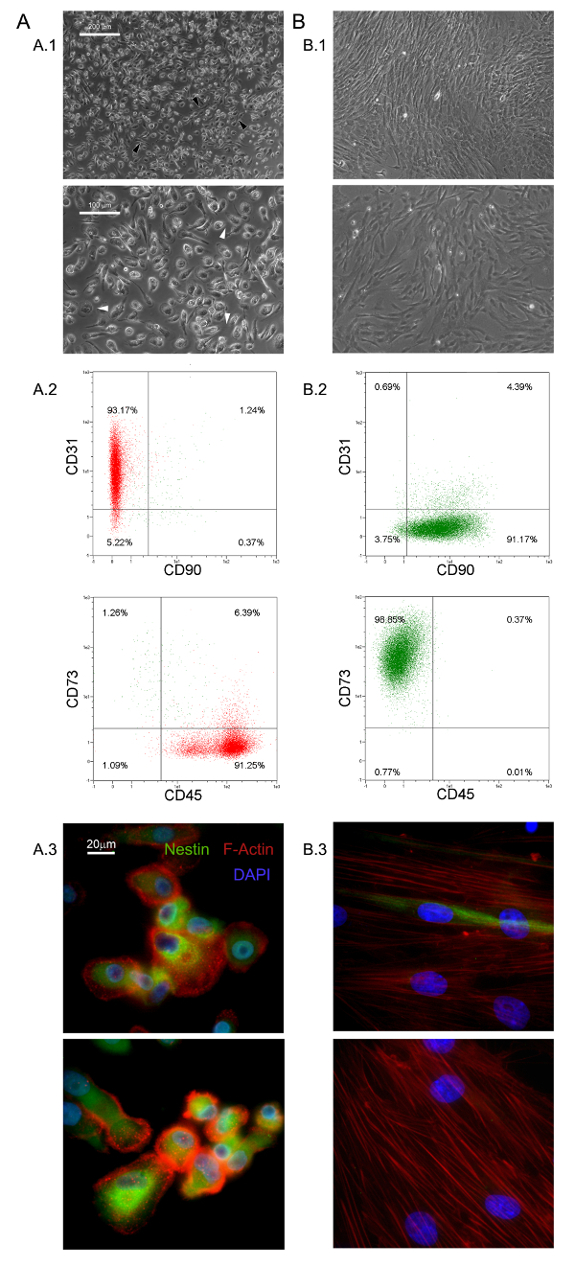
Figura 1. PPM appena isolate hanno caratteristiche distintive. Coltura HBM-multinazionali in DMEM / 10% PhABS per sette giorni dà luogo ad una popolazione di PPM quiescenti (A) facilmente distinguibili da MSC (B) in termini di morfologia (A.1, B.1, barre di scala = 100 micron), fenotipo (A.2, B.2), F-actina di distribuzione (rosso in A.3, B.3), e espressione nestina (verde in A.3, B.3, barre di scala = 20 micron). clicca qui per vedere una versione più grande di questa figura.
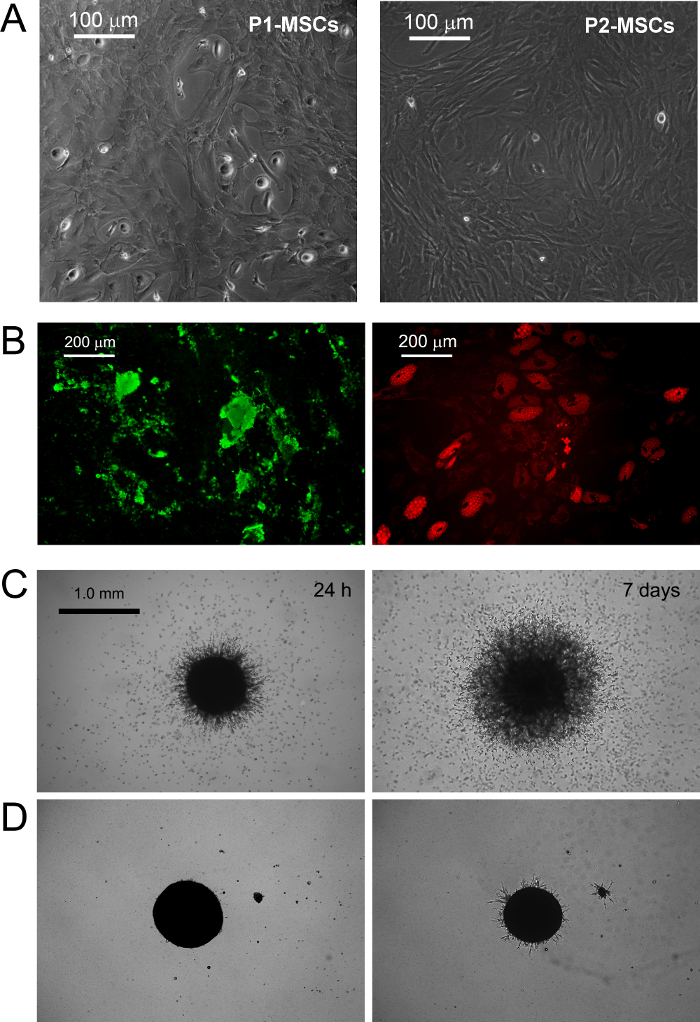
Figura 2. PPM differenziarsi in cellule staminali mesenchimali Standard e Visualizza Cavolo angiogenesi in vitro. La sostituzione di DMEM / PhABS con RS disponibili in commercio medio progettati per l'espansione MSC innesca l'induzione mesengenic di PPM. Dopo una settimana di cultura pochi PPM residui sono ancora rilevabili (P1-MSC), mentre un ulteriore passaggio in mezzo MSC-RS porta ad una popolazione di cellule confluenti MSC-simili (P2-MSC, A barre di scala = 100 micron). P2-MSC terminali differenziarsi in adipociti osteociti o sotto gli stimoli adeguati come rivelato da deposizione di calcio (verde in B) e accumulo di lipidi goccioline (rosso in B, barre di scala = 200 micron), rispettivamente. PPM mostrano germinazione coerente da sferoidi in gel di proteine ECM murina (C) ad una differenza con P2-MSC (D, barre di scala = 1,0 mm). Cliccate qui per vedere una versione più grande di questa figura.
Discussione
In the last decades, MSCs have been extensively researched and pre-clinically evaluated for possible application in the treatment of various bone/articular, immunological, neurological, cardiovascular, gastrointestinal and hematological disorders14,15. The easy and inexpensive isolation of multipotent MSCs, from many different tissues, together with their lack of significant immunogenicity16, contribute to make these cells one of the most interesting cell population to be applied in cell based therapies. Nonetheless, the very low frequency in the tissue of origin represents a great limitation to the MSCs application in clinics, forcing the expansion of these cells, in vitro, before the infusion or transplantation.
Expanded MSC cultures have revealed high grades of heterogeneity and variability17-19 making it difficult to reach a consensus about MSC production and characterization protocols. Moreover, recent investigations suggested the presence of multiple in vivo MSC ancestors in a wide range of tissues, which contribute to culture heterogeneity10,20. In fact, it has been proposed that particular culture conditions possibly select or simply promote specific sub-populations of MSCs progenitors present, in various percentages, in "crude" and unprocessed samples like bone marrow (hBM-MNCs) or adipose tissues (stromal vascular fraction)2. Thus, the variability in MSC-initiating cell populations together with the great number of different enrichment/isolation and culture protocols applied, represent a great obstacle to the definition of feasible MSC-based therapies.
A crucial factor affecting heterogeneity of MSC cultures is serum supplementation21. In our hands replacement of FBS with PhABS in primary cultures from hBM-MNCs, combined with high density seeding on hydrophobic plastics, led to the isolation of a novel highly adherent cell population with distinct biological features named MPCs5,6. We observed that the addition of small percentages of PhABS to FBS primary cultures also allowed MPC isolation, suggesting the presence of MPC inducing agents in the human serum6. At the moment, the MPC isolation/characterization protocol is a unique method available to obtain almost pure MPCs. The protocol has been carefully adjusted and it is highly reproducible for quality screening of MPC preparations before further applications.
MPCs could be used as a source for MSC production, thus limiting the variability introduced by use of unfractionated starting material. The precise definition of the multiple steps characterizing MPC mesengenic differentiation reported9 would allow synchronized mesenchymal cell expansion. Nonetheless, this latest condition could be realized exclusively applying highly purified MPC population, as a consequence the characterization of the cell products obtained by the protocol described here, results of crucial importance. This isolating method has been reported allowing MPC recovery with purity generally around 95%. However, donor/patient variability together with the variability related to the different batches of human pooled serum applied, could lead to a significant percentage of MSC-like cells co-isolated together with MPCs, under selective conditions.
It is not clear if these "contaminating" MSC-like cells could arise from the other different in vivo progenitors described in bone marrow22 or from uncontrolled and spontaneous MPC differentiation. In any case, a consistent percentage of MSC-like cells in the MPC products nullify the possibility to applying these cells as homogeneous starting material for the MSC expansion. Thus, here it has been suggested a simple and inexpensive method, based on the MPC resistance to trypsin digestion, increasing the purity of the MPC products. Similar or even better results in purifying MPC cultures could be achieved by fluorescent or magnetic cell sorting performing CD73 and/or CD90 depletion, but significantly prolonging the process time and increasing the costs.
Moreover, MPCs showed expression of pluripotency-associated markers and Nestin, all rapidly lost during mesengenic differentiation7. Sprouting assay revealed MPC ability to invade murine ECM protein gel. Taken together these results indicate that MPCs have to be considered a more immature progenitor, retaining angiogenic potential. Nonetheless, the initial enthusiasm about mesodermal differentiation potential of MPCs is actually waning. In fact, after more than 7 years of studies on MPCs, mesengenic and angiogenic potential have been extensively described5-9, but differentiation toward any other cells of mesodermal origin is still lacking. Thus, here we propose a new, and more rigorous, definition of these cells as "Mesangiogenic Progenitor Cells", maintaining the acronym MPCs.
We also believe that most controversies about MSC angiogenic potential could be related to the heterogeneous composition of expanded cultures consisting of sub-populations of MPCs and MSCs in variable percentages23.
Finally, MPCs could also play a crucial role for the implementation of CBMPs applicable for tissue reconstruction, as these cells could also support the neo-vascularization. In fact, future studies on regeneration should take in consideration that the newly formed tissue growth should be supported by concomitant neo-angiogenesis. The co-existence of mesengenic and angiogenic potential in MPCs could significantly improve the regeneration potential of new therapeutic approaches that involve these interesting cells.
Divulgazioni
The authors have no competing financial interests or other conflicts of interest.
Riconoscimenti
Gli autori desiderano ringraziare in particolare il Dr. Paolo Parchi, Dipartimento di Chirurgia, Medicina e Patologia Molecolare e Critical Care Medicine, Università di Pisa, per la fornitura di campioni di midollo osseo e la sua esperienza in osteo-progenitori umani
Materiali
| Name | Company | Catalog Number | Comments |
| Matrigel Basement Membrane Matrix | BD Bioscience (San Jose, CA-USA) | 354230 | Murine ECM proteins Stock Concentration: 100% (9 - 12 mg/ml) Final Concentration: 100% |
| Dulbecco's Phosphate-Buffered Saline (D-PBS) | Sigma (St. Louis, MO, USA) | D8537 | |
| 70 μm Filters | Miltenyi Biotec (BergischGladbach, Germany) | 130-095-823 | |
| Ficoll-Paque PREMIUM | GE Healthcare (Uppsala, Sweden) | 17-5442-03 | medium for discontinuos density gradient centrifugation |
| Pooled human AB type serum (PhABS) | LONZA (Walkersville MD-USA) | 14-490E | Final Concentration: 10% |
| Glutamax-I | ThermoFisher (Waltham, MA USA) | 35050-038 | Stabilized L-Glutamine Stock Concentration: 100x Final Concentration: 2 mM |
| Bovine Serum Albumin (BSA) | Sigma (St. Louis, MO, USA) | A8412 | Stock Concentration: 7.5% Final Concentration: 0.5% |
| Sodium Azide | Sigma (St. Louis, MO, USA) | S8032 | Final Concentration: 0.02% |
| Penicillin/Streptomycin (Pen Strep) | Gibco (Grand Island, NY, USA) | 15070-063 | Antibiotics Stock Concentration: 5,000 UI/ml penicillin, 5,000 μg/ml Streptomycin Final Concentration: 50 UI/ml penicillin, 50 μg/ml Streptomycin |
| T-75 culture flask for suspension cultures | Greiner Bio-one (Frickenhausen, Germany) | 658 190 | |
| T-75 culture flask TC treated | Greiner Bio-one (Frickenhausen, Germany) | 658170 | |
| TrypLE Select | ThermoFisher (Waltham, MA USA) | 12563-011 | Animal-free proteases detaching solution Stock Concentration: 1x Final Concentration: 1x |
| Trypsin/EDTA | ThermoFisher (Waltham, MA USA) | 15400-054 | Phenol red free Stock Concentration: 0.5% Final Concentration: 0.25% |
| anti-CD90 APC antibody (CD90) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-402 | Final Concentration: 1:40 |
| anti-CD45 APC-Vio770 antibody (CD45) | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-609 | Final Concentration: 1:40 |
| anti-CD73 PE antibody (CD73) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-182 | Final Concentration: 1:40 |
| anti-CD31 PE Vio-770 antibody (CD31) | MiltenyiBiotec (BergischGladbach, Germany) | 130-105-260 | Final Concentration: 1:40 |
| Mouse IgG1 APC antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-846 | Final Concentration: 1:40 |
| Mouse IgG2a APC Vio770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-637 | Final Concentration: 1:40 |
| Mouse IgG1 PE antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-845 | Final Concentration: 1:40 |
| Mouse IgG1 PE Vio-770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-563 | Final Concentration: 1:40 |
| Low Glucose Dulbecco's Modified Eagle Medium (DMEM) | ThermoFisher (Waltham, MA USA) | 13-1331-82 | Phenol red-free minimal essential medium Stock Concentration: 1,000 mg/L glucose |
| Fetal Bovine Serum (FBS) | ThermoFisher (Waltham, MA USA) | 10500 | Stock Concentration:0.2 mg/ml Final Concentration: 2 μg/ml |
| Prolong Gold antifade reagent with 4’,6-diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | P-36931 | Aqueous mounting medium + DAPI Final Concentration: 1x |
| Paraformaldehyde | Sigma (St. Louis, MO, USA) | P6148 | Fixative Final Concentration: 4% |
| LAB-TEK two-well chamber slides | Sigma (St. Louis, MO, USA) | C6682 | |
| Anti-Nestin antibody [clone 10C2] | Abcam (Cambridge, UK) | ab2035 | Stock Concentration: 1 mg/ml Final Concentration: 7 μg/ml |
| Alexa Fluor 555 Phalloidin | ThermoFisher (Waltham, MA USA) | A34055 | Stock Concentration: 200 UI/ml Final Concentration: 5 UI/ml |
| Triton X-100 | Euroclone (Milan, Italy) | EMR237500 | Final Concentration: 0.05% |
| MesenPRO RS Medium (MSC-RS medium) | ThermoFisher (Waltham, MA USA) | 12746-012 | |
| Alexa Fluor 488 anti-mouse SFX kit | ThermoFisher (Waltham, MA USA) | A31619 | Goat anti-mouse secondary antibody + Signal enhancer Stock Concentration: 2 mg/ml Final Concentration: 2 μg/ml |
| Pasteur Pipette | Kartell Labware (Noviglio (MI), ITALY ) | 329 | |
| StemMACS AdipoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-679 | |
| StemMACS OsteoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-678 | |
| Osteoimage Bone mineralization Assay | LONZA (Walkersville MD-USA) | PA-1503 | Hydroxyapatite specific fluorescent staining solution |
| 50 ml Polystyrene conical tube | Greiner bio-one (Kremsmünster Austria) | 227261 | |
| Nile Red | ThermoFisher (Waltham, MA USA) | N1142 | Fluorescent staining solution for lipids Stock Concentration: 100 mM Final Concentration: 200 Nm |
| Glycerin | Sigma (St. Louis, MO, USA) | G2289 | Final Concentration: 50% |
| Polistirene Petri dishes | Sigma (St. Louis, MO, USA) | P5606 | |
| 24-well plates TC-treated | Greiner Bio-one GmbH (Frickenhausen, Germany) | 662160 | |
| Endothelial Growth Medium, EGM-2 BulletKit (EGM-2) | LONZA (Walkersville MD-USA) | CC-3162 | VEGF-rich endothelial cell growth medium |
| Leica Qwin Image Analisys Software | Leica (Wetzlar, Germany) | Image analysis software |
Riferimenti
- Stoltz, J. F., et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015, 734731 (2015).
- Pacini, S. Deterministic and stochastic approaches in the clinical application of mesenchymal stromal cells (MSCs). Front Cell Dev Biol. 2, 50 (2014).
- Galvez, P., Clares, B., Hmadcha, A., Ruiz, A., Soria, B. Development of a cell-based medicinal product: regulatory structures in the European Union. Br Med Bull. 105, 85-105 (2013).
- Herberts, C. A., Kwa, M. S., Hermsen, H. P. Risk factors in the development of stem cell therapy. J Transl Med. 9, 29 (2011).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Pacini, S., et al. Constitutive expression of pluripotency-associated genes in mesodermal progenitor cells (MPCs). PLoS One. 5 (3), 9861 (2010).
- Pacini, S., et al. Specific integrin expression is associated with podosome-like structures on mesodermal progenitor cells. Stem Cells Dev. 22 (12), 1830-1838 (2013).
- Fazzi, R., et al. Mesodermal progenitor cells (MPCs) differentiate into mesenchymal stromal cells (MSCs) by activation of Wnt5/calmodulin signalling pathway. PLoS One. 6 (9), 25600 (2011).
- Tormin, A., et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood. 117 (19), 5067-5077 (2011).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Wang, Y. H., Liu, Y., Maye, P., Rowe, D. W. Examination of mineralized nodule formation in living osteoblastic cultures using fluorescent dyes. Biotechnol Prog. 22 (6), 1697-1701 (2006).
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7 (5), 393-395 (2005).
- Wang, S., Qu, X., Zhao, R. C. Clinical applications of mesenchymal stem cells. J Hematol Oncol. 5, 19 (2012).
- Si, Y. L., Zhao, Y. L., Hao, H. J., Fu, X. B., Han, W. D. MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Res Rev. 10 (1), 93-103 (2011).
- Le Blanc, K., Tammik, C., Rosendahl, K., Zetterberg, E., Ringden, O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 31 (10), 890-896 (2003).
- Phinney, D. G. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. 6 (23), 2884-2889 (2007).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Tolar, J., Le Blanc, K., Keating, A., Blazar, B. R. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 28 (8), 1446-1455 (2010).
- Corselli, M., et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 21 (8), 1299-1308 (2012).
- Bieback, K., et al. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. 27 (9), 2331-2341 (2009).
- Watson, L., Elliman, S. J., Coleman, C. M. From isolation to implantation: a concise review of mesenchymal stem cell therapy in bone fracture repair. Stem Cell Res Ther. 5 (2), 51 (2014).
- Pacini, S., Petrini, I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells. Front Cell Dev Biol. 2, 20 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon