Method Article
Isoler cellules progénitrices Mesangiogenic (PPM) de Human Bone Marrow
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Here we describe an optimized, highly reproducible protocol to isolate Mesodermal Progenitor Cells (MPCs) from human bone marrow (hBM). MPCs were characterized by flow cytometry and nestin expression. They showed the ability to give rise to exponentially growing MSC-like cell cultures while retaining their angiogenic potential.
Résumé
In a research study aimed to isolate human bone marrow (hBM)-derived Mesenchymal Stromal Cells (MSCs) for clinical applications, we identified a novel cell population specifically selected for growth in human serum supplemented medium. These cells are characterized by morphological, phenotypic, and molecular features distinct from MSCs and we named them Mesodermal Progenitor Cells (MPCs). MPCs are round, with a thick highly refringent core region; they show strong, trypsin resistant adherence to plastic. Failure to expand MPCs directly revealed that they are slow in cycling. This is as also suggested by Ki-67 negativity. On the other hand, culturing MPCs in standard medium designed for MSC expansion, gave rise to a population of exponentially growing MSC-like cells. Besides showing mesenchymal differentiation capacity MPCs retained angiogenic potential, confirming their multiple lineage progenitor nature. Here we describe an optimized highly reproducible protocol to isolate and characterize hBM-MPCs by flow cytometry (CD73, CD90, CD31, and CD45), nestin expression, and F-actin organization. Protocols for mesengenic and angiogenic differentiation of MPCs are also provided. Here we also suggest a more appropriate nomenclature for these cells, which has been re-named as "Mesangiogenic Progenitor Cells".
Introduction
Les cellules souches mésenchymateuses (CSM) ont une valeur clinique pertinente pour leur capacité de différenciation de lignées multiples et de leur capacité à soutenir l' hématopoïèse, pour sécréter des facteurs de croissance / cytokines , ainsi que pour jouer un rôle dans l' immunorégulation 1. Dans la définition de la production et de l' application à base de MSC thérapies cellulaire ont fait l'objet d' une vaste recherche clinique et pré-clinique 2, avec une attention particulière à la réglementation internationale spécifique pour la sécurité et l' efficacité de la cellule produit médicinal (CBMP) traitements 3 base. MSCs humaines sont largement cultivées dans des milieux contenant des suppléments et des réactifs d'origine animale, tel que le sérum fœtal bovin (FBS) et de la trypsine bovine. Par conséquent, aux côtés de risques infectieux associés à la manipulation des cellules, les patients sont également confrontés à prion exposition ainsi que les risques immunologiques liés à des protéines, des peptides ou d'autres biomolécules d'origine animale qui pourraient persister après la récolte de cellules et Transplantation 4.
Pour contourner le problème, nous avons cultivé l'os humain MSCs -derived dans un milieu exempt d'animaux de moelle (HBM), en remplacement de FBS avec humain regroupé type AB sérum (PhABS). Dans ces conditions, aux côtés de MSCs croissance, nous avons identifié une nouvelle population de cellules. Ces cellules sont morphologiquement et phénotypique différent de MSCs et ont montré un profil d'expression des gènes distinctifs ainsi que les propriétés caractéristiques culture / adhérence. Ils conservaient les deux cellules mesengenic et le potentiel angiogéniques et ont donc été nommés mésodermique progénitrices (PPM) 5. Par la suite, nous avons été en mesure de définir les conditions de culture sélective et reproductibles pour générer au PPM haute qualité de pureté 6.
Nous avons également étudié les propriétés morphologiques et biologiques des PPM. Les PPM ont montré être nestine positif, lent dans le cyclisme, Ki-67-négatif, et avec des chromosomes caractérisés par de longs télomères 5. Ils ont exprimé plurFacteurs de transcription ipotency associé MSC principaux régulateurs Runx2 et Sox9 7 octobre-4 et Nanog plutôt que. Phénotypique, PPMs exprimé endogline (CD105) au niveau inférieur à MSCs tout en manquant des marqueurs mésenchymateuses CD73, CD90, CD166. PPM a également montré un motif distinctif de molécules d'adhésion caractérisés par l' expression cohérente de PECAM (CD31), intégrines αL (CD11a), aM (CD11b), aX (CD11c) ainsi que β2 intégrine (CD18) qui soutient spécifiquement les structures podosomes-like 8 . Dans les médias de l' expansion de MSC standard, PPM différencié rapidement en MSCs par une étape intermédiaire , avec l'activation de Wnt5 / calmoduline signalisation cellulaire 9. PPM a également conservé des propriétés angiogéniques, comme l'a démontré leur capacité à germer à partir de sphéroïdes dans murins matrice extracellulaire (ECM) cultures protéines 3D. Le potentiel angiogénique a été rapidement perdu après différenciation MPC le long de la lignée mesengenic.
Nous présentons ici protocols optimisés pour isoler et caractériser PPMs hautement purifiés à partir d'échantillons de sang HBM. protocoles reproductibles pour MPC mesengenic et la différenciation angiogéniques sont également décrits.
Protocole
NOTE: Après consentement écrit, des échantillons HBM ont été obtenus au cours de la chirurgie orthopédique pour le remplacement de la hanche. Immédiatement après l'ostéotomie du col du fémur et du fémur avant aléser une seringue de 20 ml contenant 500 UI d'héparine, a été utilisée pour aspirer le BM frais. Le protocole doit être considéré comme largement applicable à toute source BM.
1. Isolement de l'os humain de cellules de moelle osseuse mononucléaires (HBM-PTM)
- Diluer 5 - 10 ml de BM frais de 50 ml, en appliquant la solution saline tamponnée au phosphate de Dulbecco (D-PBS) et on mélange par inversion. répartir également 25 ml dans deux nouveaux tubes coniques de 50 ml, ajouter 25 ml de D-PBS à chaque tube et mélanger par retournement.
- Laisser les tubes reposer pendant 10 min à température ambiante, pour la séparation de fragments d'os minéraux et de matières grasses de la solution.
- Retirez délicatement la graisse flottante avec une pipette et filtre Pasteur suspension cellulaire stérile à travers 70 um filtres sans perturber l'os minéral fragment pellet.
- Ensemble de quatre tubes de 50 ml avec 15 ml de milieu à gradient discontinu de densité de centrifugation (1,077 g / ml). Assurez-vous que ce milieu est à la température ambiante.
- Déposer délicatement 20 - 25 ml de dilution BM au-dessus du milieu de gradient de densité. Effectuez cette opération avec soin, laissant suspension cellulaire filet sur les parois du tube pour empêcher les couches de mélange.
- Effectuer un gradient de densité centrifugation à 400 xg pendant 30 min à température ambiante avec frein désactivé.
- Récupérer la bague blanchâtre de cellules situées entre les deux phases à l'aide d'une pipette Pasteur stérile et le transférer dans un nouveau tube de 50 ml.
- Laver les cellules avec un milieu de culture frais: rouge de phénol libre, faible taux de glucose (1,000 mg / l) milieu de Eagle modifié Dulbecco (DMEM), 10% (v / v) mise en commun de type AB sérum humain (PhABS), 2 mM de L-glutamine et des antibiotiques (DMEM / 10% PhABS). Centrifuger à 400 g pendant 5 min.
- Aspirer le surnageant et remettre en suspension le culot dans 5 à 10 ml de DMEM frais / 10% PhABS.
- Passez à la numération cellulaire.Déterminer le nombre de globules blancs par dilution 1: 1 en trypan. Appliquer à l'hémocytomètre, et observer sous microscope à contraste de phase. Exclure les petites et parfaitement arrondis érythrocytes et les cellules mortes colorées en bleu de la numération cellulaire.
NOTE: Il est fortement recommandé de PhABS écran lots pour leur performance dans la récupération MPC. PhABS provenant de sources USA ont donné de meilleurs résultats alors que la plupart des sérums d'origine différente a donné lieu à des cultures MPC avec des pourcentages plus élevés de cellules MSC-like.
2. Isolement des PPM de HBM-PTM
- Fixer hydrophobes flacons T-75 avec 15 ml de DMEM frais / 10% PhABS et laisser le pH et la température équilibrent par une pré-incubation à 37 ° C dans 5% de CO2 pendant 30 min.
- Seed 4-6 x 10 7 HBM-MNC par flacon et incuber à 37 ° C dans 5% de CO 2 pendant 48 heures.
- Aspirer et jeter les cellules moyennes et non-adhérentes des flacons. Ajouter 15 ml de DMEM frais / 10% PhABS et incuber à 37 ° Cà 5% de CO 2. Maintenir les cultures pour 6 - 8 jours, le changement moyen toutes les 48 heures.
EN OPTION: Pour augmenter le rendement MPC, les cellules non-adhérentes de 2.3 pourraient être ré-étalées dans un nouveau flacon de culture et maintenus comme décrit pour les cultures primaires. - Aspirer et jeter milieu des flacons, laver avec du DMEM frais et ajouter 2 ml d'animaux protéase libre solution détachant. Incuber à 37 ° C pendant 5 - 15 min (éviter une incubation prolongée).
- Ajouter 10 ml de DMEM frais / 10% PhABS, aspirer la suspension cellulaire et centrifuger à 400 g pendant 5 min
- Aspirer et éliminer le surnageant et remettre en suspension le culot dans 1 - 2 ml de DMEM frais / 10% PhABS. Passez à nombre de cellules comme décrit à l'étape 1.10.
NOTE: Ne pas utiliser de trypsine / EDTA comme détachant réactif. PPMs sont trypsine résistants. le dépistage morphologique des cultures, avant la récolte des cellules, est fortement recommandée afin d'évaluer la présence de cellules MSC-like en forme de fuseau. En cas quantité considérable de cellules MSC-like sont detected, d'augmenter la pureté du produit cellulaire en éliminant sélectivement les cellules contaminées. Pour ce faire, digestion par la trypsine peut être réalisée avant la récolte MPC, en ajoutant 2 ml de trypsine / EDTA 0,05% pendant 2 min. cultures Laver deux fois avec 5 ml de DMEM / 10% PhABS, puis procéder à la protéase traitement comme ci-dessus.
3. Cellule Caractérisation
- La cytométrie en flux
- Mettre en place des échantillons en double de 10 5 cellules fraîchement isolées dans la solution de lavage: D-PBS additionné de 0,5% (v / v) de sérum - albumine bovine (BSA) et 0,02% (p / v) d' azoture de sodium. Centrifuger à 400 g pendant 5 min.
ATTENTION: L' azoture de sodium est toxique. - Remettre en suspension des pastilles dans 200 ul de solution de lavage et ajouter de l'anti-CD90, anti-CD45, anti-CD73 et anti-CD31 des anticorps conjugués avec des colorants fluorescents ( «TEST»); en parallèle mis en place des contrôles isotypiques ( "CTRL").
NOTE: Les quantités de coloration des anticorps doivent être déterminés par titrage ou according aux instructions du fabricant. - Incuber les échantillons à 4 ° C pendant 30 min.
- Centrifuger à 400 g pendant 5 min. Resuspendre les cellules dans 500 ul de solution de lavage et l' acquisition d' au moins 5 x 10 4 sur le flux des événements multicolore cytomètre 7 9 10.
- Analyser les résultats par point-parcelles et utiliser "CTRL" événements enregistrés pour définir quadrants.
NOTE: Afin de définir la culture comme la culture MPC le pourcentage de CD73 CD90 neg neg CD45 + CD31 + cellules devrait être supérieure à 95%. Pour certaines applications spécifiques, par exemple une analyse d'expression génique, la reprise de coupure doit être augmenté à 97-98%.
- Mettre en place des échantillons en double de 10 5 cellules fraîchement isolées dans la solution de lavage: D-PBS additionné de 0,5% (v / v) de sérum - albumine bovine (BSA) et 0,02% (p / v) d' azoture de sodium. Centrifuger à 400 g pendant 5 min.
- détection Nestin et F-actine analyse de l'organisation
- Plate PPMs fraîchement isolés sur des lames de la chambre de culture (20 000 / cm 2). Permettre aux cellules d'adhérer par une incubation pendant une nuit à 37 ° C dans 5% de CO2.
- Laver les cellules dans une solution de lavage et de fix dans 4% (p / v) de para-formaldéhyde à la température ambiante pendant 15 min. Pour supprimer fixateur ajouter la solution de lavage, incuber pendant 2 min et versez.
- Répéter deux fois le lavage.
- Perméabiliser les cellules dans D-PBS additionné de 0,05% (v / v) de Triton X-100 pendant 15 min à température ambiante.
- Arrêter la réaction en protéine libre amplificateur de signal (30 min à température ambiante) ou d'une solution de blocage standard (D-PBS additionné de 3% (p / v) de BSA).
- Retirer le signal activateur / solution de blocage.
- Ajouter 7 pg / ml (p / v) de l'anticorps primaire anti-humain de la nestine et incuber à 4 ° C pendant une nuit dans une chambre humidifiée. En parallèle, utiliser des anticorps de contrôle isotypiques pour évaluer les signaux de fluorescence non spécifiques.
- Laver les lames en ajoutant D-PBS, laisser pendant 2 minutes et verser. Répéter deux fois.
- Ajouter 2 pg / ml (p / v) de colorant fluorescent, un anticorps secondaire conjugué et on incube à 4 ° C pendant 1 heure dans l'obscurité.
- Laver les lames comme ci-dessus.
- Ajouter phalloïdine fluorescente (5 UI / ml), laisser à température ambiante pendant 30 mdans dans l'obscurité et laver 3 fois dans D-PBS.
- Retirer les parois de la chambre et monter les diapositives dans un milieu de montage aqueux additionné de antifade réactif et 4 ', 6-diamidino-2-phénylindole (DAPI) pour la détection des noyaux. Passez à l' imagerie 7 9 10.
4. Mesengenic Différenciation des PPM
- Planche 2 x 10 4 / cm 2 PPMs fraîchement isolés dans TC-traités T75 flacons de culture et laisser les cellules adhérer pendant une nuit dans DMEM / 10% PhABS à 37 ° C dans 5% de CO 2.
- Remplacer le milieu DMEM / 10% PhABS avec un milieu standard de sérum réduit, d' environ 200 pl / cm 2, conçu pour l' expansion des cellules mésenchymateuses du stroma (milieu CSM-RS). Cultiver les cellules jusqu'à la confluence (P1-MSCs), généralement de 7 à 10 jours à compter de l'induction. Actualisez moyenne tous les 2 jours.
- Aspirer et jeter milieu des flacons, se laver avec du milieu MSC-RS fraîche et ajouter 2 ml d'animaux protéase libre solution détachant. Incuber à 3776; C pendant 5 - 15 min (éviter une incubation prolongée).
- Ajouter 10 ml de milieu MSC-RS fraîche, aspirer la suspension cellulaire et centrifuger à 400 g pendant 5 min
- Aspirer le surnageant et remettre en suspension le culot dans 1 - 2 ml de milieu MSC-RS frais. Passez à nombre de cellules comme décrit à l'étape 1.10
- Passez à la sous-culture par ensemencement les 3-5 x 10 3 cellules / cm 2. Cultiver les cellules jusqu'à la confluence (P2-MSCs).
- cellules de récolte par protease digestion comme décrit à l'étape 4.3 à l'étape 4.5 et de procéder à la caractérisation comme décrit dans la section 3.
REMARQUE: Un pourcentage de CD73 + CD90 + CD45 des cellules CD31 nég nég inférieure à 95% indique que la différenciation partielle et exiger un nouveau passage en culture. - Plate P2-MSCs à 2 x 10 4 / cm 2 dans six plaques et TC-traitées et de croître jusqu'à la confluence dans un milieu MSC-RS.
- Marquer deux puits comme "No Diff" et actualisez moyen MSC-RS.
- Mark deux biens comme «ostéo» et remplacer moyenne avec 200 pl / cm 2 de milieu osteogene standard, spécialement conçu pour la différenciation MSC.
- Marquer deux puits comme "Adipo" et remplacer moyenne avec 200 pl / cm 2 de milieu adipogénique standard, spécialement conçu pour la différenciation MSC.
- Maintenir les cultures à 37 ° C dans 5% de CO 2 en changeant l'ensemble des supports 48 par heure.
NOTE: Il est fortement recommandé d'utiliser les médias de différenciation standards disponibles dans le commerce pour la reproductibilité du test. Après 2/3 semaines dans des conditions de différenciation, les dépôts de calcium apparaissent dans ostéogéniques induit des cultures, tandis que des gouttelettes lipidiques intracellulaires accumulation est évident dans les cellules adipogènes induite. - Aspirer et jeter les milieux de culture, puis laver avec du D-PBS.
- Fixer les cultures en ajoutant 1 ml de 4% (p / v) de paraformaldehyde pendant 15 minutes à température ambiante.
- Pour supprimer fixateur ajouter D-PBS, incuber pendant 2 min et versez. Répétez le lavagedeux fois.
- Colorer un "No Diff" en même temps que les deux «ostéo» marqué puits dans une solution fluorescente spécifique hydroxyapatite et un "No Diff" avec les deux "Adipo" marqué puits dans 200 nM solution rouge Nil. Incuber pendant 30 min à température ambiante , 11,12.
- Retirer la coloration des solutions et laver dans D-PBS deux fois.
- Retirer du D-PBS, ajouter du D-PBS supplémenté avec 50% (v / v) de glycérine et de procéder à l' imagerie 7 9 10.
5. MPC Spheroid Germination Assay
- Pour produire sphéroïdes 3D, poser des gouttes de 20 pi de suspension fraîchement isolés de MPC (1,5 x 10 4 cellules / goutte) sur la surface intérieure d'un plat couvercle Petri.
NOTE: Comme des gouttes de manipulation pourraient conduire à leur rupture, il est fortement recommandé de les poser en excès. - utiliser avec précaution le couvercle pour récapituler une boîte de Pétri contenant du D-PBS pour empêcher la pendaison chute évaporation. Incuber à 37 ° C dans 5% de CO 2la nuit pour permettre aux cellules d'agréger en sphéroïdes 3D.
- Définir un gel épais de protéines murines matrice extracellulaire (ECM) en ajoutant 300 uL d'aliquotes de protéines d'ECM standards dans une plaque de pré-réfrigérée culture à 24 puits et incuber à 37 ° C pendant 30 min.
- Basculez avec précaution sur le plat couvercle Petri et ramasser doucement les sphéroïdes à l'aide d'une pipette Pasteur stérile.
- Déposer sphéroïdes sur le gel de protéine d'ECM, ajouter 700 ul de parties aliquotes de milieu de croissance endothélial cellulaire VEGF riche standard et laisser incuber à 37 ° C dans 5% de CO2.
- Après 24 heures et à 7 jours de culture, prendre des photos des cultures 3D à 4X puissance de grossissement. Évaluer la germination de sphéroïdes appliquant un logiciel d'analyse d'image en mesurant la distance radiale entre la dernière cellule d'invasion et le bord sphéroïde. mesures répétées le long d'au moins 20 directions différentes. la distance moyenne est considéré comme positif lorsque 50 um ou plus.
Résultats
Les conditions de culture sélective décrites ici ont permis l'isolement d'une nouvelle population de cellules adhérentes et presque monomorphe que 1,0% de la HBM-MNC (0,5 - 2,0 x 10 6 HBM-SMN de 5 - 10 ml d'échantillons BM frais) 5,6 . Nous avons identifié ces grands (40 - 60 m de diamètre), arrondie, les cellules au repos, Ki-67-négatives PPM 5. Morphologiquement, ils sont caractérisés par un oeuf-forme distinctive frit avec une région centrale épaisse entourée d'une périphérie mince plat montrant beaucoup de filopodes à une puissance de grossissement (flèches blanches sur la figure 1 A.1). Allongement polaire de la limite externe de la cellule est souvent observée (flèches noires sur la figure 1 A.1). Une telle morphologie est clairement différente de l'apparence mésenchymateuses de cellules stromales fusiforme typique rapportée dans des cultures de MSC standards. Cytométrie de flux a montré plus de 95% des PPM fraîchement isolés pour exprimer CD31 et CD45 en mmarqueurs associés de esenchymal CD90 et CD73 13 étaient indétectables (Figure 1 A.2). Nous considérons cet ensemble restreint de quatre antigènes comme indicatif pour les PPM. D' autres caractéristiques distinctives des PPM sont en pointillés distribution F-actine révélant un certain nombre de structures de podosomes-like (rouge dans la figure 1 A.3) et l' expression intense de nestine (vert sur la figure 1 A.3), qui est détecté dans les cellules coloré avec l'anticorps témoin isotypique (données non présentées).
PPMs culture dans standard RS moyen conçu pour obtenir des résultats d'expansion MSC dans la différenciation rapide dans les cellules MSC-like en croissance exponentielle (Figure 1 B.1). Après deux passages cellules finalement passer leur phénotype de CD73 neg neg CD90 CD45 + CD31 + CD73 + CD90 à + CD45 neg neg CD31 (Figure 1 B.2). Dans le processus, PPMs re-organize F-actine en fibres de stress alors que l' expression de la nestine devient limitée à quelques rares cellules (Figure 1 B.3). MPC différenciation mesengenic en un phénotype MSC comme défini se produit par deux étapes distinctes révélées par différentes morphologies cellulaires. Après une semaine en milieu MSC RS une population résiduelle de cellules MPC-like est encore détectable dans une couche confluente de plat, des cellules multibranchées polygonales (P1-MSCs dans la Figure 2 A). Un autre passage est nécessaire pour obtenir une culture presque monomorphe de cellules MSC comme la broche en forme (P2-MSCs dans la Figure 2 A). Ces cellules en croissance exponentielle peuvent facilement se différencier en ostéoblastes ou adipocytes lorsqu'ils sont transférés dans des milieux sélectifs pendant au moins 2 semaines, confirmant ainsi leur MSC nature. Dans ostéogéniques induite cultures, les dépôts de calcium peuvent être détectés par l' une tache Alizarine-S colorimétriques ou des colorants fluorescents spécifiques (vert dans la figure 2 B). Après que les cellules d'induction adipogéniquesmontrer gouttelette lipidique accumulation comme l'a révélé soit colorimétriques Oil Red ou fluorescent rouge Nil tache (rouge dans la figure 2 B).
MPC typage a été confirmée par la germination dosage de l'angiogenèse. PM ont montré leur capacité d'envahir (plus de 50 pm) de gel de protéine d'ECM sphéroïdes de souris 3D après 24 h VEGF-stimulus (figure 2 C). Après que les cellules envahissant d'une semaine ont été détectés à 300-600 um de distance. A l' inverse, la capacité d'invasion a été perdu dans P2-après différenciation des MSC mesengenic (figure 2 D).
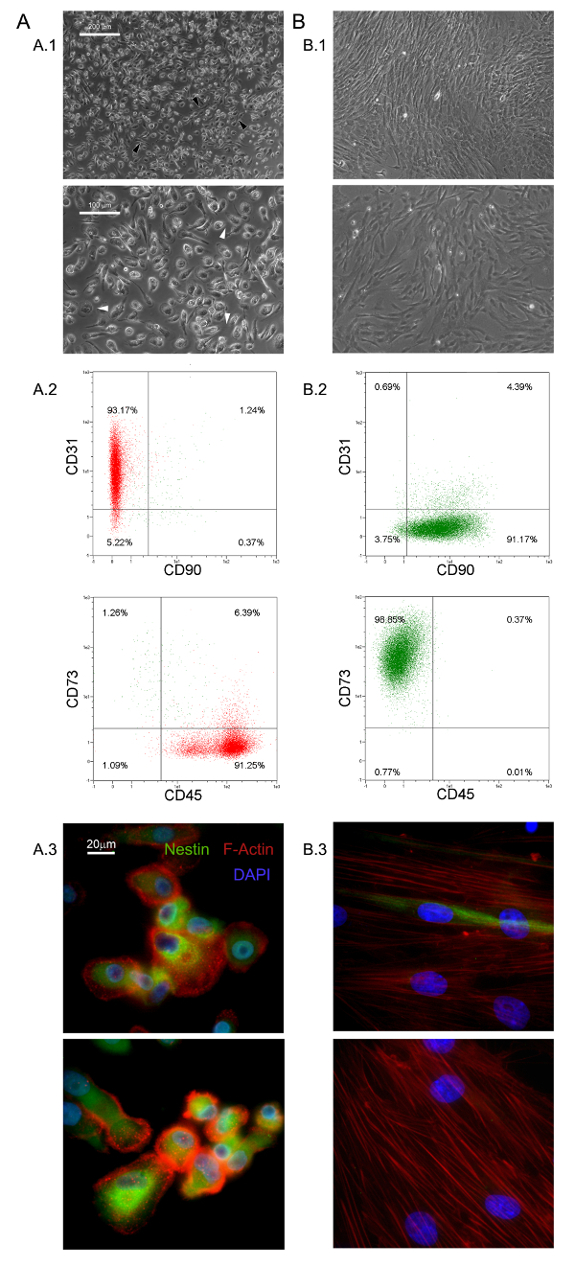
Figure 1. PPMs fraîchement isolés ont des caractéristiques distinctives. La culture HBM-MNC dans DMEM / 10% PhABS pendant sept jours donne lieu à une population de PPM de repos (A) facilement distinguables de MSCs (B) en termes de morphologie (A.1, B.1, barres d'échelle = 100 um), phénotype (A.2, B.2), F-actine de distribution (rouge en A.3, B.3), et expression de la nestine (vert en A.3, B.3, barres d'échelle = 20 pm). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
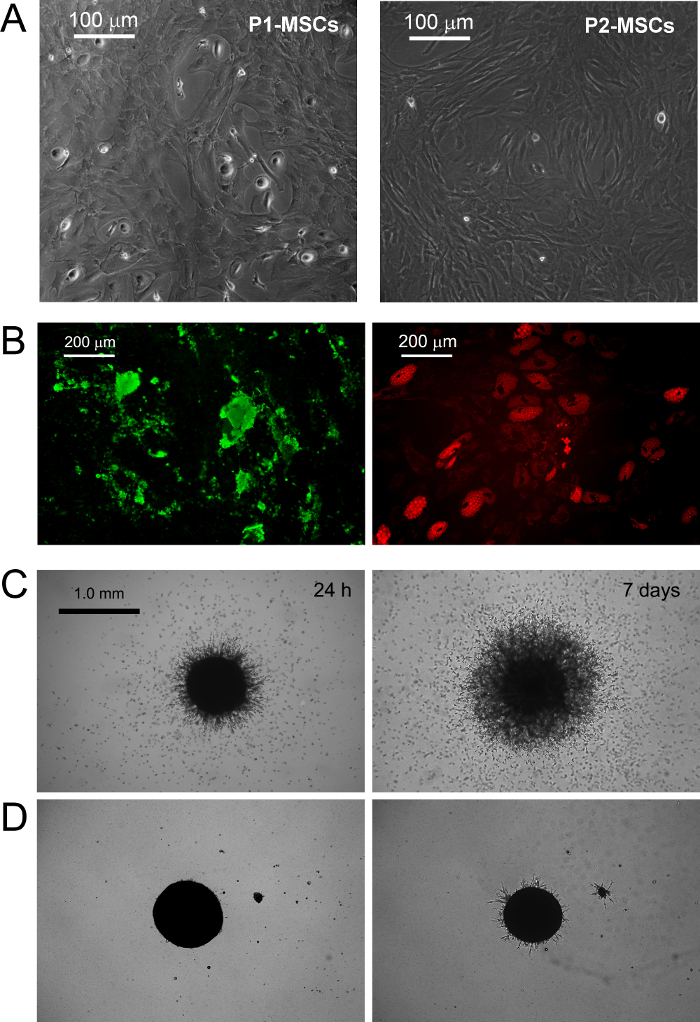
Figure 2. PPMs Différencier en MSCs standard et Afficher Germination angiogenèse in vitro. Le remplacement de DMEM / PhABS avec RS disponibles dans le commerce à moyen conçu pour l' expansion MSC déclenche l' induction mesengenic des PPM. Après une semaine en culture quelques PM résiduels sont encore détectables (P1-MSC) , tandis qu'un autre passage dans du milieu CSM-RS conduit à une population de cellules confluentes MSC-like (P2 MSCs, A barres d'échelle = 100 um). P2-MSCs différencier en ostéocytes terminale ou adipocytes sous des stimuli appropriés comme révélé par le dépôt de calcium (vert B) et de l' accumulation de lipides de gouttelettes (rouge B, barres d'échelle = 200 um), respectivement. PPMs montrent la germination cohérente de sphéroïdes en gel de protéine de ECM murin (C) à une différence avec P2-MSCs (D, barres d'échelle = 1,0 mm). S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
In the last decades, MSCs have been extensively researched and pre-clinically evaluated for possible application in the treatment of various bone/articular, immunological, neurological, cardiovascular, gastrointestinal and hematological disorders14,15. The easy and inexpensive isolation of multipotent MSCs, from many different tissues, together with their lack of significant immunogenicity16, contribute to make these cells one of the most interesting cell population to be applied in cell based therapies. Nonetheless, the very low frequency in the tissue of origin represents a great limitation to the MSCs application in clinics, forcing the expansion of these cells, in vitro, before the infusion or transplantation.
Expanded MSC cultures have revealed high grades of heterogeneity and variability17-19 making it difficult to reach a consensus about MSC production and characterization protocols. Moreover, recent investigations suggested the presence of multiple in vivo MSC ancestors in a wide range of tissues, which contribute to culture heterogeneity10,20. In fact, it has been proposed that particular culture conditions possibly select or simply promote specific sub-populations of MSCs progenitors present, in various percentages, in "crude" and unprocessed samples like bone marrow (hBM-MNCs) or adipose tissues (stromal vascular fraction)2. Thus, the variability in MSC-initiating cell populations together with the great number of different enrichment/isolation and culture protocols applied, represent a great obstacle to the definition of feasible MSC-based therapies.
A crucial factor affecting heterogeneity of MSC cultures is serum supplementation21. In our hands replacement of FBS with PhABS in primary cultures from hBM-MNCs, combined with high density seeding on hydrophobic plastics, led to the isolation of a novel highly adherent cell population with distinct biological features named MPCs5,6. We observed that the addition of small percentages of PhABS to FBS primary cultures also allowed MPC isolation, suggesting the presence of MPC inducing agents in the human serum6. At the moment, the MPC isolation/characterization protocol is a unique method available to obtain almost pure MPCs. The protocol has been carefully adjusted and it is highly reproducible for quality screening of MPC preparations before further applications.
MPCs could be used as a source for MSC production, thus limiting the variability introduced by use of unfractionated starting material. The precise definition of the multiple steps characterizing MPC mesengenic differentiation reported9 would allow synchronized mesenchymal cell expansion. Nonetheless, this latest condition could be realized exclusively applying highly purified MPC population, as a consequence the characterization of the cell products obtained by the protocol described here, results of crucial importance. This isolating method has been reported allowing MPC recovery with purity generally around 95%. However, donor/patient variability together with the variability related to the different batches of human pooled serum applied, could lead to a significant percentage of MSC-like cells co-isolated together with MPCs, under selective conditions.
It is not clear if these "contaminating" MSC-like cells could arise from the other different in vivo progenitors described in bone marrow22 or from uncontrolled and spontaneous MPC differentiation. In any case, a consistent percentage of MSC-like cells in the MPC products nullify the possibility to applying these cells as homogeneous starting material for the MSC expansion. Thus, here it has been suggested a simple and inexpensive method, based on the MPC resistance to trypsin digestion, increasing the purity of the MPC products. Similar or even better results in purifying MPC cultures could be achieved by fluorescent or magnetic cell sorting performing CD73 and/or CD90 depletion, but significantly prolonging the process time and increasing the costs.
Moreover, MPCs showed expression of pluripotency-associated markers and Nestin, all rapidly lost during mesengenic differentiation7. Sprouting assay revealed MPC ability to invade murine ECM protein gel. Taken together these results indicate that MPCs have to be considered a more immature progenitor, retaining angiogenic potential. Nonetheless, the initial enthusiasm about mesodermal differentiation potential of MPCs is actually waning. In fact, after more than 7 years of studies on MPCs, mesengenic and angiogenic potential have been extensively described5-9, but differentiation toward any other cells of mesodermal origin is still lacking. Thus, here we propose a new, and more rigorous, definition of these cells as "Mesangiogenic Progenitor Cells", maintaining the acronym MPCs.
We also believe that most controversies about MSC angiogenic potential could be related to the heterogeneous composition of expanded cultures consisting of sub-populations of MPCs and MSCs in variable percentages23.
Finally, MPCs could also play a crucial role for the implementation of CBMPs applicable for tissue reconstruction, as these cells could also support the neo-vascularization. In fact, future studies on regeneration should take in consideration that the newly formed tissue growth should be supported by concomitant neo-angiogenesis. The co-existence of mesengenic and angiogenic potential in MPCs could significantly improve the regeneration potential of new therapeutic approaches that involve these interesting cells.
Déclarations de divulgation
The authors have no competing financial interests or other conflicts of interest.
Remerciements
Les auteurs seraient particulièrement à remercier le Dr Paolo Parchi, département de chirurgie, de médecine et de pathologie moléculaire et Critical Care Medicine, Université de Pise, pour fournir des échantillons de moelle osseuse et son expertise en ostéo-progéniteurs humains
matériels
| Name | Company | Catalog Number | Comments |
| Matrigel Basement Membrane Matrix | BD Bioscience (San Jose, CA-USA) | 354230 | Murine ECM proteins Stock Concentration: 100% (9 - 12 mg/ml) Final Concentration: 100% |
| Dulbecco's Phosphate-Buffered Saline (D-PBS) | Sigma (St. Louis, MO, USA) | D8537 | |
| 70 μm Filters | Miltenyi Biotec (BergischGladbach, Germany) | 130-095-823 | |
| Ficoll-Paque PREMIUM | GE Healthcare (Uppsala, Sweden) | 17-5442-03 | medium for discontinuos density gradient centrifugation |
| Pooled human AB type serum (PhABS) | LONZA (Walkersville MD-USA) | 14-490E | Final Concentration: 10% |
| Glutamax-I | ThermoFisher (Waltham, MA USA) | 35050-038 | Stabilized L-Glutamine Stock Concentration: 100x Final Concentration: 2 mM |
| Bovine Serum Albumin (BSA) | Sigma (St. Louis, MO, USA) | A8412 | Stock Concentration: 7.5% Final Concentration: 0.5% |
| Sodium Azide | Sigma (St. Louis, MO, USA) | S8032 | Final Concentration: 0.02% |
| Penicillin/Streptomycin (Pen Strep) | Gibco (Grand Island, NY, USA) | 15070-063 | Antibiotics Stock Concentration: 5,000 UI/ml penicillin, 5,000 μg/ml Streptomycin Final Concentration: 50 UI/ml penicillin, 50 μg/ml Streptomycin |
| T-75 culture flask for suspension cultures | Greiner Bio-one (Frickenhausen, Germany) | 658 190 | |
| T-75 culture flask TC treated | Greiner Bio-one (Frickenhausen, Germany) | 658170 | |
| TrypLE Select | ThermoFisher (Waltham, MA USA) | 12563-011 | Animal-free proteases detaching solution Stock Concentration: 1x Final Concentration: 1x |
| Trypsin/EDTA | ThermoFisher (Waltham, MA USA) | 15400-054 | Phenol red free Stock Concentration: 0.5% Final Concentration: 0.25% |
| anti-CD90 APC antibody (CD90) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-402 | Final Concentration: 1:40 |
| anti-CD45 APC-Vio770 antibody (CD45) | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-609 | Final Concentration: 1:40 |
| anti-CD73 PE antibody (CD73) | MiltenyiBiotec (BergischGladbach, Germany) | 130-095-182 | Final Concentration: 1:40 |
| anti-CD31 PE Vio-770 antibody (CD31) | MiltenyiBiotec (BergischGladbach, Germany) | 130-105-260 | Final Concentration: 1:40 |
| Mouse IgG1 APC antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-846 | Final Concentration: 1:40 |
| Mouse IgG2a APC Vio770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-096-637 | Final Concentration: 1:40 |
| Mouse IgG1 PE antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-845 | Final Concentration: 1:40 |
| Mouse IgG1 PE Vio-770 antibody | MiltenyiBiotec (BergischGladbach, Germany) | 130-098-563 | Final Concentration: 1:40 |
| Low Glucose Dulbecco's Modified Eagle Medium (DMEM) | ThermoFisher (Waltham, MA USA) | 13-1331-82 | Phenol red-free minimal essential medium Stock Concentration: 1,000 mg/L glucose |
| Fetal Bovine Serum (FBS) | ThermoFisher (Waltham, MA USA) | 10500 | Stock Concentration:0.2 mg/ml Final Concentration: 2 μg/ml |
| Prolong Gold antifade reagent with 4’,6-diamidino-2-phenylindole | Invitrogen (Waltham, MA, USA) | P-36931 | Aqueous mounting medium + DAPI Final Concentration: 1x |
| Paraformaldehyde | Sigma (St. Louis, MO, USA) | P6148 | Fixative Final Concentration: 4% |
| LAB-TEK two-well chamber slides | Sigma (St. Louis, MO, USA) | C6682 | |
| Anti-Nestin antibody [clone 10C2] | Abcam (Cambridge, UK) | ab2035 | Stock Concentration: 1 mg/ml Final Concentration: 7 μg/ml |
| Alexa Fluor 555 Phalloidin | ThermoFisher (Waltham, MA USA) | A34055 | Stock Concentration: 200 UI/ml Final Concentration: 5 UI/ml |
| Triton X-100 | Euroclone (Milan, Italy) | EMR237500 | Final Concentration: 0.05% |
| MesenPRO RS Medium (MSC-RS medium) | ThermoFisher (Waltham, MA USA) | 12746-012 | |
| Alexa Fluor 488 anti-mouse SFX kit | ThermoFisher (Waltham, MA USA) | A31619 | Goat anti-mouse secondary antibody + Signal enhancer Stock Concentration: 2 mg/ml Final Concentration: 2 μg/ml |
| Pasteur Pipette | Kartell Labware (Noviglio (MI), ITALY ) | 329 | |
| StemMACS AdipoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-679 | |
| StemMACS OsteoDiff Media | MiltenyiBiotec (BergischGladbach, Germany) | 130-091-678 | |
| Osteoimage Bone mineralization Assay | LONZA (Walkersville MD-USA) | PA-1503 | Hydroxyapatite specific fluorescent staining solution |
| 50 ml Polystyrene conical tube | Greiner bio-one (Kremsmünster Austria) | 227261 | |
| Nile Red | ThermoFisher (Waltham, MA USA) | N1142 | Fluorescent staining solution for lipids Stock Concentration: 100 mM Final Concentration: 200 Nm |
| Glycerin | Sigma (St. Louis, MO, USA) | G2289 | Final Concentration: 50% |
| Polistirene Petri dishes | Sigma (St. Louis, MO, USA) | P5606 | |
| 24-well plates TC-treated | Greiner Bio-one GmbH (Frickenhausen, Germany) | 662160 | |
| Endothelial Growth Medium, EGM-2 BulletKit (EGM-2) | LONZA (Walkersville MD-USA) | CC-3162 | VEGF-rich endothelial cell growth medium |
| Leica Qwin Image Analisys Software | Leica (Wetzlar, Germany) | Image analysis software |
Références
- Stoltz, J. F., et al. Stem Cells and Regenerative Medicine: Myth or Reality of the 21th Century. Stem Cells Int. 2015, 734731 (2015).
- Pacini, S. Deterministic and stochastic approaches in the clinical application of mesenchymal stromal cells (MSCs). Front Cell Dev Biol. 2, 50 (2014).
- Galvez, P., Clares, B., Hmadcha, A., Ruiz, A., Soria, B. Development of a cell-based medicinal product: regulatory structures in the European Union. Br Med Bull. 105, 85-105 (2013).
- Herberts, C. A., Kwa, M. S., Hermsen, H. P. Risk factors in the development of stem cell therapy. J Transl Med. 9, 29 (2011).
- Petrini, M., et al. Identification and purification of mesodermal progenitor cells from human adult bone marrow. Stem Cells Dev. 18 (6), 857-866 (2009).
- Trombi, L., et al. Selective culture of mesodermal progenitor cells. Stem Cells Dev. 18 (8), 1227-1234 (2009).
- Pacini, S., et al. Constitutive expression of pluripotency-associated genes in mesodermal progenitor cells (MPCs). PLoS One. 5 (3), 9861 (2010).
- Pacini, S., et al. Specific integrin expression is associated with podosome-like structures on mesodermal progenitor cells. Stem Cells Dev. 22 (12), 1830-1838 (2013).
- Fazzi, R., et al. Mesodermal progenitor cells (MPCs) differentiate into mesenchymal stromal cells (MSCs) by activation of Wnt5/calmodulin signalling pathway. PLoS One. 6 (9), 25600 (2011).
- Tormin, A., et al. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood. 117 (19), 5067-5077 (2011).
- Greenspan, P., Mayer, E. P., Fowler, S. D. Nile red: a selective fluorescent stain for intracellular lipid droplets. J Cell Biol. 100 (3), 965-973 (1985).
- Wang, Y. H., Liu, Y., Maye, P., Rowe, D. W. Examination of mineralized nodule formation in living osteoblastic cultures using fluorescent dyes. Biotechnol Prog. 22 (6), 1697-1701 (2006).
- Horwitz, E. M., et al. Clarification of the nomenclature for MSC: The International Society for Cellular Therapy position statement. Cytotherapy. 7 (5), 393-395 (2005).
- Wang, S., Qu, X., Zhao, R. C. Clinical applications of mesenchymal stem cells. J Hematol Oncol. 5, 19 (2012).
- Si, Y. L., Zhao, Y. L., Hao, H. J., Fu, X. B., Han, W. D. MSCs: Biological characteristics, clinical applications and their outstanding concerns. Ageing Res Rev. 10 (1), 93-103 (2011).
- Le Blanc, K., Tammik, C., Rosendahl, K., Zetterberg, E., Ringden, O. HLA expression and immunologic properties of differentiated and undifferentiated mesenchymal stem cells. Exp Hematol. 31 (10), 890-896 (2003).
- Phinney, D. G. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy. Cell Cycle. 6 (23), 2884-2889 (2007).
- Phinney, D. G. Functional heterogeneity of mesenchymal stem cells: implications for cell therapy. J Cell Biochem. 113 (9), 2806-2812 (2012).
- Tolar, J., Le Blanc, K., Keating, A., Blazar, B. R. Concise review: hitting the right spot with mesenchymal stromal cells. Stem Cells. 28 (8), 1446-1455 (2010).
- Corselli, M., et al. The tunica adventitia of human arteries and veins as a source of mesenchymal stem cells. Stem Cells Dev. 21 (8), 1299-1308 (2012).
- Bieback, K., et al. Human alternatives to fetal bovine serum for the expansion of mesenchymal stromal cells from bone marrow. Stem Cells. 27 (9), 2331-2341 (2009).
- Watson, L., Elliman, S. J., Coleman, C. M. From isolation to implantation: a concise review of mesenchymal stem cell therapy in bone fracture repair. Stem Cell Res Ther. 5 (2), 51 (2014).
- Pacini, S., Petrini, I. Are MSCs angiogenic cells? New insights on human nestin-positive bone marrow-derived multipotent cells. Front Cell Dev Biol. 2, 20 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon