Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quantifizierung des absoluten Myokardflusses und -widerstands durch kontinuierliche Thermodilution bei Patienten mit Ischämie und nichtobstruktiver koronarer Herzkrankheit (INOCA)
In diesem Artikel
Zusammenfassung
Im Folgenden wird ein Protokoll zur Messung des absoluten Myokardflusses und -widerstands mittels kontinuierlicher Thermodilution bei Patienten mit Ischämie und nichtobstruktiver koronarer Herzkrankheit vorgestellt.
Zusammenfassung
Bei etwa der Hälfte der Patienten, die sich einer Koronarangiographie wegen Angina pectoris oder wegen Anzeichen oder Symptomen, die auf eine ischämische Herzkrankheit hindeuten, unterziehen, ist angiographisch keine obstruktive koronare Herzkrankheit sichtbar. Die Mehrheit dieser Patienten mit Angina pectoris oder Ischämie und ohne obstruktive koronare Herzkrankheit (INOCA) hat eine zugrunde liegende koronare vasomotorische Dysfunktion, und aktuelle Konsensusdokumente empfehlen diagnostische invasive koronare vasomotorische Funktionstests (CFT).
Während der CFT kann eine Vielzahl von Endotypen der vasomotorischen Dysfunktion beurteilt werden, einschließlich vasospastischer koronarer Dysfunktion (epikardialer oder mikrovaskulärer Vasospasmus) und/oder mikrovaskulärer vasodilatatorischer Dysfunktion, einschließlich einer beeinträchtigten gefäßerweiternden Kapazität und eines erhöhten mikrovaskulären Widerstands. Die Quantifizierung des von der kontinuierlichen Thermodilution abgeleiteten absoluten koronaren Blutflusses und -widerstands könnte im Vergleich zu den derzeit verwendeten physiologischen Standardmaßen ein besseres Maß sein. Dieser Artikel gibt einen Überblick über diese kontinuierliche Thermodilutionsmethode.
Einleitung
Bei etwa der Hälfte der Patienten, die sich einer Koronarangiographie wegen Angina pectoris oder wegen Anzeichen oder Symptomen, die auf eine ischämische Herzkrankheit hindeuten, unterziehen, ist keine obstruktive koronare Herzkrankheit angiographisch sichtbar1. Die Mehrzahl dieser Patienten mit Angina pectoris oder Ischämie und ohne obstruktive koronare Herzkrankheit (INOCA) hat eine zugrundeliegende koronare vasomotorische Dysfunktion, und die aktuellen ESC-Leitlinien und ein kürzlich erschienenes ESC-Positionspapier zu INOCA empfehlen diagnostische invasive koronare vasomotorische Funktionstests (CFT)1,2.
Während der CFT kann eine Vielzahl von Endotypen der vasomotorischen Dysfunktion beurteilt werden, einschließlich vasospastischer koronarer Dysfunktion (epikardialer oder mikrovaskulärer Vasospasmus) und/oder mikrovaskulärer vasodilatatorischer Dysfunktion, einschließlich einer beeinträchtigten gefäßerweiternden Kapazität und eines erhöhten mikrovaskulären Widerstands. Die Konsensuskriterien für diese Endotypen wurden von der Coronary Vasomotion Disorders International Study Group (COVADIS)3,4 definiert.
Während die vasospastische koronare Dysfunktion in der Regel durch Acetylcholin-Provokationstests nachgewiesen wird, ist die Diagnose einer mikrovaskulären vasodilatatorischen Dysfunktion komplexer. Diese Diagnose wird durch einen abnormalen Index des mikrovaskulären Widerstands (IMR) und/oder der koronaren Flussreserve (CFR)4 gestellt.
Für die Messung von IMR oder CFR gibt es zwei Methoden: Thermodilution oder Doppler-Strömungsgeschwindigkeit. Beide verwenden intravenöses Adenosin, um eine maximale Hyperämie (und damit eine minimale Resistenz) zu induzieren, und beide Methoden wurden umfassend validiert. Sie weisen jedoch einige wichtige Mängel auf: Der Bedarf an Adenosin schränkt ihre Verwendung bei Patienten mit schwerer chronisch obstruktiver Lungenerkrankung oder Asthma ein. Außerdem kann die Thermodilutionsmethode den CFR überschätzen und weist eine große Intra-Observer-Variabilität auf, und mit den Doppler-Strömungsgeschwindigkeitsmethoden kann es schwierig sein, ein stabiles Doppler-Flusssignal zu erhalten5. Am wichtigsten ist, dass sowohl CFR als auch IMR nur Surrogatmaße sind und den tatsächlichen koronaren Blutfluss und -widerstand nicht quantifizieren.
Der absolute koronare Blutfluss (Q) und der Widerstand (R) können direkt quantifiziert werden, indem eine kürzlich validierte und neuartige Methode verwendet wird, die eine kontinuierliche Thermodilution mit intrakoronarer Kochsalzlösung bei Raumtemperatur verwendet, um eine Hyperämie zu induzieren. Ein spezieller Monorail-Infusionskatheter und ein Druckdraht mit Temperatursensoren ermöglichen die direkte Quantifizierung von Q und R ohne den Einsatz von Adenosin. Diese neuartige Methode hat sich als sicher, hochgradig reproduzierbar und bedienerunabhängig erwiesen 6,7.
Wie in einer kürzlich veröffentlichten Konsenserklärung gefordert, benötigen wir ein besseres Verständnis des zugrunde liegenden Mechanismus der myokardialen Ischämie bei Patienten mit INOCA über die verschiedenen Endotypenhinweg 1. Dies könnte erhebliche Auswirkungen auf die Behandlung und die Prognose haben. Die Quantifizierung des absoluten koronaren Blutflusses und -widerstands könnte im Vergleich zu den derzeit verwendeten physiologischen Standardmaßen ein besseres Maß sein. Kürzlich wurde gezeigt, dass kontinuierliche Thermodilutionsmessungen mit Symptomen bei INOCA assoziiert sind, während IMR und CFR nichtbei 8 lagen. Weitere Ergebnisdaten werden folgen. In diesem Artikel wird das Protokoll der kontinuierlichen Thermodilution beschrieben.
Protokoll
Das folgende Protokoll wurde von der lokalen medizinischen Ethikkommission des Radboudumc-Krankenhauses in Nijmegen, Niederlande, genehmigt. Die folgenden Schritte sollten bei der kontinuierlichen Thermodilution befolgt werden, um den absoluten Durchfluss und Widerstand zu berechnen.
1. Vorbereitungen
- Halten Sie vasoaktive Medikamente mindestens 24 Stunden lang zurück (48 Stunden bei Kalziumkanalblockern).
2. Diagnostische Koronarangiographie
- Injizieren Sie eine Lokalanästhesie (1 bis 2 ml 20 mg/ml Lidocain) entweder in der Nähe der rechten Arteria radialis oder der linken Arteria radialis. Falls ein radialer Zugang nicht möglich ist, injizieren Sie eine Lokalanästhesie entweder in der Nähe der rechten Oberschenkelarterie (normalerweise 10 ml Lidocain) oder der linken Oberschenkelarterie.
- Bestätigen Sie die örtliche Betäubung, indem Sie mit der Nadel in die betäubte Haut stechen und prüfen, ob noch Schmerzen vorhanden sind.
- Punktieren Sie die Arteria radialis oder femoralis mit einer Kanüle, führen Sie den Draht durch die Kanüle ein und entfernen Sie ihn. Führen Sie eine 6 Fr Scheide über den Draht ein. Stellen Sie sicher, dass Sie dies unter sterilen Bedingungen durchführen.
- Verabreichen Sie Heparin gemäß dem lokalen Protokoll (patientengewichtsbereinigt 100 internationale Einheiten pro Kilogramm, mindestens 5000 internationale Einheiten, maximal 10.000 internationale Einheiten).
- Führen Sie den Draht durch die Schleuse zur aufsteigenden Aorta und platzieren Sie den Diagnosekatheter über der Aortenklappe. Entfernen Sie dann den Draht und verbinden Sie den Katheter mit der Kontrastspritze.
- Setzen Sie die rechte Koronararterie mit einem diagnostischen Katheter ein. Nach intrakoronarer Verabreichung von 0,2 mg Nitroglycerin ist eine Koronarangiographie mit manuellen Kontrastmittelinjektionen durchzuführen.
- Greifen Sie die linke Koronararterie mit einem Führungskatheter an (um einen nachträglichen Wechsel von der Diagnose zur Führung zu vermeiden). Nach intrakoronarer Verabreichung von 0,2 mg Nitroglycerin ist eine Koronarangiographie mit manuellen Injektionen eines Kontrastmittels durchzuführen. Verwenden Sie einen Führungskatheter der Größe 6 Fr oder größer, um den speziellen Einschienenbahnkatheter zu erleichtern (Schritt 4).
- Ausschluss des Vorliegens einer obstruktiven koronaren Herzkrankheit: jede relevante Epikardstenose durch visuelle Beurteilung und intrakoronare physiologische Beurteilung im Falle einer intermediären Epikardstenose (40-90% angiographische Stenose) 9.
3. Einrichtung von kontinuierlichen Thermodilutionsmessungen
- Stellen Sie sicher, dass alle koronaren Druckspuren und Temperaturen drahtlos übertragen und von einer speziellen Konsole analysiert werden, die mit einer Software ausgestattet ist, die Q und R automatisch berechnet.
- Bereiten Sie einen Kontrastmittelinjektor mit einem Grenzwert von 100 bis 150 ml Kochsalzlösung bei Raumtemperatur vor.
4. Kontinuierliche Thermodilutionsmessungen
- Spülen Sie einen Führungsdraht mit Druck- und Temperatursensoren (im Folgenden als "Druckdraht" bezeichnet) manuell mit Spritzen mit Kochsalzlösung.
- Stellen Sie sicher, dass der Druckdraht mit der entsprechenden Software verbunden ist (so dass Druck/Temperatur in Echtzeit visualisiert werden) und führen Sie den Druckdraht durch den Führungskatheter. Stellen Sie sicher, dass der proximale Teil des röntgendichten Abschnitts des Druckdrahtes mittels Angiographie im Ostium der Koronararterie platziert wird.
- Gleichen Sie den Druckdraht an den Aortendruck aus. Es ist wichtig, dass dieser Schritt abgeschlossen ist, bevor Messungen eingeleitet werden.
- Schieben Sie den Druckdraht bis zum distalen 1/3 der interessierenden Koronararterie vor.
- Schließen Sie einen speziellen Monorail-Katheter an den Kontrastmittelinjektor an.
- Spülen Sie den Einschienenbahn-Katheter mit Kochsalzlösung mit dem automatischen Kontrastinjektor, der auf 10 ml/min eingestellt ist, um Luft aus dem Einschienenbahnkatheter zu entfernen. Wenn Kochsalzlösung aus den Infusionslöchern an der Spitze des Einschienenbahn-Katheters austritt, schieben Sie den Einschienenbahn-Katheter während der Spülung durch den Führungskatheter.
- Wenn der Einschienenbahn-Katheter den hämostatischen Konnektor passiert, stoppen Sie die Spülung und schieben Sie den Einschienenbahn-Katheter weiter in den Führungskatheter vor.
- Platzieren Sie den röntgendichten Marker des Einschienenbahnkatheters im proximalen Teil (erster Zentimeter) der Koronararterie von Interesse.
HINWEIS: Es ist sicherzustellen, dass zwischen dem röntgendichten Marker des proximal platzierten Einschienenbahn-Katheters und dem röntgendichten Marker des distal platzierten Führungsdrahtes ein Abstand von mindestens 3 cm besteht, um eine optimale Vermischung von Blut und Kochsalzlösung zu gewährleisten 10,11. - Wählen Sie in der entsprechenden Software das Programm Absoluter Fluss aus, wählen Sie die gewünschte Koronararterie aus und stellen Sie die Temperatur auf Null ein (Referenztemperatur vergleichbar mit 37 °C beim Menschen).
- Wählen Sie die geeignete Infusionsrate von (Raumtemperatur-)Kochsalzlösung (Qi) an der Infusionspumpe aus und stellen Sie sicher, dass die Programmeinstellungen entsprechend aktualisiert werden.
HINWEIS: Das Qi beträgt in der Regel 20 ml/min für die linke anteriore absteigende (LAD) und linke Zirkumflexarterie (LCX) und 15 ml/min für die rechte Koronararterie (RCA). Starten Sie die Infusion noch nicht. - Starten Sie die absolute Durchflussmessung mit dem entsprechenden Softwareprogramm. Stoppen Sie die Messung nicht bis Schritt 4.16. Stellen Sie sicher, dass mehrere Sekunden gemessen werden, bevor die Infusion von Kochsalzlösung eingeleitet wird.
- Starten Sie die Infusion von Kochsalzlösung an der Infusionspumpe mit der gewählten Durchflussrate (Qi). Beenden Sie die Infusion nicht bis Schritt 4.15.
HINWEIS: Nach Beginn der Infusion mit Kochsalzlösung sinkt die Temperatur in der distalen Koronararterie. - Stellen Sie sicher, dass eine stationäre distale Temperatur des Blut-Kochsalzlösung-Gemisches für mindestens 10 s aufgezeichnet wird.
- Ziehen Sie den Führungsdraht zurück in den Einschienenbahn-Infusionskatheter, um eine proximale Temperatur (Ti) zu erhalten. Stellen Sie sicher, dass ein stabiler Ti für ca. 10 s aufgezeichnet wird.
- Stoppen Sie die Infusion von Kochsalzlösung bei Raumtemperatur an der Infusionspumpe.
- Stellen Sie sicher, dass die Temperatur auf den Nullwert zurückgesetzt wird. Stoppen Sie danach die absolute Durchflussmessung in dem entsprechenden Softwareprogramm.
HINWEIS: FFR, absolute Q und R werden jetzt automatisch von der entsprechenden Software berechnet. - Entfernen Sie den speziellen Einschienenbahn-Katheter.
- Stellen Sie sicher, dass der Druckdraht ähnlich wie in Schritt 4.2 im Ostium der Koronararterie platziert wird, und führen Sie eine Driftkontrolle der Druckmessung durch. Wenn die Drift mehr als 2 mmHg beträgt, die Messungen wiederholen. Wenn keine Drift vorhanden ist, entfernen Sie den Druckdraht.
- Führen Sie ein oder zwei abschließende Angiographien durch, in denen die Koronararterien von Interesse dargestellt werden, um nach möglichen Komplikationen zu suchen (z. B. Dissektion der Koronararterien).
5. Berechnung des absoluten Durchflusses und des absoluten Widerstands
HINWEIS: Wie in Abbildung 1 gezeigt, ermöglicht der spezielle Einschienenbahn-Infusionskatheter die Infusion von Kochsalzlösung nur durch vier äußere Seitenlöcher, was zu einer vollständigen und optimalen Vermischung mit dem Blut führt. Zwei innenliegende Seitenlöcher ermöglichen die Messung der Temperatur durch den verwendeten Führungsdraht.
- Berechnen Sie den absoluten Fluss (Q) in mL pro Minute mit der folgenden Gleichung7:
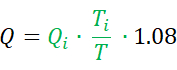
Wie oben erwähnt, ist Qi die Kochsalzinfusionsrate in ml pro Minute und Ti ist die Temperatur der infundierten Kochsalzlösung in der Nähe des speziellen Monorail-Katheterausganges. T ist die Temperatur des homogenen Gemisches aus Blut und Kochsalzlösung im distalen Teil der Koronararterie während der Infusion. Die Konstante 1,08 bezieht sich auf die Differenz zwischen der spezifischen Temperatur und Dichte von Blut und Kochsalzlösung und dem Zeitpunkt, zu dem Kochsalzlösung in das Blut infundiert wird. - Berechnen Sie R, ausgedrückt in Holzeinheiten (WU) oder mmHg * (L/min), nach folgender Formel:
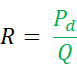
Es gibt eine leicht verfügbare, fortschrittliche Plattform zur Messung physiologischer Indizes, die mit dem Druckdraht kommuniziert und die Live-Berechnung von FFR, Q und R (Table of Materials) ermöglicht.
Ergebnisse
Abbildung 2 zeigt eine repräsentative Messung, die bei Patient A ohne obstruktive KHK in der Koronarangiographie durchgeführt wurde. Die LAD-Arterie wurde mittels kontinuierlicher Thermodilution gemessen, um die absolute Q und R zu berechnen. Die rote und die grüne Linie stellen Druckmessungen dar, und die blaue Linie stellt den Temperaturverlauf dar. Die Infusionsrate wurde auf 20 ml/min (Qi) festgelegt, da die LAD-Arterie gemessen wurde. Bei Punkt 1 wur...
Diskussion
Die kontinuierliche Thermodilution ist eine genaue Methode zur Messung des absoluten Koronarflusses und -widerstands, die nachweislich stark mit dem Goldstandard [15O2]H2O PET-abgeleiteter Fluss und Widerstandübereinstimmt 5. Diese Messungen sind für INOCA-Patienten von besonderem Interesse, da aktuelle klinische Leitlinien die Beurteilung des koronaren Flusses und Widerstands in dieser Gruppe empfehlen.
Offenlegungen
Peter Damman erhielt Vortrags- und/oder Beratungshonorare von Phillips und Abbott Vascular.
Danksagungen
Nichts.
Materialien
| Name | Company | Catalog Number | Comments |
| Rayflow multipurpose infusion catheter | Hexacath | RFW61S | Only compatible with 6F guiding catheter |
| PressureWire X guidewire | Abbott | C12059 | Wireless guidewire with distal temperature and pressure sensor |
| Coroventis CoroFlow Cardiovascular System software | Coroventis | N/A | Advanced platform to measure physiological indices |
| Illumena Neo injector or similar injector system | Liebel-Flarsheim | GU01181006-E | Any injector with pressure limit (600 psi) and adjustable flow and volume injection rate |
| 100 ml NaCl 0.9% at room temperature |
Referenzen
- Kunadian, V., et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. European Heart Journal. 41 (37), 3504-3520 (2020).
- Knuuti, J., et al. ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Beltrame, J. F., et al. International standardization of diagnostic criteria for vasospastic angina. European Heart Journal. 38 (33), 2565-2568 (2017).
- Ong, P., et al. International standardization of diagnostic criteria for microvascular angina. International Journal of Cardiology. 250, 16-20 (2018).
- Everaars, H., et al. Continuous thermodilution to assess absolute flow and microvascular resistance: validation in humans using [15O]H2O positron emission tomography. European Heart Journal. 40 (28), 2350-2359 (2019).
- Konstantinou, K., et al. Absolute microvascular resistance by continuous thermodilution predicts microvascular dysfunction after ST-elevation myocardial infarction. International Journal of Cardiology. 319, 7-13 (2020).
- Xaplanteris, P., et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circulation Cardiovascular Interventions. 11 (3), 006194 (2018).
- Konst, R. E., et al. Absolute Coronary Blood Flow Measured by Continuous Thermodilution in Patients With Ischemia and Nonobstructive Disease. Journal of the American College of Cardiology. 77 (6), 728-741 (2021).
- Neumann, F. J., et al. ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal. 40 (2), 87-165 (2019).
- Aarnoudse, W., et al. Direct volumetric blood flow measurement in coronary arteries by thermodilution. Journalof the American College of Cardiology. 50 (24), 2294-2304 (2007).
- van't Veer, M., et al. Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. 12 (6), 701-707 (2016).
- Fournier, S., et al. Normal Values of Thermodilution-Derived Absolute Coronary Blood Flow and Microvascular Resistance in Humans. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. , (2020).
- Keulards, D. C. J., et al. Safety of Absolute Coronary Flow And Microvascular Resistance Measurements by Thermodilution. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. , (2020).
- Konijnenberg, L. S. F., et al. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovascular Research. 116 (4), 787-805 (2020).
- Wijnbergen, I., van't Veer, M., Lammers, J., Ubachs, J., Pijls, N. H. Absolute coronary blood flow measurement and microvascular resistance in ST-elevation myocardial infarction in the acute and subacute phase. Cardiovascular Revascularization Medicine: including Molecular Interventions. 17 (2), 81-87 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten