Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Quantification du débit myocardique absolu et de la résistance par thermodilution continue chez les patients atteints d’ischémie et de maladie coronarienne non obstructive (INOCA)
Dans cet article
Résumé
Voici un protocole permettant de mesurer le débit myocardique absolu et la résistance à l’aide d’une thermodilution continue chez des patients atteints d’ischémie et de maladie coronarienne non obstructive.
Résumé
Chez environ la moitié des patients subissant une coronarographie pour une angine de poitrine ou pour des signes ou symptômes évocateurs d’une cardiopathie ischémique, aucune coronaropathie obstructive n’est visible par angiographie. La majorité de ces patients atteints d’angine de poitrine ou d’ischémie et sans maladie coronarienne obstructive (INOCA) présentent une dysfonction vasomotrice coronaire sous-jacente, et les documents de consensus actuels recommandent un test diagnostique invasif de la fonction vasomotrice coronaire (CFT).
Au cours de la CFT, une variété d’endotypes de dysfonction vasomotrice peuvent être évalués, y compris la dysfonction coronarienne vasospastique (vasospasme épicardique ou microvasculaire) et/ou la dysfonction vasodilatatrice microvasculaire, y compris l’altération de la capacité vasodilatatrice et l’augmentation de la résistance microvasculaire. La quantification du débit sanguin coronaire absolu et de la résistance dérivés de la thermodilution continue pourrait être une meilleure mesure par rapport aux mesures physiologiques standard actuellement utilisées. Cet article donne un aperçu de cette méthode de thermodilution continue.
Introduction
Chez environ la moitié des patients subissant une coronarographie pour une angine de poitrine ou pour des signes ou symptômes évocateurs d’une cardiopathie ischémique, aucune maladie coronarienne obstructive n’est visible angiographiquement1. La majorité de ces patients atteints d’angine de poitrine ou d’ischémie et sans maladie coronarienne obstructive (INOCA) présentent une dysfonction vasomotrice coronaire sous-jacente, et les directives actuelles de l’ESC et un récent document de position de l’ESC sur l’INOCA recommandent un test diagnostique invasif de la fonction vasomotrice coronaire (CFT)1,2.
Au cours de la CFT, une variété d’endotypes de dysfonction vasomotrice peuvent être évalués, y compris la dysfonction coronarienne vasospastique (vasospasme épicardique ou microvasculaire) et/ou la dysfonction vasodilatatrice microvasculaire, y compris l’altération de la capacité vasodilatatrice et l’augmentation de la résistance microvasculaire. Les critères consensuels pour ces endotypes ont été définis par le Groupe d’étude international sur les troubles coronariens vasomoteurs (COVADIS)3,4.
Alors que la dysfonction coronarienne vasospastique est généralement démontrée par le test de provocation à l’acétylcholine, le diagnostic de dysfonction vasodilatatrice microvasculaire est plus complexe. Ce diagnostic est posé par un indice anormal de résistance microvasculaire (IMR) et/ou de réserve de débit coronarien (CFR)4.
Deux méthodes existent pour la mesure de l’IMR ou du CFR : la thermodilution ou la vitesse d’écoulement Doppler. Les deux utilisent l’adénosine intraveineuse pour induire une hyperémie maximale (et donc une résistance minimale), et les deux méthodes ont été largement validées. Cependant, ils présentent plusieurs lacunes importantes : la nécessité de disposer d’adénosine limite leur utilisation chez les patients atteints de bronchopneumopathie chronique obstructive sévère ou d’asthme. De plus, la méthode de thermodilution peut surestimer le CFR et présente une grande variabilité intra-observateur, et avec les méthodes de vitesse d’écoulement Doppler, il peut être difficile d’obtenir un signal d’écoulement Doppler stable5. Plus important encore, le taux de létalité et le taux de mortalité infantile ne sont que des mesures de substitution et ne permettent pas de quantifier le véritable flux sanguin coronaire et la résistance.
Le débit sanguin coronaire absolu (Q) et la résistance (R) peuvent être directement quantifiés à l’aide d’une méthode récemment validée et nouvelle qui utilise une thermodilution continue avec une perfusion saline intracoronaire à température ambiante pour induire l’hyperémie. Un cathéter de perfusion monorail dédié et un fil de pression avec des capteurs de température permettent une quantification directe de Q et R, sans utiliser d’adénosine. Cette nouvelle méthode s’est avérée sûre, hautement reproductible et indépendante de l’opérateur 6,7.
Comme l’a souligné une récente déclaration de consensus, nous avons besoin d’une meilleure compréhension du mécanisme sous-jacent de l’ischémie myocardique chez les patients atteints d’INOCA, à travers les différents endotypes1. Cela pourrait avoir des implications majeures pour le traitement et le pronostic. La quantification du débit sanguin coronaire absolu et de la résistance pourrait être une meilleure mesure par rapport aux mesures physiologiques standard actuellement utilisées. Il a récemment été démontré que les mesures continues de thermodilution sont associées à des symptômes chez INOCA, alors que la TMI et la létinalité n’étaient pasde 8. D’autres données sur les résultats suivront. Dans cet article, le protocole de thermodilution continue est décrit.
Protocole
Le protocole suivant a été approuvé par le comité local d’éthique médicale de l’hôpital Radboudumc, à Nimègue, aux Pays-Bas. Les étapes suivantes doivent être suivies lors de l’exécution d’une thermodilution continue pour calculer le débit et la résistance absolus.
1. Préparatifs
- Suspendre l’administration des médicaments vasoactifs pendant au moins 24 heures (48 heures en cas d’inhibiteurs calciques).
2. Angiographie coronarienne diagnostique
- Injecter une anesthésie locale (1 à 2 mL de lidocaïne à 20 mg/mL) à proximité de l’artère radiale droite ou de l’artère radiale gauche. Dans le cas où l’accès radial n’est pas possible, injectez une anesthésie locale à proximité de l’artère fémorale droite (généralement 10 ml de lidocaïne) ou de l’artère fémorale gauche.
- Confirmez l’anesthésie locale en piquant la peau anesthésiée avec l’aiguille et vérifiez si la douleur est toujours présente.
- Percez l’artère radiale ou fémorale à l’aide d’une canule, insérez le fil dans la canule et retirez-le. Insérez une gaine 6 Fr sur le fil. Assurez-vous de le faire dans des conditions stériles.
- Administrer l’héparine selon le protocole local (poids du patient ajusté 100 unités internationales par kilogramme, minimum de 5000 unités internationales, maximum de 10 000 unités internationales).
- Faites avancer le fil à travers la gaine jusqu’à l’aorte ascendante et placez le cathéter de diagnostic au-dessus de la valve aortique. Retirez ensuite le fil et connectez le cathéter avec la seringue de contraste.
- Engagez l’artère coronaire droite à l’aide d’un cathéter diagnostique. Après l’administration intracoronaire de 0,2 mg de nitroglycérine, effectuez une coronarographie avec des injections manuelles d’agent de contraste.
- Engagez l’artère coronaire gauche à l’aide d’un cathéter de guidage (pour éviter de passer du diagnostic au guidage par la suite). Après l’administration intracoronaire de 0,2 mg de nitroglycérine, effectuez une coronarographie avec injections manuelles d’un agent de contraste. Utilisez un cathéter de guidage de taille 6 Fr ou plus grand pour faciliter le cathéter monorail dédié (étape 4).
- Exclure la présence d’une coronaropathie obstructive : toute sténose épicardique pertinente par évaluation visuelle, et évaluation physiologique intracoronaire en cas de sténose épicardique intermédiaire (sténose angiographique de 40 à 90 %) 9.
3. Mise en place de mesures de thermodilution en continu
- Assurez-vous que tous les tracés de pression coronaire et les températures sont transmis sans fil et analysés par une console dédiée équipée d’un logiciel qui calcule automatiquement Q et R.
- Préparez un injecteur de contraste avec limite de pression contenant 100 à 150 ml de solution saline à température ambiante.
4. Mesures de thermodilution en continu
- Rincez manuellement un fil-guide avec des capteurs de pression et de température (également appelé « fil de pression ») à l’aide de seringues avec du sérum physiologique.
- Assurez-vous que le fil de pression est connecté au logiciel approprié (afin que la pression/température soit visualisée en temps réel) et faites passer le fil de pression à travers le cathéter de guidage. S’assurer que la partie proximale de la section radio-opaque du fil de pression est placée dans l’ostium de l’artère coronaire à l’aide de l’angiographie.
- Égalisez le fil de pression à la pression aortique. Il est essentiel que cette étape soit terminée avant que toute mesure ne soit initiée.
- Avancez le fil de pression jusqu’au 1/3 distal de l’artère coronaire d’intérêt.
- Connectez un cathéter monorail dédié à l’injecteur de contraste.
- Rincez le cathéter monorail avec une solution saline à l’aide de l’injecteur de contraste automatisé réglé à 10 ml/min pour éliminer l’air du cathéter monorail. Lorsque la solution saline sort des trous de perfusion à l’extrémité du cathéter monorail, faites avancer le cathéter monorail à travers le cathéter de guidage pendant le rinçage.
- Lorsque le cathéter monorail passe le connecteur hémostatique, arrêtez le rinçage et avancez le cathéter monorail plus loin dans le cathéter de guidage.
- Placez le marqueur radio-opaque du cathéter monorail dans la partie proximale (premier centimètre) de l’artère coronaire d’intérêt.
REMARQUE : Assurez-vous qu’il y a une distance d’au moins 3 cm entre le marqueur radio-opaque du cathéter monorail placé proximal et le marqueur radio-opaque du fil-guide placé distalement pour assurer un mélange optimal du sang et de la solution saline 10,11. - Sur le logiciel dédié, sélectionnez le programme Absolute flow , sélectionnez l’artère coronaire d’intérêt, et réglez la température à zéro (température de référence comparable à 37 °C chez l’homme).
- Sélectionnez le débit de perfusion approprié de solution saline (Qi) (à température ambiante) sur la pompe à perfusion et assurez-vous que les paramètres du programme sont mis à jour en conséquence.
REMARQUE : Le Qi est généralement de 20 mL/min pour l’artère descendante antérieure gauche (DAL) et l’artère circonflexe gauche (LCX) et de 15 mL/min pour l’artère coronaire droite (ACR). Ne commencez pas encore l’infusion. - Démarrez la mesure de débit absolu sur le logiciel dédié. N’arrêtez pas la mesure jusqu’à l’étape 4.16. Assurez-vous de mesurer plusieurs secondes avant de commencer l’infusion de solution saline.
- Démarrez l’infusion de solution saline au niveau de la pompe à perfusion au débit sélectionné (Qi). N’arrêtez pas la perfusion jusqu’à l’étape 4.15.
REMARQUE : Après le début de la perfusion avec une solution saline, la température dans l’artère coronaire distale diminuera. - S’assurer que la température distale à l’état d’équilibre du mélange sang/sérum physiologique est enregistrée pendant au moins 10 s.
- Tirez le fil-guide dans le cathéter de perfusion monorail pour obtenir une température proximale (Ti). Assurez-vous qu’un Ti stable est enregistré pendant environ 10 s.
- Arrêtez l’infusion de solution saline à température ambiante sur la pompe à perfusion.
- Assurez-vous que la température revient à la valeur mise à zéro. Après cela, arrêtez la mesure de débit absolu sur le logiciel dédié.
REMARQUE : Le FFR, le Q et le R absolus sont désormais calculés automatiquement par le logiciel dédié. - Retirez le cathéter monorail dédié.
- Assurez-vous que le fil de pression est placé dans l’ostium de l’artère coronaire comme à l’étape 4.2 et effectuez une vérification de la dérive de la mesure de pression. Si la dérive est supérieure à 2 mmHg, répéter les mesures. S’il n’y a pas de dérive, retirez le fil de pression.
- Effectuez une ou deux angiographies finales en visualisant l’artère coronaire d’intérêt pour vérifier s’il y a d’éventuelles complications (par exemple, dissection de l’artère coronaire).
5. Calcul du débit absolu et de la résistance absolue
REMARQUE : Comme le montre la figure 1, le cathéter de perfusion monorail dédié permet l’infusion de solution saline uniquement à travers quatre trous latéraux extérieurs, ce qui permet un mélange complet et optimal avec le sang ; Deux trous latéraux intérieurs permettent la mesure de la température par le fil-guide utilisé.
- Calculer le débit absolu (Q) en mL par minute à l’aide de l’équation7 suivante :
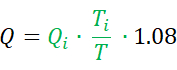
Comme mentionné ci-dessus, Qi est le débit de perfusion de solution saline en mL par minute et Ti est la température de la solution saline perfusée près de la sortie du cathéter monorail dédié. T est la température du mélange homogène de sang et de solution saline dans la partie distale de l’artère coronaire pendant la perfusion. La constante 1,08 se rapporte à la différence entre la température et la densité spécifiques du sang et du sérum physiologique, et le moment où une solution saline est perfusée dans le sang. - Calculer R, exprimé en unités bois (WU) ou en mmHg * (L/min), par la formule :
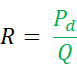
Il existe une plate-forme avancée facilement disponible pour mesurer les indices physiologiques, qui communique avec le fil de pression et qui permet le calcul en direct de FFR, Q et R (Table of Materials).
Résultats
La figure 2 montre une mesure représentative réalisée chez le patient A sans coronaropathie obstructive sur coronarographie. L’artère DAL a été mesurée à l’aide d’une thermodilution continue pour calculer Q et R absolus. Les lignes rouge et verte représentent les mesures de pression, et la ligne bleue représente la courbe de température. Le débit de perfusion a été fixé à 20 mL/min (Qi) puisque l’artère DAL a été mesurée. Au point...
Discussion
La thermodilution continue est une méthode précise pour mesurer le débit coronaire absolu et la résistance, qui s’est avérée être en accord avec l’écoulement etla résistance dérivés du PET [15O2]H2O 5. Ces mesures sont d’un intérêt particulier pour les patients INOCA, les directives cliniques actuelles préconisant l’évaluation du flux coronarien et de la résistance dans ce groupe.
Déclarations de divulgation
Peter Damman a reçu des honoraires de conférence et/ou de consultation de Phillips et d’Abbott Vascular.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| Rayflow multipurpose infusion catheter | Hexacath | RFW61S | Only compatible with 6F guiding catheter |
| PressureWire X guidewire | Abbott | C12059 | Wireless guidewire with distal temperature and pressure sensor |
| Coroventis CoroFlow Cardiovascular System software | Coroventis | N/A | Advanced platform to measure physiological indices |
| Illumena Neo injector or similar injector system | Liebel-Flarsheim | GU01181006-E | Any injector with pressure limit (600 psi) and adjustable flow and volume injection rate |
| 100 ml NaCl 0.9% at room temperature |
Références
- Kunadian, V., et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International Study Group. European Heart Journal. 41 (37), 3504-3520 (2020).
- Knuuti, J., et al. ESC Guidelines for the diagnosis and management of chronic coronary syndromes. European Heart Journal. 41 (3), 407-477 (2020).
- Beltrame, J. F., et al. International standardization of diagnostic criteria for vasospastic angina. European Heart Journal. 38 (33), 2565-2568 (2017).
- Ong, P., et al. International standardization of diagnostic criteria for microvascular angina. International Journal of Cardiology. 250, 16-20 (2018).
- Everaars, H., et al. Continuous thermodilution to assess absolute flow and microvascular resistance: validation in humans using [15O]H2O positron emission tomography. European Heart Journal. 40 (28), 2350-2359 (2019).
- Konstantinou, K., et al. Absolute microvascular resistance by continuous thermodilution predicts microvascular dysfunction after ST-elevation myocardial infarction. International Journal of Cardiology. 319, 7-13 (2020).
- Xaplanteris, P., et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circulation Cardiovascular Interventions. 11 (3), 006194 (2018).
- Konst, R. E., et al. Absolute Coronary Blood Flow Measured by Continuous Thermodilution in Patients With Ischemia and Nonobstructive Disease. Journal of the American College of Cardiology. 77 (6), 728-741 (2021).
- Neumann, F. J., et al. ESC/EACTS Guidelines on myocardial revascularization. European Heart Journal. 40 (2), 87-165 (2019).
- Aarnoudse, W., et al. Direct volumetric blood flow measurement in coronary arteries by thermodilution. Journalof the American College of Cardiology. 50 (24), 2294-2304 (2007).
- van't Veer, M., et al. Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. 12 (6), 701-707 (2016).
- Fournier, S., et al. Normal Values of Thermodilution-Derived Absolute Coronary Blood Flow and Microvascular Resistance in Humans. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. , (2020).
- Keulards, D. C. J., et al. Safety of Absolute Coronary Flow And Microvascular Resistance Measurements by Thermodilution. EuroIntervention: Journal of EuroPCR in collaboration with the Working Group on Interventional Cardiology of the European Society of Cardiology. , (2020).
- Konijnenberg, L. S. F., et al. Pathophysiology and diagnosis of coronary microvascular dysfunction in ST-elevation myocardial infarction. Cardiovascular Research. 116 (4), 787-805 (2020).
- Wijnbergen, I., van't Veer, M., Lammers, J., Ubachs, J., Pijls, N. H. Absolute coronary blood flow measurement and microvascular resistance in ST-elevation myocardial infarction in the acute and subacute phase. Cardiovascular Revascularization Medicine: including Molecular Interventions. 17 (2), 81-87 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon