Ideale Gasgleichung
Überblick
Quelle: Labor von Dr. Andreas Züttel - schweizerischen Eidgenössischen Laboratorien für Werkstoffwissenschaft und Werkstofftechnologie
Das ideale Gasgesetz beschreibt das Verhalten der am häufigsten verwendeten Gase bei in der Nähe-Umgebungsbedingungen und die Tendenz aller chemischen Materie in der verdünnten zu begrenzen. Es ist eine grundlegende Beziehung zwischen drei messbare makroskopischen Systemvariablen (Druck, Temperatur und Volumen) und die Anzahl der Moleküle des Gases in das System und ist somit ein wichtiges Bindeglied zwischen der mikroskopischen und makroskopischen Universen.
Die Geschichte des idealen Gases Gesetzes reicht bis zur Mitte des17. Jahrhunderts als das Verhältnis zwischen Druck und Volumen der Luft gefunden wurde, umgekehrt proportional, ein Ausdruck von Robert Boyle und die wir jetzt als Boyles Gesetz (Gleichung 1) bezeichnen bestätigt .
P  V-1 (Gleichung 1)
V-1 (Gleichung 1)
Unveröffentlichte Arbeit von Jacques Charles in den 1780er Jahren, das wurde erweitert, um zahlreiche Gase und Dämpfe von Joseph Louis Gay-Lussac und berichtet im Jahre 1802, gegründet direkt proportionale Beziehung zwischen der absoluten Temperatur und Volumen eines Gases. Diese Beziehung ist Karls Gesetz (Gleichung 2) genannt.
V  T (Gleichung 2)
T (Gleichung 2)
Guillaume Amontons ist in der Regel mit der ersten Entdeckung der Beziehung zwischen der Temperatur und der Druck der Luft in einem festen Volumen an der Wende des18. Jahrhunderts gutgeschrieben. Dieses Gesetz wurde auch auf zahlreiche andere Gase durch Joseph Louis Gay-Lussac zu Beginn des19. Jahrhunderts erweitert und ist somit entweder als entweder Amontonss oder Gay-Lussac-Gesetz, erklärt wie in Gleichung 3bezeichnet.
P  T (Gleichung 3)
T (Gleichung 3)
Gemeinsam können diese drei Beziehungen kombiniert werden, um die Beziehung in Gleichung 4geben.
V  T (Gleichung 4)
T (Gleichung 4)
Schließlich wurde im Jahr 1811 von Amedeo Avogadro vorgeschlagen, dass keine zwei Gase, gehalten in der gleichen Lautstärke und bei der gleichen Temperatur und Druck, die gleiche Anzahl von Molekülen enthalten. Dies führte zu dem Schluss, dass alle Gase durch eine gemeinsame Konstante, die ideale Gaskonstante R, beschrieben werden können, die unabhängig von der Beschaffenheit des Gases ist. Dies nennt man das ideale Gasgesetz (Gleichung 5). 1,2
PV  T (Gleichung 5)
T (Gleichung 5)
Verfahren
1. Messung des Volumens der Probe
- Die Probe sorgfältig reinigen und trocknen.
- Füllen Sie eine hochauflösende Messzylinder mit genug destilliertes Wasser auf die Probe zu decken. Beachten Sie die Ausgangsmenge
- Ziehen Sie das Sample in das Wasser, und beachten Sie die Volumenänderung. Dies ist das Volumen der Probe, V.
- Entfernen Sie die Probe und trocknen. Hinweis: Alternativ Seite Länge(n) der Probe gemessen und sein Volumen mit Geometrie zu berechnen.
.css-f1q1l5{display:-webkit-box;display:-webkit-flex;display:-ms-flexbox;display:flex;-webkit-align-items:flex-end;-webkit-box-align:flex-end;-ms-flex-align:flex-end;align-items:flex-end;background-image:linear-gradient(180deg, rgba(255, 255, 255, 0) 0%, rgba(255, 255, 255, 0.8) 40%, rgba(255, 255, 255, 1) 100%);width:100%;height:100%;position:absolute;bottom:0px;left:0px;font-size:var(--chakra-fontSizes-lg);color:#676B82;}
Ergebnisse
Das ideale Gasgesetz ist eine gültige Beschreibung der tatsächlichen Gas Eigenschaften der zahlreichen gemeinsamen Gase zu Konditionen in der Nähe von ambient (Abbildung 1 Einschub) und eignet sich daher im Zusammenhang mit vielen Anwendungen. Die Grenzen des idealen Gases Gesetzes beschreibt Systeme unter den Bedingungen der hohen Drücke oder niedrigen Temperaturen lässt sich durch die zunehmende Bedeutung der molekularen Wechselwirkungen und/oder die endliche Größe der Gasmoleküle, die einen Be...
Anwendung und Zusammenfassung
Das ideale Gasgesetz ist solch eine Fundamentalgleichung der chemischen Wissenschaften, dass es eine Fülle von Anwendungen sowohl in Berechnungen als auch im täglichen Labortätigkeiten und Modellierung selbst hochkomplexe Systeme, zumindest in erster Näherung. Ihre Anwendbarkeit ist nur durch die inhärente Annäherungen an das Gesetz selbst beschränkt; in der Nähe von ambient Drücke und Temperaturen, wo das ideale Gasgesetz gut für viele gemeinsame Gase gilt, ist es weit verbreitet in der Interpretation von Gas-...
Referenzen
- Zumdahl, S.S., Chemical Principles. Houghton Mifflin, New York, NY. (2002).
- Kotz, J., Treichel, P., Townsend, J. Chemistry and Chemical Reactivity. 8th ed. Brooks/Cole, Belmont, CA (2012).
- Rouquerol, F., Rouquerol, J., Sing, K.S.W., Llewellyn, P., Maurin, G. Adsorption by Powders and Porous Solids: Principles, Methodology and Applications.Academic Press, San Diego, CA. (2014).
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Ideale Gasgleichung
General Chemistry
78.9K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
658.1K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.0K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
556.7K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.8K Ansichten

Ermittlung der Summenformel
General Chemistry
183.7K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.5K Ansichten

Verwendung eines pH-Meters
General Chemistry
346.7K Ansichten

Einführung in die Titration
General Chemistry
425.3K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.6K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
265.8K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.8K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.3K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.5K Ansichten

Komplexchemie
General Chemistry
91.7K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
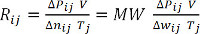 (Gleichung 9)
(Gleichung 9)