Verwendung eines pH-Meters
Überblick
Quelle: Labor von Dr. Zhongqi He - United States Department of Agriculture
Säuren und Basen sind Stoffe, die Protonen (H+) und Hydroxid-Ionen (OH–), bzw. zu spenden. Sie sind zwei Extreme, die Chemikalien zu beschreiben. Mischen von Säuren und Basen kann aufheben oder ihre extreme Auswirkungen zu neutralisieren. Eine Substanz, die weder sauer noch grundlegende ist neutral. Die Werte der Proton Konzentration ([H]+]) für die meisten Lösungen sind ungünstig klein und schwer zu vergleichen, so dass ein praktischer Menge, pH, wurde eingeführt. pH war ursprünglich definiert als die dezimalen Logarithmus der Kehrwert der molaren Konzentration von Protonen 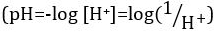 , aber auf dem dezimalen Logarithmus des der Kehrwert der Wasserstoff-Ionen Aktivität aktualisiert wurde
, aber auf dem dezimalen Logarithmus des der Kehrwert der Wasserstoff-Ionen Aktivität aktualisiert wurde 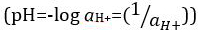 . Die ehemalige Definition wird heute gelegentlich als p [H] ausgedrückt. Der Unterschied zwischen p [H] und pH ist recht klein. Es wurde festgestellt, dass pH = p [H] + 0,04. Es ist üblich, den Begriff "pH" für beide Arten von Messungen zu verwenden.
. Die ehemalige Definition wird heute gelegentlich als p [H] ausgedrückt. Der Unterschied zwischen p [H] und pH ist recht klein. Es wurde festgestellt, dass pH = p [H] + 0,04. Es ist üblich, den Begriff "pH" für beide Arten von Messungen zu verwenden.
Die pH Skala in der Regel reicht von 0 bis 14. Nach einer 1 M Lösung von einer starken Säure pH = 0 und für eine 1 M Lösung eine starke Basis, pH = 14. So werden gemessenen pH-Werte meist im Bereich von 0 bis 14, liegen, obwohl Werte außerhalb dieses Bereichs durchaus möglich sind. Reines Wasser ist neutral mit pH = 7. Einem pH-Wert von weniger als 7 ist sauer, und ein pH-Wert größer als 7 ist einfach. Da die pH-Skala logarithmisch ist, ist pH-Wert eine dimensionslose Quantität. Jedes ganze pH-Wert unter 7 ist 10 X mehr Säure als die nächste ganze Zahl. Zum Beispiel ist ein pH-Wert von 4 10 X mehr Säure als ein pH-Wert von 5 und 100 x (10 x 10) saurer als ein pH-Wert von 6. Das gleiche gilt auch für pH-Werte über 7, von denen jeder 10 x mehr Basic ist (oder alkalisch) als dem nächstniedrigeren ganzen Wert. Zum Beispiel ist ein pH-Wert von 10 10 x mehr Basic als einen pH-Wert von 9.
Verfahren
1. pH-Wert Kalibrierung
- Schalten Sie das Messgerät durch Drücken der Taste "Power".
- Legen Sie die automatische Temperatur Kompensation (ATC) Sonde, wenn es verfügbar ist und/oder nicht mit der Elektrode.
- Überprüfen Sie, dass der Messmodus pH-Wert ist. Wenn dies nicht der Fall ist, drücken Sie die Taste "MODE" bis "pH"-Modus auf dem Display angezeigt wird.
- Konsultieren Sie die Kurzanleitung an der Unterseite des Messgeräts oder in der Nähe für Hilfe, wenn nötig.
- Verwende
Ergebnisse
Abbildung 1 zeigt den pH-Wert von landwirtschaftlich genutzten Flächen durch Zuschneiden Management und Grundwasser Bewässerung belastet. Diese Bodenproben wurden bei 5 Kartoffelfeldern unter verschiedenen Zuschneiden Drehung Praktiken mit oder ohne Grundwasser Bewässerung entnommen. Der niedrigsten pH-Wert wird in Feld 4 Böden in Rainfed und Grundwasser bewässerten Serie beobachtet. Grundwasser-Bewässerung erhöht konsequent Boden-pH in allen 5 Felder. Die pH-Informationen sind unerlässlich für Empfehlung der Kalkun...
Anwendung und Zusammenfassung
pH ist eines der am häufigsten gemessenen chemische Parameter von wässrigen Lösungen. Es ist ein kritischer Parameter bei Wasser und Abwasser Behandlung für kommunale und industrielle Anwendungen, chemische Produktion, Landwirtschaft Forschung und Produktion. Es ist auch wichtig in biochemischen und pharmazeutischen Forschung, Überwachung, Chemie- und Life Sciences Umweltforschung, Elektronikfertigung und viele weitere Anwendungen. Abbildung 2 listet pH-Werte einiger gemeinsamer Stoffe.
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Verwendung eines pH-Meters
General Chemistry
347.0K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.1K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.4K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.0K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.9K Ansichten

Ermittlung der Summenformel
General Chemistry
183.8K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.6K Ansichten

Einführung in die Titration
General Chemistry
425.8K Ansichten

Ideale Gasgleichung
General Chemistry
79.4K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.9K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
265.8K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.8K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.4K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten