Einführung in die Titration
Überblick
Quelle: Labor Dr. Yee geb. Tan – Agentur für Wissenschaft, Technologie und Forschung
Titration ist eine gängige Technik verwendet, um quantitativ zu bestimmen, die unbekannte Konzentration eines Analyten identifiziert. 1-4 volumetrische Analyse, auch zur Messung von Volumes bezeichnet ist entscheidend für die Titration. Es gibt viele Arten von Titrationen basiert auf den Arten von Reaktionen, die sie ausbeuten. Die häufigsten Arten sind Säure-Base-Titrationen und Redox-Titrationen. 5-11
In einem typischen Titration wird eine Standardlösung Titriermittel in einer Bürette schrittweise angewendet, um mit einem Analyten mit einer unbekannten Konzentration in einen Erlenmeyerkolben reagieren. Für die Säure-Basen-Titration ist ein pH-Indikator in der Regel in der Analyt-Lösung an den Endpunkt der Titration hinzugefügt. 12 anstatt pH-Indikatoren pH-Wert auch überwacht werden kann mit dem pH-Meter bei einer Titration und der Endpunkt wird grafisch aus einer Kurve pH Titration bestimmt. Das Volumen der Titriermittel aufgenommen am Endpunkt kann verwendet werden, um die Konzentration des Analyten basierend auf die Stöchiometrie der Reaktion zu berechnen.
Für die Säure-Base-Titration, präsentiert in diesem Video das Titriermittel ist eine standardisierte Natriumhydroxid-Lösung und der Analyt ist häusliche Essig. Essig ist eine saure Flüssigkeit, die häufig als kulinarische Gewürz oder Aromen verwendet wird. Essig besteht hauptsächlich aus Wasser und Essigsäure (CH3COOH). Der Essigsäure-Inhalt der kommerziellen Essig kann stark variieren und das Ziel dieses Experiments ist es, die Essigsäure-Gehalt an kommerzielle Essig durch Titration zu bestimmen.
Grundsätze
Die Bestimmung von Essigsäure in Essig basiert auf dem Prinzip einer Säure-Base-Titration-Methode. Die Reaktion zwischen NaOH und CH3COOH zeigt Gleichung 1:
CH3COOH(Aq) + NaOH(Aq) → H2O(l) + NaCH3CO2(aq) (1)
Die standardisierte NaOH-Lösung wird nach und nach hinzugefügt, den Essig mit unbekannten Essigsäurekonzentration bis zum Endpunkt erreicht ist. Während die Säure-Basen-Titration kann der pH-Wert als Funktion des Volumens der Titriermittel hinzugefügt geplottet werden. Der Wendepunkt der Kurve, der Punkt, an dem es eine stöchiometrische gleiche Menge an Säure und base in einer Lösung nennt man den Äquivalenzpunkt. Die meisten Säuren und Basen sind farblos, ohne sichtbare Reaktion auftritt am Äquivalenzpunkt. Um zu beobachten, wenn der Äquivalenzpunkt erreicht ist, wird ein pH-Indikator hinzugefügt. Der Endpunkt ist nicht der Äquivalenzpunkt aber einen Punkt, an dem der pH-Indikator verfärbt. Es ist wichtig, einen geeignete pH-Indikator zu wählen, damit der Endpunkt in der Nähe von der Äquivalenzpunkt der Titration wie möglich ist.
Am Endpunkt dieser Reaktion ist die konjugierte base NaCH3CO2 etwas einfach. Phenolphthalein Indikator hat eine arbeiten-pH-Bereich von 8,3 – 10,0, die in saurer Lösung und Magenta oberhalb von pH 8,2 farblos ist. Phenolphthalein ist daher eine bevorzugte Indikator, da es von farblos bis rosa in diesem Zustand ändert. Wenn Sie das Experiment durchführen, empfiehlt es sich, die Konzentration des pH-Indikators niedrig zu halten, weil pH-Indikatoren selbst meist schwache Säuren sind, die mit Base reagieren.
Das Volumen der standardisierten NaOH Lösung hinzugefügt am Endpunkt kann dann verwendet werden, die Molaren Konzentrationen von Essigsäure basierend auf die Stöchiometrie der obigen Gleichung berechnen. In diesem Experiment Titriermittel NaOH ist ein stark alkalisch und die Analyten Essigsäure ist eine schwache Säure.
Bevor Sie das Experiment durchführen, ist es wichtig, die hygroskopische Natur von NaOH zu berücksichtigen. Diese Eigenschaft erfordert die Lösung mit einem stabilen Primärnormal wie Kalium Wasserstoff Phthalat (KHC8H4O4) standardisiert werden. Die genaue molare Konzentration NaOH Lösung kann dann nach Standardisierung genau bestimmt werden. Die Reaktion zwischen der primären Säure standard und NaOH ist in Gleichung 2dargestellt:
KHC8H4O4(aq) + NaOH(Aq) → H2O(l) + NaKC8H4O4(aq) (2)
Eine ausführliche Schritt für Schritt Titration-Protokoll wird im folgenden Abschnitt vorgestellt.
Verfahren
1. Standardisierung der NaOH mit Kalium Hydrogenphthalate (KHC8H4O4)
- Um zu beginnen, muss das Titriermittel, Natriumhydroxid, standardisiert werden. Bereiten Sie eine Aktie NaOH Lösung durch etwa 4 g NaOH Pellet in 100 mL entionisiertem Wasser auflösen. Beachten Sie, dass NaOH ist eine gefährliche Chemikalie ist ätzend auf Haut und reizt Augen, seien Sie vorsichtig und tragen Sie geeignete persönliche Schutzausrüstung (PSA) um Haut- oder Augenkontakt zu vermeiden.
- Machen Sie eine 01:10 Verdünnung von Natronlauge durch Zugabe von 25 mL der Lager von Natriumhydroxid-Lösung auf eine 500-mL-Flasche. Natriumhydroxid absorbiert Kohlendioxid. Es ist wichtig, dies zu verhindern, indem sichergestellt wird, gekocht, deionisiertes Wasser, eine Flasche Ofen getrocknet verwenden und die Flasche schnell verschließen. Machen die Lösung bis zu 250 mL mit entionisiertem Wasser und schütteln zu mischen.
- 4 – 5 g der primäre standard Säure, KHC8H4O4 bei 110 ° C für 4 h in einem Trockenschrank zu trocknen und dann kühl der Feststoff in einem Exsikkator für 1 h.
- Etwa 4 g getrocknete KHC8H4O4 in 250 mL entionisiertem Wasser auflösen. Aufzeichnen die Masse genau. Berechnen Sie die molare Konzentration der KHC8H4O4 Lösung.
- Pipette 25 mL KHC8H4O4 in einen Erlenmeyerkolben sauber und trocken. Fügen Sie 2 Tropfen Phenolphthalein und Wirbel sanft gut mischen. Beachten Sie, dass Phenolphthalein giftig und reizend ist, seien Sie vorsichtig, Haut- oder Augenkontakt zu vermeiden.
- Reinigen Sie eine 50 mL Bürette und einen Trichter gründlich mit Wasser und Spülmittel. Die Bürette mit Wasser spülen und 3 X mit entionisiertem Wasser spülen. Die Bürette mit der verdünnten NaOH Lösung 3 x, um sicherzustellen, dass die NaOH die gesamte innere Oberfläche benetzt und abtropfen lassen Sie den Abfall durch die Spitze. Die gewaschene Bürette auf ein Ringstand mit einer Schelle montieren und sorgen dafür, dass es senkrecht steht.
- Füllen Sie die saubere Bürette mit die verdünnte NaOH-Lösung. Es sei darauf hingewiesen, dass die Höhe der verdünnte NaOH muß nicht genau an der Nullmarke sein sollte jedoch innerhalb der Skala und ausreichend für mindestens eine Titration. Luftblasen können die Genauigkeit des Bandes lesen beeinträchtigen. Überprüfen Sie sorgfältig die Bürette Luftblasen, und klopfen Sie leicht die Bürette um sie frei und öffnen Sie den Absperrhahn ein paar mL Titriermittel durch und gleichzeitig loslassen eingeschlossene Luft fließen zu lassen. Gelesen Sie der Lautstärke von der Unterseite des Meniskus nach 10 S. Datensatz anzeigen dieser erste Band. Achten Sie auf die signifikanten Stellen der Lektüre. Notieren Sie den Wert auf zwei Dezimalstellen in mL.
- Legen Sie den Erlenmeyerkolben mit Kalium Wasserstoff Phthalat (KHC8H4O4) unter die Bürette und einstellen Sie die Höhe der die Bürette richtig. Titrieren Sie die KHC8H4O4 Lösung durch Zugabe von NaOH Lösung langsam in 1 – 2 mL Schritten mit einer Hand, um die Fördermenge zu kontrollieren, durch Anpassung der Absperrhahn, und den anderen Wirbeln der Küvette.
- Wenn in der Nähe des Endpunkts beginnen Sie Titriermittel tropfenweise hinzufügen. Der Endpunkt ist erreicht, wenn die Lösung färbt sich eine schwache, anhaltende rosa Farbe. Der letzte Band der verdünnte NaOH in die Bürette aufzeichnen.
- Wiederholen Sie die Titration mindestens zweimal mehr, um konsistente Daten zu erhalten. Berechnen Sie die molare Konzentration der verdünnte NaOH-Lösung.
2. Titration Essig mit standardisierten Natronlauge
- Die Natriumhydroxid-Lösung ist jetzt standardisiert und kann als ein Titriermittel verwendet werden, um Essig zu analysieren. Reduzierung der stechenden Geruch von Essig verdünnen 10 mL Essig-Lösung in einem 01:10 zu testende ration auf ein Gesamtvolumen von 100 mL.
- Pipette 25 mL des Analyten in einem sauberen und trockenen Erlenmeyerkolben (angegeben als VA). Tropfen Sie 2 Phenolphthalein.
- Füllen Sie die Bürette mit der standardisierten NaOH-Lösung aus dem ersten Teil des Verfahrens. Datensatz des Ausgangsvolumens Titriermittel (V1).
- Fügen Sie die standardisierte NaOH-Lösung schrittweise den Essig hinzu. Nähert sich das Volumen der Titriermittel Erwartungswert, passen Sie den Absperrhahn Titriermittel tropfenweise hinzufügen. Weiter zu wirbeln die Flasche mit einer Hand und halten die andere Hand bereit, den Hahn schließen. Sobald die Lösung des Analyten in hellrosa Farbe ändert, Wirbel für ein paar Sekunden zu sehen, ob die Farbe verblassen wird. Wenn die Farbe weiterhin besteht, erreicht die Titration der Endpunkt. Der letzte Band der Titriermittel (V1') aufnehmen. Wenn die Lösung Farbe verblasst, fügen Sie einen weiteren Tropfen der Titriermittel. Waschen Sie die untere Spitze der die Bürette mit der Spritzflasche. Sammeln ändern der gewaschenen Mischung und beobachten Sie die Farbe der Analyt-Lösung. Weiter bis zum Endpunkt die Titration. Aufgewendete Titriermittel erforderlich (Vt1 = V1' V1).
- Wiederholen Sie die Titration mindestens doppelt bis drei übereinstimmende Werte, die innerhalb von 0,1 mL voneinander sind (Vt2 und Vt3) gewonnen wird.
- Berechnen Sie den Mittelwert aus Titriermittel Lautstärke mithilfe der drei Werte, die in drei verschiedenen Titrationen: Vt = (Vt1 + Vt2 + Vt3) / 3. Die molare Konzentration der Essigsäure in Essig kann somit mit Gleichung 3berechnet werden.
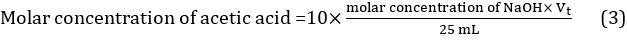
Ergebnisse
| Einheit | Studie 1 | Studie 2 | Studie 3 | |||
| Volumen von verdünntem Essig-Säure (VA) | mL | 25,00 | ||||
| Molare Konzentration von NaOH (CNaOH) | Mol/L | 0.09928 | ||||
| Anfängliche Bürette Lesung von NaOH | mL | 0.10 | 0. 05 | 1.20 | ||
| Endgültige Bürette Lesung von NaOH | mL | 18.75 | 18.60 | 19,80 | ||
| Volumen der NaOH verzichtet | mL | 18,65 | 18.55 | 18.60 | ||
| Mittlere Volumen der NaOH verzichtet (Vt) | mL | 18.60 | ||||
Tabelle 1. Titration Ergebnisse.
Beispielrechnungen:
Masse des KC8H5O4 = 4,0754 g
Molare Masse von KC8H5O4 = 204.22 g/Mol
Anzahl der Mole von KC8H5O4 25,00 mL Standardlösung =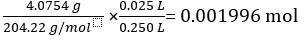
Nach Gleichung 2,
Konzentration der verdünnte NaOH Lösung =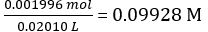
Mol NaOH verzichtet = Konzentration von NaOH × mittlere Volumen der NaOH verzichtet = 0.09928 Mol/L × 18,60 mL = 1.847 × 10-3 Mol
Nach Gleichung 1,
Anzahl der Mol CH3COOH in 25,00 mL verdünntem Essig = 1.847 × 10-3 Mol
Konzentration von verdünntem Essig =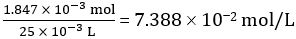
Damit Konzentration von unverdünntem Essig = 10 × 10 7,3882 Mol/L = 0.7388 Mol/L
Die oben genannten Schritte werden vorgestellt, um das Berechnungsverfahren zu veranschaulichen; Wir können einfach gelten die Gleichung 3 um die Konzentration des unverdünnten Essig in einem Schritt zu erhalten.
Daher enthält 1,000 Liter unverdünntem Essig 0.7388 Mol CH3COOH.
Volumen von CH3COOH =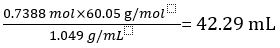
Volumenprozent Essig = 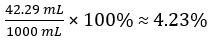
Anwendung und Zusammenfassung
Titration ist eine wichtige chemische Methode, die häufig angewendet wird in der aktuellen Chemie-Forschung. Säure-base-Titration gilt beispielsweise für Amin- oder Hydroxyl-Wert einer Probe zu bestimmen. Der Amin-Wert ist definiert als die Anzahl von mg KOH den Amin-Inhalt in einem Gramm der Probe entspricht. Um die Hydroxylzahl festzustellen, ist die Analyten zunächst acetyliert, mit Essigsäureanhydrid dann titriert mit KOH. Die Masse in mg KOH entspricht dann Hydroxyl-Gruppen in einem Gramm der Probe. 13 ein weiteres Beispiel ist der Winkler-Test, eine bestimmte Art von Redox-Titration verwendet, um die Konzentration an gelöstem Sauerstoff im Wasser für Wasser Qualitätsstudien zu bestimmen. Gelöster Sauerstoff sinkt mit Mangan (II) Sulfat, das reagiert dann mit Kaliumjodid, Jod zu produzieren. Da das Jod freigesetzt direkt proportional zu den Sauerstoffgehalt ist, die Sauerstoffkonzentration Titration Jod mit Thiosulfat mit einer Stärke-Indikator bestimmt. 14
Neben Anwendungen in der chemischen Grundlagenforschung wurde Titration auch in industriellen und täglichen Gebrauch weithin angenommen. In Biodiesel-Industrie müssen Abfälle Pflanzenöl (WVO) zuerst neutralisiert werden, um freie Fettsäuren, die normalerweise reagieren würden, um unerwünschte Seife zu entfernen. Ein Teil der WVO ist titriert mit ein Ausgangspunkt, um die Probe Säure zu bestimmen, also der Rest der Partie richtig neutralisiert werden könnte. 15 Benedikts Methode, ein Test für die Quantifizierung der Urin Glucose-Ebene, ist ein weiteres Beispiel, das zeigt der Bedeutungdes der Titration im Gesundheitswesen. In dieser Titration Kupfer-Ionen reduziert geladene Ionen von Glukose, die dann mit Kalium Thiocyanat bilden einen weißen Niederschlag, unter Angabe des Endpunkts zu reagieren. 16
Tags
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Einführung in die Titration
General Chemistry
425.8K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.4K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.5K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.1K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.9K Ansichten

Ermittlung der Summenformel
General Chemistry
183.9K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.6K Ansichten

Verwendung eines pH-Meters
General Chemistry
347.0K Ansichten

Ideale Gasgleichung
General Chemistry
79.4K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.9K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
265.9K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.8K Ansichten

Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.5K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten