Bestimmung der Ratengleichung und der Reaktionsreihenfolge
Überblick
Quelle: Labor von Dr. Neal Abrams – SUNY College of Environmental Science and Forestry
Alle chemische Reaktionen haben eine spezifische Definition des Fortschritts der Edukte zu Produkten. Diese Rate kann durch Temperatur, Konzentration und die physikalischen Eigenschaften der Edukte beeinflusst werden. Der Preis beinhaltet auch die Zwischenprodukte und Transformationsstaaten, die gebildet werden, aber sind weder die Edukt noch das Produkt. Das Tarif-Gesetz definiert die Rolle der einzelnen Reaktionspartner in einer Reaktion und kann verwendet werden, um den Zeitaufwand für eine Reaktion auf gehen mathematisch zu modellieren. Die allgemeine Form einer Rate Gleichung wird unten gezeigt:
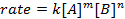
wo A und B Konzentrationen von verschiedenen Molekülsorten, m und n sind sind Reaktion Aufträge, und k ist die Geschwindigkeitskonstante. Die Geschwindigkeit der nahezu jede Reaktion ändert im Laufe der Zeit als Reaktionspartner erschöpft sind, so dass wirksame Kollisionen weniger wahrscheinlich auftreten. Die Rate konstant, ist jedoch für jede einzelne Reaktion bei einer gegebenen Temperatur fixiert. Die Reaktionsordnung zeigt die Anzahl der in einer Reaktion beteiligten molekularen Spezies. Es ist sehr wichtig zu wissen, das Rate Gesetz, einschließlich Rate konstante und Reaktion Anordnung, die nur experimentell ermittelt werden können. In diesem Experiment werden wir eine Methode zur Bestimmung der Geschwindigkeit rechts erkunden und verwenden, um den Fortschritt einer chemischen Reaktion zu verstehen.
Verfahren
1. Vorbereitung H2O2 Verdünnungen
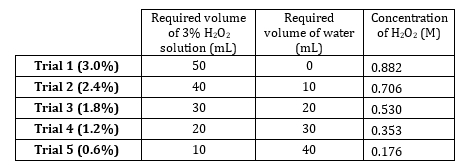
- Lager 3 % Wasserstoffperoxid hat eine Konzentration von 0,882 M. bereiten 5 Verdünnungen von 0,882 M bis hin zu 0,176 M (Tabelle 1). Diese Lösungen volumetrisch vorbereiten, aber sie Additiv vorzubereiten, da der gelöste Stoff sehr verdünnte ist und Wassermengen sind additiv.
- Legen Sie die Lösungen in einem Wasserbad konstante Temperatur oder lassen Sie sie auf die Bank oben nach equilibrate bei Raumtemperatur. Ein Temperaturbe
Ergebnisse
Sauerstoff-Evolution-Data und erste Preise
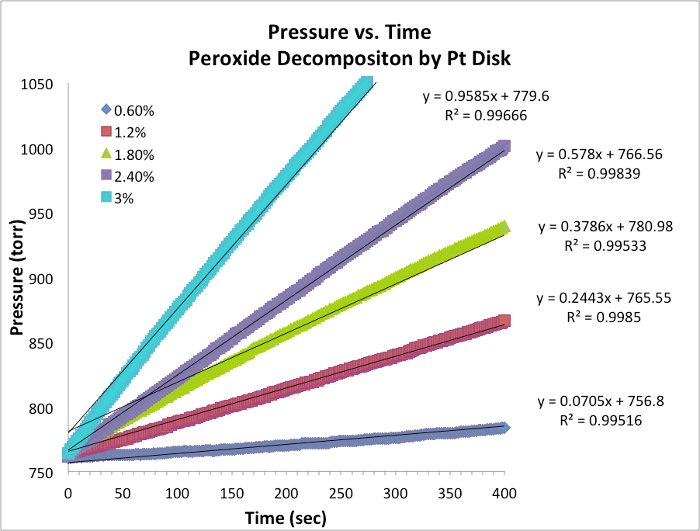
Abbildung 1: Druck vs. Zeitdaten für jeden Versuch bei konstanter Temperatur. Die Steigung entspricht der momentanen Rate der Reaktion.
Reaktionsordnung
- Daten für fünf Versuche und Grafik mit Steigung ist tabellarisch (T...
Anwendung und Zusammenfassung
Während Bestimmung Rate Gesetz Variablen mathematisch beteiligt sein kann, sind die Methoden eigentlich ganz einfach. Solange das Verschwinden der Reaktionspartner oder Erscheinungsform eines Erzeugnisses gemessen werden kann, können Rate Grundstücke verwendet, um die Rate konstant zu berechnen. Eine Erweiterung dieser Methode wird häufig verwendet, um die Aktivierungsenergie einer Reaktion, Eein, bestimmen die Messrate und die Berechnung der Rate konstant bei verschiedenen Temperaturen. Bei dieser Methode...
pringen zu...
Videos aus dieser Sammlung:

Now Playing
Bestimmung der Ratengleichung und der Reaktionsreihenfolge
General Chemistry
196.4K Ansichten

Labor-Glaswaren und deren Verwendung
General Chemistry
659.1K Ansichten

Lösungen und Konzentrationen
General Chemistry
275.4K Ansichten

Bestimmung der Dichte von Fest- und Flüssigstoffen
General Chemistry
557.0K Ansichten

Bestimmung der prozentualen Massenanteile in einer wässrigen Lösung
General Chemistry
383.9K Ansichten

Ermittlung der Summenformel
General Chemistry
183.8K Ansichten

Bestimmung der Löslichkeit von ionischen Verbindungen
General Chemistry
141.6K Ansichten

Verwendung eines pH-Meters
General Chemistry
347.0K Ansichten

Einführung in die Titration
General Chemistry
425.8K Ansichten

Ideale Gasgleichung
General Chemistry
79.4K Ansichten

Spektrophotometrische Bestimmung der Gleichgewichtskonstante
General Chemistry
158.9K Ansichten

Das Prinzip von Le Chatelier
General Chemistry
265.8K Ansichten

Gefrierpunktserniedrigung zur Bestimmung einer unbekannten Substanz
General Chemistry
160.8K Ansichten

Verwendung der dynamischen Differenzkalorimetrie zur Messung von Enthalpieänderungen
General Chemistry
44.8K Ansichten

Komplexchemie
General Chemistry
91.8K Ansichten
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
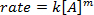 . Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert
. Einnahme von natürlichen Logarithmus (ln) die Gleichung eine linearen Gleichung produziert 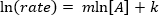 , wo m, die Steigung ist die Reihenfolge der Reaktion.
, wo m, die Steigung ist die Reihenfolge der Reaktion.