Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
ELIME (Enzyme Linked Inmuno magnética químicos) Método para la detección de micotoxinas
En este artículo
Resumen
Un protocolo para detectar tricotecenos (micotoxinas de interés para la salud humana), utilizando un método de selección de nuevo desarrollo basado en un método competitivo inmunoquímica y un final de la detección electroquímica se demuestra.
Resumen
Inmunoensayos son una alternativa válida a la que consumen más caro y HPLC cuantitativa o GC 1, 2 métodos de cribado para la detección de micotoxinas peligrosas en los productos alimenticios. En este protocolo se muestra cómo fabricar e interrogar a una enzima vinculada ensayo electroquímicos competitivos inmunomagnética basado en el uso de partículas magnéticas como soporte sólido para la cadena de inmunoquímica 3 y electrodos serigrafiados como la detección de la plataforma.
Nuestro método tiene como objetivo determinar la cantidad total de HT-2 y las toxinas T-2, las micotoxinas que pertenecen a la familia de los tricotecenos y de gran preocupación para la salud humana 4. El uso de un anticuerpo clon con una reactividad cruzada del 100% para HT-2 y T-2 permite detectar simultáneamente dos toxinas con una sensibilidad similar 5.
El primer paso de nuestro análisis es la etapa de recubrimiento en el que inmovilizar HT2-KLH conjugado toxina en la superficie de partículas magnéticas. Después de una etapa de bloqueo, necesario para evitar absorciones no específicas, la adición de un anticuerpo monoclonal permite la competencia entre los inmovilizados HT-2 y libres presentes HT-2 o T-2 en la muestra o en una solución estándar.
Al final de la etapa de la competencia, la cantidad de anticuerpo monoclonal ligado a la inmovilización HT-2 será inversamente proporcional a la cantidad de toxina en la solución de la muestra.
Un anticuerpo secundario marcado con fosfatasa alcalina (AP) se utiliza para mostrar la unión entre el anticuerpo específico y el inmovilizado HT-2. La etapa de medición final se realiza dejando caer una parte alícuota de la suspensión de cuentas magnéticas, correspondientes a una muestra específica / solución estándar, en la superficie de un electrodo serigrafiado de trabajo, partículas magnéticas se inmovilizan y se concentraron por medio de un imán colocado precisamente bajo el serigrafiado de los electrodos. Después de dos minutos de incubación entre partículas magnéticas y un sustrato de la AP, el producto enzimático es detectado por voltametría de pulso diferencial (DPV), utilizando un equipo portátil (PalmSens) también es capaz de iniciar automáticamente ocho mediciones en un intervalo de pocos segundos.
Protocolo
1) El bloqueo de perlas magnéticas recubiertas con:
Proceder de la siguiente manera para bloquear perlas magnéticas recubiertas con:
- Preparar un conjunto de 2 ml tubos Eppendorf;
- Homogeneizar (temblores, pero no agitación) de perlas magnéticas recubiertas (véase el apéndice para la preparación de perlas magnéticas recubiertas) con la muestra de rotación del mezclador;
- Inmediatamente después de la homogeneización, pipeta de 10 l de perlas magnéticas recubiertas por separado en cada uno de los tubos Eppendorf;
- Añadir 1 ml de leche desnatada solución de bloqueo en cada tubo Eppendorf de la serie;
- Vamos a perlas magnéticas se incuba durante 30 min a temperatura ambiente en el mezclador de rotación de la muestra;
- Retire la solución de bloqueo: para ello se coloca el tubo en el concentrador de partículas magnéticas con la parte magnética para poner en 2 minutos (ver partículas magnéticas se pegue en la pared lateral del tubo); pipeta cuidadosamente el sobrenadante, dejando cuentas sin perturbaciones;
- Añadir 1 ml de tampón PBS + NaN3 + BSA como solución de almacenamiento para cada tubo;
- Tienda recubierto y bloquearon las bolas magnéticas a 4 ° C (por favor, tenga en cuenta que de perlas magnéticas recubiertas son estables durante al menos 2 meses a 4 ° C);
2) la cadena inmunológica en partículas magnéticas para la construcción de la curva de calibración y análisis de las muestras
Proceder de la siguiente manera para que las bolas magnéticas listo para la medición:
- Tome un tubo de Eppendorf (2 ml) de solución de cubierta y bloqueada por cada extracto de muestra que se va a analizar;
- Tomar un extra de tubo de Eppendorf para cada solución calibrador de trabajo;
- Homogeneizar las bolas magnéticas durante 2 minutos en el mezclador de rotación de la muestra antes de su uso;
- Retire el líquido de almacenamiento mediante concentrador de partículas magnéticas;
- Lávese las partículas magnéticas tres veces con solución de lavado PBS / BSA. Eliminar líquido de lavado;
- Paso la competencia: Añadir a cada tubo que contiene las cuentas de lavado magnético, 200μl de la muestra de extracto preparado, el uso de un tubo de cuentas magnéticas para cada muestra. Repita el mismo procedimiento para cada solución estándar. Añadir 200 l de solución de anticuerpos monoclonales para cada tubo de cuentas magnéticas. Vamos a perlas magnéticas se incuba durante una media hora en el mezclador de rotación de la muestra a temperatura ambiente;
- Eliminar de los tubos Eppendorf la solución utilizada para la competición a paso;
- Etiquetado paso: Añadir 400μl del anticuerpo secundario marcado a cada tubo de bolas magnéticas Eppendorf. Vamos a perlas magnéticas se incuba durante una media hora en el mezclador de rotación de la muestra a temperatura ambiente;
- Quitar el etiquetado de los tubos Eppendorf solución;
- Lávese las partículas magnéticas tres veces con PBS / Tween ® 20 solución de lavado. Eliminar el líquido;
- Resuspender con 100μl de buffer DEA cada alícuota de partículas magnéticas. Ahora las bolas magnéticas están listos para la etapa de medición electroquímica;
3) El conjunto de PalmSens con el multiplexor (MUX) opciones
Tenga en cuenta: el producto enzimático de hidrólisis del sustrato faltas la superficie del electrodo, por este motivo un nuevo electrodo que se necesita para cada medición.
- Conectar un PC portátil a PalmSens a través del cable de serie;
- Conecte el conector de 9-DIN de CH8 multiplexor con PalmSens.
- Conecte el cable de serie de ocho canales Mux contacto eléctrico con CH8 multiplexor;
- Coloque la tira de electrodos en el bloque de imán ocho. Preste atención para que cada imán debajo de cada electrodo de trabajo (de la nota, la necesidad de un solo imán para cada electrodo es imprescindible lo contrario, la partícula magnética no se concentrará en el área del electrodo de trabajo);
- Conecte la tira de electrodos en ocho canales de contacto eléctrico Mux;
Para la medición de la DPV utilizar los siguientes parámetros en las casillas correspondientes:
E comenzar: 0 (V); final E: 0,6 (V); paso E: 0.016 (V); E pulso: 0,0339 (V); E acondicionado: 0 (V), deposición de E: 0 (V); Velocidad de lectura : 0,1 (V / s); T pulso: 0,06 (s); acondicionado T: 0 (s), deposición de T: 0 (s) de equilibrio T: 8 (s).
4) una reacción enzimática y medición electroquímica
- Homogeneizar agitando suavemente cada tubo Eppendorf que contiene partículas magnéticas listo para la etapa de medición electroquímica con el fin de obtener una suspensión y dispersión de partículas magnéticas;
- Pipeta de cada Eppendorf, inmediatamente después de la homogeneización, una alícuota de 20 l de la dispersión con bolas magnéticas en la superficie del electrodo de trabajo correspondiente. Para cada electrodo del uso de una franja de 20 l de bolas magnéticas tomadas de diferentes tubos Eppendorf (por ejemplo, para el uso de electrodos ocho ocho diferentes Eppendorf);
- Añadir 80 l de solución de sustrato enzimático en el primer electrodo. Inicio 2 minutos la cuenta regresiva. Después de 14 segundos, añadir 80 l de solución de sustrato enzimático en el segundo electrodo. Después de otros 14 segundos, añadir 80 l de solución de sustrato enzimático en el thiº de los electrodos. Proceder, en el mismo intervalo de tiempo (14 segundos) hasta que el último electrodo (que significa: agacharse cada alícuota de sustrato, con intervalos de 14 segundos). El intervalo de tiempo de 14 segundos se calcula como el tiempo requerido por el potenciostato para realizar la medición de la nota, la solución de 80 l de cada sensor debe cubrir el electrodo de trabajo, referencia y contra. Además, las soluciones para cada sensor no debe entrar en contacto con las soluciones de los electrodos de vecinos.
- Después del minuto 2 la cuenta regresiva de la primera adición de la solución de sustrato enzimático, iniciar la medición electroquímica;
- Utilice el PalmSens Lite para obtener picos de corriente (mA) para cada solución.
5) Cálculo
Establecer una curva de calibración utilizando una ecuación logística cuatro parámetros para calcular la concentración de la cantidad total de toxina HT-2/T-2 en nanogramos por mililitro para cada tubo Eppendorf que contiene la muestra desconocida.
Los datos experimentales, la altura del pico (mA) en contra de la concentración de los calibradores (ng / ml), debe estar equipado con un no-lineal de cuatro parámetros logísticos (4-PL) trama ecuación (1) (con Sigma Plot 8.0 o KaleidaGraph). La no-lineal 4-PL modelo se adopta generalmente para describir los ensayos de unión ligando (LBA) 6.
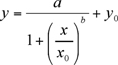 (1)
(1)
a, b, x0, y0 son los parámetros de logística dada por el programa Sigma Plot ajuste de la curva.
Use la fórmula explicada para calcular el contenido de HT-2/T-2 cantidad total de toxina en la solución de extracto de la muestra diluida  (2)
(2)
x es la concentración en masa de la cantidad total de HT-2/T-2 toxinas en la solución del extracto diluido, calculado a partir de la ecuación logística cuatro parámetros en nanogramos por milliltre (ng / ml)
y es el valor actual en mA obtenidos para la muestra desconocida
Apéndice
6) de perlas magnéticas recubiertas
Proceder de la siguiente manera para tener perlas magnéticas recubiertas con:
Procedimiento de lavado
- Homogeneizar tosylactivated Dynabeads ® M-280 (solución madre 2 x 109 cuentas / ml) por agitación y agitación (velocidad máxima) durante 1 min (evitar la formación de espuma) (tenga en cuenta la concentración de partículas magnéticas debe ser siempre la misma para asegurar la reproducibilidad de la medición);
- Inmediatamente pipeta de 1 ml de homogeneizado por encima de las cuentas en un tubo de 2 ml Eppendorf;
- Colocar el tubo en el concentrador de partículas magnéticas con la parte magnética para poner en 2 minutos (ver partículas magnéticas se pegue en la pared lateral del tubo);
- Pipeta cuidadosamente el sobrenadante, dejando inalteradas cuentas;
- Retire el tubo de Eppendorf del concentrador de partículas magnéticas y volver a suspender las bolas en 1 ml de 0,1 M pH 9,5 borato. Mezclar suavemente durante 2 minutos en el mezclador de rotación de la muestra durante 2 minutos;
- Pipeta el sobrenadante;
- Pipeta de 1 ml de solución tampón de borato en el tubo Eppendorf. Partículas magnéticas están listos para el paso de revestimiento;
Proceso de emulsionado
- Añadir 600 ml de HT-2 conjugado con KLH solución stock (hemocianina de lapa californiana) a 1 ml de partículas magnéticas) (final HT-2-KLH concentración de 375 mg / ml); incubar perlas magnéticas y la solución HT-2-KLH para 20h a 37 ° C * con una rotación lenta de inclinación en la rotación de mezclador de la muestra;
- Después de colocar el tubo de incubación en el concentrador de partículas magnéticas y la pipeta el sobrenadante;
Lávese las bolas recubiertas dos veces con 1 ml de solución tampón PBS / BSA. Entre cada lavado eliminar PBS / BSA solución. Todos los pasos de lavado se realizaron entorno perlas magnéticas y PBS / BSA en un mezclador rotatorio durante 5 minutos; - Lávese las bolas magnéticas, una vez utilizando 1 ml de solución tampón TRIS / BSA. Quitar TRIS / solución de BSA. Llevar a cabo este paso mediante el establecimiento de perlas magnéticas y tampón Tris / BSA en la rotación de mezclador de 4 horas a 37 ° C *;
- Lávese las bolas magnéticas con 1 ml de una vez refrescado (conservarse en la nevera a 4 ° C) de PBS / BSA solución buffer. Quitar PBS / BSA solución. Llevar a cabo este paso, establecer las bolas magnéticas y el tampón PBS / BSA en la rotación de mezclador durante 5 minutos a temperatura ambiente;
- Después de la etapa de lavado eliminar todo el líquido de lavado y añadir 1 ml de tampón PBS + NaN3 + BSA como de almacenamiento de líquidos;
- Tienda de perlas magnéticas recubiertas a 4 ° C (por favor, tenga en cuenta que de perlas magnéticas recubiertas son estables durante al menos 2 meses a 4 ° C);
* Para este fin, el mezclador se coloca en el horno equipado con un agujero que permite la inserción de los cables de la fuente de alimentación. Como alternativa, el mezclador puede ser colocado en una habitación con termostato a 37 ° C.
7) Preparación de la muestra y la extracción
25 g demuestra finamente molida (el bebé los cereales del desayuno o la comida) se pesan en un vaso de la licuadora y se extrajo con 100 ml de solución de acetonitrilo / agua (86/14) durante 3 minutos en una batidora de alta velocidad. Después de la centrifugación a 4000 rpm (3000 g) durante 5 minutos, 8 ml de sobrenadante se tomaron y se purifica con la columna Mycosep, 4 ml de extracto de limpieza se secaron bajo corriente de nitrógeno. Las muestras secas se pueden guardar a -30 ° C hasta varios meses.
8) la reconstitución de muestra
Cereales para el desayuno
Reconstituir el extracto seco de cereales de desayuno (comida a base de cereales destinados al consumo para adultos) con 40 ml de PBS pH 7,4. De esta manera, una muestra con una concentración de la toxina igual que el límite legal supone (200 ng / g) se dan en la etapa de medición de una señal cae en el medio del rango de trabajo.
Comida para bebés
Reconstituir el bebé extracto seco de alimentos (comida a base de cereales destinados al consumo infantil) con 4 ml de PBS. De esta manera, una muestra con una concentración de toxinas igual que el límite legal supone (20-25 ng / g) se dan en la etapa de medición de una señal cae en el medio del rango de trabajo.
Access restricted. Please log in or start a trial to view this content.
Discusión
El uso de anticuerpos como la sonda de reconocimiento biomolecular ha visto un uso generalizado de tecnologías de detección, métodos inmunoquímicos de detección, tales como ELISA y Meias, son, hoy en día, entre las plataformas más utilizadas y aplicadas en muchos laboratorios de 7.
Si bien estos enfoques lograr una sensibilidad y especificidad, el objetivo principal de muchos grupos de investigación en los últimos años ha sido la mejora y optimización de sus actuaciones...
Access restricted. Please log in or start a trial to view this content.
Agradecimientos
Los autores desean agradecer a Nancy Downer y todos los miembros del laboratorio de Química Analítica de la Universidad de Roma "Tor Vergata" por su colaboración y apoyo logístico. Este trabajo fue apoyado por el proyecto de la UE "BioCop".
Access restricted. Please log in or start a trial to view this content.
Materiales
Reactivos
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| Cloruro de potasio | Sigma | P9333 | |
| Dihidrógeno fosfato de potasio | Sigma | P9791 | |
| Fosfato disódico de hidrógeno | Sigma | S3264 | |
| Cloruro de sodio | Sigma | S3014 | |
| MgCl2 anhidro | Sigma | M8266 | |
| DEA (99,5%) | Sigma | 31589 | |
| HCl 37% | Sigma | 320331 | |
| H 3 BO 3 | Sigma | B6768 | |
| Tris [hidroximetil]-aminometano | Sigma | 252859 | |
| BSA (albúmina de suero bovino) | Sigma | A4503 | |
| NaOH | Sigma | S5881 | |
| Tween 20 | Sigma | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-naftil fosfato disódico sal | Fluka | N7255 | |
| Solución de leche desnatada bloquear - leche en polvo no grasa | Bio-Rad | 170-6404 | |
| HT-2 conjugado con KLH (hemocianina de lapa californiana), solución de reserva (1 mg / ml en PBS): | Biopure | 004050 | El conjugado HT-2-KLH se obtuvo por el CDI-método en el que la libre circulación de grupos OH en la posición 3 y 4 de la toxina HT-2 fueron activados por N, N'-carbonildiimidazol (CDI) y la activa HT-2 toxina vamos a reaccionar con aminogroups de la proteína (KLH) para generar un vínculo carbammate estable. |
| Anticuerpo secundario marcado: Anti-ratón IgG (H + L) de caballo, conjugado con fosfatasa alcalina, la concentración de 1 mg / ml. | Vector Laboratories | AP-2000 | |
| HT-2 toxina | Biopure | ||
| Partículas magnéticas: Dynabeads ® | Dynal | M-280 Tosylactivated | Concentración de 2 x 10 9 bolas / ml. |
Soluciones
| Nombre del reactivo | Preparación | Comentarios (opcional) |
| Tampón fosfato salino (PBS), pH 7,4 | Disolver 0,20 g de cloruro de potasio, 0,20 g de dihidrógeno fosfato de potasio, 1,16 g de fosfato disódico de hidrógeno y 8,00 g de cloruro de sodio en 900 ml de agua | |
| Dietanolamina de amortiguamiento, la DEA, 0,97 M + 1 mM MgCl 2 + 0,15 M KCl, pH 9,8 | Disolver 0.0476g de MgCl2 anhidro y 7.3.59 g de KCl en ~ 300 ml de agua. Vez disueltos, añadir 51 ml de la DEA (99,5%). Ajustar el pH a 9.8 con HCl (6 M). Diluir hasta 500 ml con agua. | |
| Tampón de borato, 0,1 M, pH 9,5 | Disolver 3,09 g de H 3 BO 3 en ~ 300 ml de agua destilada, ajustar el pH a 9.5 con NaOH y / o HCl (6 M o menor concentración). Diluir hasta 500 ml con agua destilada. | |
| TRIS buffer, 0,2 M, pH 8,5 | Disolver 3,85 g de Tris [hidroximetil]-aminometano en 100 ml de agua. Ajustar el pH a 8.5 con NaOH y / o HCl (6 M o menor concentración). Diluir a 200 ml con agua. | |
| Tampón TRIS + BSA solución (0,1%), pH 8,4 | Disolver 0,050 g de BSA en 50 ml de TRIS buffer de pH 8,4. | Esta solución debe prepararse en el día de uso. |
| Tampón PBS + Tween ® 0,05% | Disolver 0,250 g de Tween 20 en 500 ml del preparado previamente buffer PBS, pH 7,4 | |
| Tampón PBS + BSA solución al 0,1% | Disolver 0,050 g de BSA en 50 ml de PBS, pH 7,3. | Esta solución debe prepararse en el día de uso. |
| Tampón PBS + BSA 0,1% + 0,02% NaN3 | Disolver 0,050 g de BSA y 0.010 de NaN 3 en 50 ml de tampón PBS, pH 7,3. | Almacenamiento de sollución |
| Sustrato enzimático | Disolver 0,010 g de sal 1-naftil fosfato de sodio en 100 ml de buffer de pH 9,8 DEA. Envolver el matraz herméticamente en papel de aluminio. | Esta solución debe prepararse en el día de uso. |
| Solución de leche desnatada bloqueo | Añadir 0,20 g de secante bloqueador de grado de leche sin grasa seca (Bio-Rad, Hercules, CA, EE.UU.) a 200 ml de tampón PBS pH 7,3. | Esta solución debe prepararse en el día de uso. |
| HT-2 de la solución madre | Disolver 10 mg de tricotecenos vial de toxina HT-2, en 10 ml de acetonitrilo para dar una solución con una concentración de 1 mg / ml. | Dividir esta solución en un solo uso alícuotas de 30 ml y guárdelos a menos de -30 ° C. |
| HT-2 la solución de trabajo estándar | Colocar 20 ml de HT-2 toxina solución de reserva en una de 2 ml calibrada matraz aforado y diluir con acetonitrilo para obtener una solución HT-2 de trabajo que contiene 10 mg / ml de toxina tricotecenos. | Esta solución debe prepararse en el día de uso. |
| HT-2 Trabajo soluciones calibrante | Diluir el HT-2 solución patrón de trabajo (10 mg / ml) para preparar una solución de trabajo calibrante 100 ng / ml. Diluir HT-2 Solución de trabajo de calibrante 100 ng / ml para preparar soluciones de trabajo calibrador de las siguientes concentraciones 0 (blanco), 0,5, 1, 2, 4, 10 ng / ml. | Estas soluciones deben estar recién en el día de uso. |
| HT-2 conjugado con KLH | Dividir HT-2 conjugado con KLH solución stock (hemocianina de lapa californiana) (1 mg / ml en PBS) en un solo uso alícuotas de 350 microlitros. | Alícuotas de almacenar a -30 ° C. |
| Anticuerpo monoclonal específico | Diluir 1:350 (v: v) la concentración de acciones (1,383 mg / ml) del anticuerpo monoclonal en PBS para el uso en el paso la competencia | Esta solución debe prepararse en el momento de su uso. 10 ml de solución de anticuerpos en PBS para obtener un volumen de 3,5 ml, son suficientes para analizar las 17 normas y / o muestras. |
| Secundaria de anticuerpos etiquetados | Anti-ratón IgG (H + L) conjugado con fosfatasa alcalina se diluye 1:100 (v: v) en PBS a utilizar en el paso de la competencia. | Una solución de 100 l de valores de anticuerpos en PBS para obtener un volumen final de 10 ml, son suficientes para analizar las normas 25 y / o muestras. Esta solución debe prepararse en el momento de su uso. |
Aparato
| Nombre del reactivo | Empresa | Comentarios (opcional) |
| Concentrador de partículas magnéticas: MPC ®-S | Dynal | |
| PalmSens instrumento | PalmSens | Siempre con PalmSens Lite, el cable de serie de conexión PC portátil y el software de las opciones de Mux |
| CH8 PalmSens multiplexor | PalmSens | |
| Ocho canales de contacto eléctrico Mux | hecho a mano | |
| Tira con ocho electrodos serigrafiados (EFE) | hecho a mano | |
| Apoyo especialmente diseñado para bandas de electrodos | hecho a mano | Incluye 8 imanes de neodimio de cada uno de ellos se coloca debajo de la superficie de cada electrodo de trabajo de la SPE |
| Calibrar pipetas microlitro | Gilson | |
| Agitador magnético y barras de agitación. | ||
| Vasos de vidrio (100, 50, 20 ml). | ||
| Matraces aforados (2 ml). | ||
| 0,2 y 2 ml tubos Eppendorf. | Eppendorf | |
| Falcon ™ tubos de 5 ml y 15 ml. | Halcón | |
| Laboratorio de Vortex Mixer | No utilice vórtex para resuspender perlas magnéticas recubiertas con HT2-KLH o vinculados con la cadena inmunológica para evitar la desnaturalización de las partes proteicas | |
| Horno de laboratorio o una sala con termostato | Elegir un horno capaz de mantener una temperatura de 37 ± 3 ° C. |
Referencias
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados