Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
ELIME (Enzyme Linked Immuno Magnetic électrochimique) Méthode de détection des mycotoxines
Dans cet article
Résumé
Un protocole pour détecter les trichothécènes (mycotoxines de préoccupation pour la santé humaine) en utilisant une méthode de dépistage nouvellement développé basé sur une méthode immunochimique compétitifs et une détection électrochimique dernière est démontrée.
Résumé
Les immunoessais sont une alternative valable à la plus coûteuse en temps et consommer HPLC quantitative ou GC 1, 2 méthodes de dépistage pour la détection de mycotoxines dans les denrées alimentaires dangereuses. Dans ce protocole, nous montrons comment fabriquer et d'interroger une enzyme électrochimique de dosage immuno-concurrentiel lié basé sur l'utilisation de billes magnétiques comme support solide pour la chaîne immunochimiques 3 et électrodes sérigraphiées que la détection de la plate-forme.
Notre méthode vise à déterminer la quantité totale de HT-2 et T-2 toxines, les mycotoxines appartenant à la famille des trichothécènes et de grande préoccupation pour la santé humaine 4. L'utilisation d'un clone d'anticorps avec une réactivité croisée de 100% vers la HT-2 et T-2 permet de détecter simultanément deux toxines avec une sensibilité similaire 5.
La première étape de notre analyse est l'étape de revêtement où nous immobilisent toxine conjugué HT2-KLH sur la surface de billes magnétiques. Après une étape de blocage, nécessaire pour éviter les absorptions non spécifiques, l'ajout d'un anticorps monoclonal permet la concurrence entre immobilisé HT-2 et HT-2 gratuitement ou T-2 présents dans l'échantillon ou dissous dans une solution standard.
A la fin de l'étape la concurrence, la quantité d'anticorps monoclonaux liés à l'immobilisation HT-2 sera inversement proportionnelle à la quantité de toxine dans la solution échantillon.
Un anticorps secondaire marqué à la phosphatase alcaline (AP) est utilisée pour révéler la liaison entre l'anticorps spécifique et l'immobilise HT-2. L'étape finale est effectuée la mesure par la chute d'une partie aliquote de la suspension de billes magnétiques, correspondant à un échantillon / solution de norme spécifique, sur la surface d'un écran-imprimés électrode de travail; billes magnétiques sont immobilisés et concentré au moyen d'un aimant placé exactement sous le sérigraphié électrode. Après deux minutes d'incubation entre les billes magnétiques et un substrat pour l'AP, le produit enzymatique est détecté par Differential Pulse Voltamétrie (DPV) en utilisant un instrument portatif (PalmSens) également en mesure de lancer automatiquement les huit mesures dans un intervalle de quelques secondes.
Protocole
1) Le blocage des billes magnétiques revêtues:
Procédez comme suit pour bloquer billes magnétiques recouvertes:
- Préparer un ensemble de deux tubes Eppendorf ml;
- Homogénéiser (secousses, mais pas vortex) de billes magnétiques recouvertes (voir l'annexe pour la préparation des billes magnétiques recouvertes) en utilisant l'échantillon tournant mélangeur;
- Immédiatement après homogénéisation, une pipette 10 ul de billes magnétiques recouvertes dans chaque tubes Eppendorf distinctes;
- Ajouter 1 ml de lait écrémé en solution de blocage dans chacun des tubes Eppendorf de l'ensemble;
- Laissez les billes magnétiques incuber pendant 30 min à température ambiante sur le mélangeur de l'échantillon en rotation;
- Retirer la solution de blocage: pour ce faire placer le tube dans concentrateur de particules magnétiques avec la partie magnétique mis sur pendant 2 min (voir billes magnétiques coller sur la paroi latérale du tube); soigneusement la pipette le surnageant en laissant intactes perles;
- Ajouter 1 ml de tampon PBS + NaN 3 + BSA comme solution de stockage pour chaque tube;
- Magasin de revêtement et bloqué les billes magnétiques à 4 ° C (s'il vous plaît noter que des billes magnétiques revêtues sont stables pendant au moins 2 mois à 4 ° C);
2) de la chaîne immunologiques sur des billes magnétiques pour la construction de la courbe d'étalonnage et d'analyse d'échantillon
Procédez comme suit pour avoir des billes magnétiques prêt pour la mesure:
- Prenez un tube Eppendorf (2 ml) de solution de revêtement et bloquées pour chaque extrait de l'échantillon que vous allez à analyser;
- Prenez un tube supplémentaire pour chaque Eppendorf solution d'étalonnage de travail;
- Homogénéiser les billes magnétiques pendant 2 min sur le mélangeur échantillon tournant avant utilisation;
- Retirer le liquide de stockage en utilisant concentrateur de particules magnétiques;
- Laver les billes magnétiques à trois reprises avec la solution de lavage PBS / BSA. Retirer liquide de lavage;
- Étape du concours: Ajouter à chaque tube contenant les billes lavées magnétiques, 200 pl de l'échantillon extrait préparé; utiliser un tube de bille magnétique pour chaque échantillon. Répétez la même procédure pour chaque solution standard. Ajouter 200 pi de solution d'anticorps monoclonaux pour chaque tube bille magnétique. Laissez les billes magnétiques incuber pendant une demi-heure sur la table de mixage échantillon tournant à température ambiante;
- Retirer de tubes Eppendorf la solution utilisée pour la compétition-étape;
- Étiquetage étape: Ajouter 400μl d'anticorps secondaire marqué à chaque tube Eppendorf bille magnétique. Laissez les billes magnétiques incuber pendant une demi-heure sur la table de mixage échantillon tournant à température ambiante;
- Enlever étiquette de la solution provenant de tubes Eppendorf;
- Laver les billes magnétiques à trois reprises avec du PBS / Tween ® 20 solution de lavage. Retirer du liquide;
- Resuspendre avec 100 pi de tampon DEA chaque aliquote de billes magnétiques. Maintenant, les billes magnétiques sont prêts pour l'étape de mesure électrochimique;
3) Assemblée des PalmSens avec le multiplexeur (MUX) des options
S'il vous plaît noter: produits d'hydrolyse enzymatique du substrat fautes de la surface de l'électrode, pour cette raison une nouvelle électrode est nécessaire pour chaque mesure.
- Connecter un PC portable à PalmSens par le câble série;
- Connectez la prise DIN du 9-CH8 multiplexeur avec PalmSens.
- Branchez le câble série de huit canaux de contact électrique avec Mux CH8 Multiplexeur;
- Bande d'électrode place sur le bloc aimant huit. Prêtez attention à placer chaque aimant sous chaque électrodes de travail (à noter, la nécessité d'un aimant unique pour chaque électrode est impératif sinon les particules magnétiques ne sera pas concentré sur la zone des électrodes de travail);
- Branchez la bande électrodes en huit canaux contact électrique Mux;
Pour la mesure DPV utiliser les paramètres suivants dans les cases appropriées:
E commencer: 0 (V); fin E: 0,6 (V); étape E: 0,016 (V); impulsion E: 0,0339 (V); E conditionné: le taux de numérisation;:; 0 (V) 0 (V) E dépôt : 0,1 (V / s); T impulsion: 0,06 (s); conditionné T: 0 (s); dépôt T: 0 (s); équilibration T: 8 (s).
4) la réaction enzymatique et mesure électrochimique
- Homogénéiser en agitant chaque tube Eppendorf contenant des billes magnétiques prêt pour l'étape de mesure électrochimique afin d'obtenir une suspension bien dispersée de billes magnétiques;
- Pipette de chaque Eppendorf, immédiatement après homogénéisation, une aliquote de 20 ul de la dispersion par billes magnétiques sur la surface de l'électrode de travail correspondant. Pour chaque électrode d'une utilisation de bande 20 ul de billes magnétiques provenant des tubes Eppendorf différents (par exemple l'utilisation d'électrodes pour huit huit différents Eppendorf);
- Ajouter 80 ul de solution de substrat enzymatique sur la première électrode. Démarrer 2 min décompte. Après 14 secondes, ajouter 80 ul de solution de substrat enzymatique sur la deuxième électrode. Après 14 secondes supplémentaires, ajouter 80 ul de solution de substrat enzymatique sur la troisième électrode. Procéder à l'int en même tempsErval (14 secondes) jusqu'à la dernière électrode (ce qui signifie: déposer chaque aliquote de substrat avec des intervalles de 14 secondes). L'intervalle de temps de 14 sec est calculée comme le temps requis par le potentiostat pour effectuer la mesure; à noter, la solution 80 ul de chaque capteur doit couvrir l'électrode de travail, de référence et de contre. Par ailleurs, les solutions pour chaque capteur ne doit pas entrer en contact avec des solutions d'électrodes voisines.
- Après les 2 min décompte de la première addition de solution de substrat enzymatique, lancer la mesure électrochimique;
- Utilisez le PalmSens Lite logiciel pour obtenir des pics de courant (mA) pour chaque solution.
5) Calcul
Établir une courbe d'étalonnage en utilisant une équation logistique à 4 paramètres et de calculer la concentration du total des HT-2/T-2 montant de toxine en nanogrammes par millilitre pour chaque tube Eppendorf contenant l'échantillon inconnu.
Les données expérimentales, la hauteur du pic (uA) contre la concentration de l'calibrants (ng / ml), doivent être équipés avec un non-linéaire à quatre paramètres logistiques (4-PL) tracer l'équation (1) (en utilisant Terrain Sigma 8.0 ou Kaleidagraph). Le non-linéaire 4-PL modèle est généralement adopté pour décrire les essais de liaison du ligand (LBA) 6.
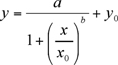 (1)
(1)
a, b, x0, y0 sont des paramètres logistiques comme donné par le programme tracé Sigma ajustement de la courbe.
Utilisez la formule explicitées pour calculer la teneur des HT-2/T-2 montant total de toxines dans la solution d'extrait échantillon dilué  (2)
(2)
x est la concentration massique de la quantité totale de toxines HT-2/T-2 dans la solution d'extrait dilué, calculé à partir de l'équation logistique à 4 paramètres en nanogramme par milliltre (ng / ml)
y est la valeur actuelle en uA obtenus pour l'échantillon inconnu
Annexe
6) de billes magnétiques recouvertes
Procédez comme suit pour avoir des billes magnétiques revêtues:
Procédure de lavage
- Homogénéiser Dynabeads tosylactivated ® M-280 (solution stock 2 x 109 billes / ml) en agitant et en vortex (vitesse max) pendant 1 min (éviter de faire mousser) (S'il vous plaît noter la concentration de billes magnétiques a besoin d'être toujours le même pour assurer la reproductibilité de la mesure);
- Immédiatement pipette de 1 ml de billes au-dessus homogénéisé dans un tube Eppendorf de 2 ml;
- Placer le tube dans concentrateur de particules magnétiques avec la partie magnétique mis sur pendant 2 min (voir billes magnétiques coller sur la paroi latérale du tube);
- Soigneusement pipette le surnageant en laissant intactes perles;
- Retirez le tube Eppendorf du concentrateur de particules magnétiques et remettre en suspension les perles dans 1 ml de 0,1 M pH tampon borate 9,5. Mélanger doucement pendant 2 min dans le mélangeur échantillon tournant pendant 2 min;
- Pipeter le surnageant;
- Pipeter 1 ml de solution tampon de borate dans le tube Eppendorf. Les billes magnétiques sont maintenant prêtes pour l'étape d'enrobage;
Procédure de revêtement
- Ajouter 600 ml de HT-2 conjugué avec une solution stock de KLH (Keyhole Limpet Keyhole) à 1 ml de billes magnétiques) (dernière HT-2-KLH concentration de 375 mg / ml); incubation des billes magnétiques et HT-2-KLH solution pour 20h à 37 ° C * avec une rotation lente sur le tilt rotation mélangeur d'échantillons;
- Après une incubation lieu le tube dans le concentrateur de particules magnétiques et la pipette le surnageant;
Lavez billes revêtues deux fois avec 1 ml de solution tampon PBS / BSA. Entre chaque lavage retirer PBS / BSA solution. Toutes les étapes de lavage ont été effectués mise en billes magnétiques et PBS / BSA sur mélangeur rotatif pendant 5 min; - Laver les billes magnétiques fois en utilisant 1 ml de solution tampon Tris / BSA. Retirer TRIS / solution de BSA. Effectuer cette étape en fixant des billes magnétiques et TRIS / BSA tampon sur tournante mélangeur pendant 4 h à 37 ° C *;
- Laver les billes magnétiques fois en utilisant 1 ml de rafraîchi (conservés au réfrigérateur à 4 ° C) PBS / BSA solution tampon. Retirer du PBS / BSA solution. Effectuer cette étape de réglage des billes magnétiques et de tampon PBS / BSA sur la rotation de mixage pour 5min à température ambiante;
- Après l'étape de lavage supprimer tous les liquides de lavage et ajouter 1 ml de tampon PBS + NaN 3 + BSA comme liquide de conservation;
- Magasin de billes magnétiques recouvertes à 4 ° C (s'il vous plaît noter que des billes magnétiques revêtues sont stables pendant au moins 2 mois à 4 ° C);
* A cet effet, le mélangeur est placé dans un four équipé d'un trou qui permet l'insertion du câble pour l'alimentation. Alternativement, le mélangeur peut être placé dans une chambre thermostatée à 37 ° C.
La préparation des échantillons 7) et l'extraction
25 g d'échantillon finement broyé (céréales pour bébés nourriture ou petit déjeuner), nous sommesighed dans un récipient du mélangeur et extrait avec 100 ml d'acétonitrile / solution d'eau (86/14) pendant 3 min dans un mélangeur à haute vitesse. Après centrifugation à 4000 rpm (3000 g) pendant 5 min, 8 ml de surnageant ont été prélevés et purifiés avec colonne Mycosep, 4 ml de l'extrait nettoyées ont été séchés sous flux d'azote. Échantillons séchés peuvent être stockés à -30 ° C jusqu'à plusieurs mois.
8) la reconstitution échantillon
Céréales pour petit déjeuner
Reconstituer l'extrait le petit déjeuner de céréales sèches (nourriture à base de céréales destinés à la consommation des adultes) avec 40 ml de PBS pH 7,4. De cette manière, un échantillon avec une concentration de toxine égale à la limite légale supposée (200 ng / g) donnera à l'étape de mesure d'un signal tombant au milieu de la plage de travail.
La nourriture pour bébé
Reconstituer l'extrait sec d'aliments pour bébés (aliments à base de céréales destinés à la consommation infantile) avec 4 ml de PBS. De cette manière, un échantillon avec une concentration de toxines égale à la limite légale supposée (20-25 ng / g) donnera à l'étape de mesure d'un signal tombant au milieu de la plage de travail.
Access restricted. Please log in or start a trial to view this content.
Discussion
L'utilisation d'anticorps comme sonde de reconnaissance biomoléculaire a vu une utilisation généralisée des technologies de détection; méthodes de détection immunochimiques, tels que ELISA et MEIAs, sont, aujourd'hui, parmi les plateformes les plus utilisées et appliquées dans de nombreux laboratoires 7.
Bien que ces approches obtenir une sensibilité et une spécificité exceptionnelle, un objectif premier de nombreux groupes de recherche dans les dernières ...
Access restricted. Please log in or start a trial to view this content.
Remerciements
Auteurs tiens à remercier Nancy Downer et tous les membres du laboratoire de Chimie Analytique, Université de Rome "Tor Vergata" pour leur collaboration et le soutien logistique. Ce travail a été soutenu par le projet européen "BioCop".
Access restricted. Please log in or start a trial to view this content.
matériels
Réactifs
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
| Le chlorure de potassium | Sigma | P9333 | |
| Phosphate monopotassique | Sigma | P9791 | |
| Phosphate disodique | Sigma | S3264 | |
| Le chlorure de sodium | Sigma | S3014 | |
| MgCl 2 anhydre | Sigma | M8266 | |
| DEA (99,5%) | Sigma | 31589 | |
| HCl 37% | Sigma | 320331 | |
| H 3 BO 3 | Sigma | B6768 | |
| Tris [hydroxyméthyl] aminométhane | Sigma | 252859 | |
| BSA (albumine sérique bovine) | Sigma | A4503 | |
| NaOH | Sigma | S5881 | |
| TWEEN 20 | Sigma | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-naphtyl phosphate de disodium | Fluka | N7255 | |
| Solution de lait écrémé blocage - de lait écrémé sec | Bio-Rad | 170-6404 | |
| HT-2 conjugué avec KLH (Keyhole Limpet Keyhole), solution mère (1 mg / ml dans PBS): | Biopure | 004050 | Le conjugué HT-2-KLH a été obtenue par le CDI-méthode où la libre circulation des groupes OH en position 3 et 4 de la toxine HT-2 ont été activés par le N, N'-carbonyldiimidazole (CDI) et l'activation de toxine HT-2 a été laissez réagir avec groupes amino de la protéine (KLH) pour générer un lien carbammate stable. |
| Secondaire anticorps marqué: IgG anti-souris (H + L) de cheval, conjugué à la phosphatase alcaline, la concentration de 1 mg / ml. | Vector Laboratories | AP-2000 | |
| La toxine HT-2 | Biopure | ||
| Les billes magnétiques: Dynabeads ® | Dynal | M-280 Tosylactivated | Concentration 2 x 10 9 billes / ml. |
Solutions
| Nom du réactif | Préparation | Commentaires (optionnel) |
| Tampon phosphate salin (PBS), pH 7,4 | Dissoudre 0,20 g de chlorure de potassium, 0,20 g de dihydrogénophosphate de potassium, 1,16 g de phosphate disodique et 8,00 g de chlorure de sodium dans 900 ml d'eau | |
| Tampon diéthanolamine, DEA, 0,97 m + 1 mM de MgCl2 + 0,15 M de KCl, pH 9,8 | Dissoudre 0.0476g de MgCl 2 anhydre et 7.3.59 g de KCl dans ~ 300 ml d'eau. Après dissolution, ajouter 51 ml de DEA (99,5%). Ajuster le pH à 9,8 avec HCl (6 M). Diluer à 500 ml avec de l'eau. | |
| Tampon borate 0,1 M pH 9,5 | Dissoudre 3,09 g de H 3 BO 3 en ~ 300 ml d'eau distillée, ajuster le pH à 9,5 avec NaOH et / ou HCl (6 M ou des concentrations plus faibles). Diluer à 500 ml d'eau distillée. | |
| Tampon TRIS, 0,2 M, pH 8,5 | Dissoudre 3,85 g de Tris [hydroxyméthyl] aminométhane dans 100 ml d'eau. Ajuster le pH à 8,5 avec NaOH et / ou HCl (6 M ou des concentrations plus faibles). Diluer à 200 ml avec de l'eau. | |
| Tampon TRIS + BSA solution (0,1%), pH 8,4 | Dissoudre 0,050 g de BSA dans 50 ml de tampon TRIS pH 8,4. | Cette solution doit être fraîchement préparée le jour d'utilisation. |
| Tampon PBS + TWEEN ® 0,05% | Dissoudre 0,250 g de Tween 20 dans 500 ml de tampon PBS préparé préalablement, pH 7,4 | |
| Tampon PBS + BSA solution à 0,1% | Dissoudre 0,050 g de BSA dans 50 ml de tampon PBS, pH 7,3. | Cette solution doit être fraîchement préparée le jour d'utilisation. |
| Tampon PBS + BSA 0,1% + 0,02% NaN3 | Dissoudre 0,050 g de BSA et 0,010 de NaN 3 dans 50 ml de tampon PBS, pH 7,3. | Stockage Solution |
| Substrat enzymatique | Dissoudre 0,010 g de 1-naphtyl phosphate de sel de sodium dans 100 ml de tampon DEA pH 9,8. Envelopper le ballon d'serré dans du papier aluminium. | Cette solution doit être fraîchement préparée le jour d'utilisation. |
| Solution de lait écrémé bloquant | Ajouter 0,20 g de Blotting grade bloqueur non-lait écrémé en poudre (Bio-Rad, Hercules, CA, USA) pour 200 ml de tampon PBS pH 7,3. | Cette solution doit être fraîchement préparée le jour d'utilisation. |
| Solution stock HT-2 | Dissoudre 10 mg de trichothécènes HT-2 flacon de toxine, dans 10 ml d'acétonitrile pour donner une solution avec une concentration de 1 mg / ml. | Répartis cette solution dans des aliquotes à usage unique de 30 ml et de les stocker à moins de -30 ° C. |
| HT-2 Solution étalon de travail | Pipeter 20 ml de HT-2 solution stock de toxine dans un 2 ml calibré fiole jaugée et diluer avec de l'acétonitrile pour obtenir une solution HT-2 de travail contenant 10 ug / ml de toxine trichothécènes. | Cette solution doit être fraîchement préparée le jour d'utilisation. |
| HT-2 solutions calibrant travail | Diluer le HT-2 solution étalon de travail (10 pg / ml) pour préparer la solution de travail calibrant 100 ng / ml. Diluer HT-2 travaille solution d'étalonnage à 100 ng / ml pour préparer des solutions de travail calibrant des concentrations suivantes 0 (blanc), 0,5, 1, 2, 4, 10 ng / ml. | Ces solutions doivent être fraîchement préparés le jour d'utilisation. |
| HT-2 conjugué avec KLH | Répartis HT-2 conjugué avec une solution stock de KLH (Keyhole Limpet Keyhole) (1 mg / ml dans PBS) en usage unique des aliquotes de 350 pi. | Aliquotes magasin à -30 ° C. |
| Anticorps monoclonal spécifique | Diluer 1:350 (v: v) la concentration des stocks (1,383 mg / ml) d'anticorps monoclonaux dans le PBS à utiliser dans l'étape la compétition | Cette solution doit être fraîchement préparés au moment de l'utiliser. 10 ml de solution mère d'anticorps dans PBS pour un volume final de 3,5 ml, sont suffisantes pour analyser les 17 normes et / ou des échantillons. |
| Secondaire anticorps marqué | IgG anti-souris (H + L), conjugué à la phosphatase alcaline est dilué 1:100 (v: v) dans du PBS à utiliser dans l'étape concurrence. | Solution 100 ul d'actions d'anticorps dans PBS pour un volume final de 10 ml, sont suffisantes pour analyser les 25 normes et / ou des échantillons. Cette solution doit être fraîchement préparés au moment de l'utiliser. |
Un appareil
| Nom du réactif | Société | Commentaires (optionnel) |
| Concentrateur de particules magnétiques: MPC-S ® | Dynal | |
| Instrument PalmSens | PalmSens | Fourni avec PalmSens Lite, Serial PC portable câble de connexion et le logiciel Mux options |
| CH8 PalmSens Multiplexeur | PalmSens | |
| Huit canaux de contact Mux électriques | fabriqués à la main | |
| Bande avec huit électrodes sérigraphiées (EVS) | fabriqués à la main | |
| Spécialement conçu pour soutenir la bande électrodes | fabriqués à la main | Comprend 8 aimants néodyme dont chacune est placée en dessous de chaque surface de l'électrode de travail de la SPE |
| Pipettes calibrées microlitre | Gilson | |
| Agitateur magnétique et barreaux d'agitation. | ||
| Béchers en verre (100, 50, 20 ml). | ||
| Fioles jaugées (2ml). | ||
| 0.2 et 2ml tubes Eppendorf. | Eppendorf | |
| Tubes Falcon ™ de 5ml et 15ml. | Falcon | |
| Laboratoire Vortex | Ne pas utiliser vortex pour resuspendre billes magnétiques recouvertes d'HT2-KLH ou liés à la chaîne immunologiques afin d'éviter la dénaturation des pièces protéiques | |
| Four de laboratoire ou la salle thermostaté | Choisissez un four capable de garder une température de 37 ± 3 ° C. |
Références
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon