Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
ELIME (Enzyme Linked Immuno Magnetic Elektrochemische) Verfahren zur Mykotoxin-Erkennung
In diesem Artikel
Zusammenfassung
Ein Protokoll, um Trichothecene (Mykotoxine, die für die menschliche Gesundheit) mit einem neu entwickelten Screening-Methode auf einem wettbewerbsfähigen immunchemischen Verfahren und eine endgültige elektrochemischer Detektion basierte Erkennung demonstriert.
Zusammenfassung
Immunoassays sind eine gültige Alternative zu den teuren und zeitaufwendigen quantitative HPLC-oder GC-1, 2 Methoden für das Screening Erkennung von gefährlichen Mykotoxinen in Nahrungsmitteln. In diesem Protokoll zeigen wir, wie zu fertigen und zu verhören einen elektrochemischen wettbewerbsfähigen enzyme linked immunomagnetische Assay, der auf die Verwendung von magnetischen Kügelchen als feste Unterstützung für den immunchemischen Kette 3 und Siebdruck-Elektroden als sensing-Plattform.
Unsere Methode zielt darauf ab, den Gesamtbetrag der HT-2 und T-2-Toxine, Mykotoxine aus der Trichothecene Familie und von großer Bedeutung für die menschliche Gesundheit 4 zu bestimmen. Der Einsatz eines Antikörpers Klon mit einer Kreuzreaktivität von 100% gegenüber HT-2 und T-2 ermöglicht die gleichzeitige Nachweis beider Toxine mit ähnlicher Empfindlichkeit 5.
Der erste Schritt unseres Tests ist die Beschichtung Schritt, wo wir immobilisieren HT2-KLH-Konjugat-Toxin auf die Oberfläche des magnetischen Kügelchen. Nach einem Blocking-Schritt notwendig, um unspezifische Absorptionen zu vermeiden, kann die Zugabe eines monoklonalen Antikörpers die Konkurrenz zwischen immobilisierten HT-2-und HT-2-freien oder T-2 in der Probe vorhanden oder gelöst in einem Standard-Lösung.
Am Ende des Wettbewerbs Schritt, die Höhe des monoklonalen Antikörpers verknüpft die immobilisierten HT-2 ist umgekehrt proportional zur Menge des Toxins in der Probelösung.
Ein sekundärer Antikörper mit alkalischer Phosphatase (AP) bezeichnet wird verwendet, um die Bindung zwischen den spezifischen Antikörper und dem immobilisierten HT-2 offenbaren. Die abschließende Messung Schritt wird durch Fallenlassen eines Aliquots Magnetic-Bead-Suspension durchgeführt, das entspricht einer spezifischen Probe / Standard-Lösung auf der Oberfläche eines Siebdruck-Arbeitselektrode; magnetischen Beads immobilisiert und mit Hilfe eines Magneten genau unter dem platziert konzentriert Siebdruck-Elektrode. Nach zwei Minuten der Inkubation zwischen magnetischen Kügelchen und ein Substrat für AP, ist die enzymatische Produkt durch Differential-Puls-Voltammetrie (DPV) mit einem tragbaren Gerät (PalmSens) auch in der Lage, automatisch acht Messungen in einem Intervall von wenigen Sekunden starten erkannt.
Protokoll
1) Blocking beschichteten magnetischen Kügelchen:
Gehen Sie wie folgt zu beschichteten magnetischen Kügelchen Block:
- Einen Satz von 2 ml Eppendorf-Röhrchen;
- Homogenisieren (Schütteln, aber nicht Vortexen) beschichteten magnetischen Kügelchen (siehe Anhang für die Herstellung von beschichteten magnetischen Kügelchen) mit der Probe rotierenden Mischer;
- Unmittelbar nach der Homogenisierung, Pipette 10 ul der beschichteten magnetischen Kügelchen in jedem einzelnen Eppendorf-Röhrchen;
- Add 1 ml Magermilch blockiert Lösung in jedes Eppendorf-Röhrchen des Satzes;
- Lassen magnetischen Beads für 30 min bei Raumtemperatur auf der rotierenden Probe Mischer inkubieren;
- Entfernen Blockierungslösung: dazu wird das Reagenzglas in magnetischen Partikel-Konzentrator mit den magnetischen Teil legte für 2 min (siehe magnetische Kügelchen kleben an der Seitenwand des Rohres); sorgfältig Pipette aus dem Überstand, so dass Perlen ungestört;
- 1 ml PBS-Puffer + NaN 3 + BSA als Storage-Lösung für jede Röhre;
- Shop beschichtet und blockiert magnetischen Beads bei 4 ° C (bitte beachten Sie, dass beschichteten magnetischen Kügelchen stabil sind für mindestens 2 Monate bei 4 ° C);
2) Immunologische Kette auf magnetische Kügelchen für den Bau der Kalibrierkurve und Analyse von Proben
Gehen Sie wie folgt an magnetische Kügelchen bereit für die Messung haben:
- Nehmen Sie eine Eppendorf-Röhrchen (2 ml) von beschichteten und blockierten Lösung für jede Probe zu extrahieren willst du zu analysieren sind;
- Ein Extra-Eppendorf-Röhrchen für jeden Arbeitstag Kalibrierlösung;
- Homogenisieren magnetischen Beads für 2 min auf der rotierenden Probe Mischer vor dem Einsatz;
- Entfernen Lagerflüssigkeit mittels magnetischer Partikel Konzentrator;
- Wash magnetischen Beads dreimal mit PBS / BSA Waschlösung. Entfernen Waschflüssigkeit;
- Wettbewerb Schritt: Fügen Sie für jedes Röhrchen mit den gewaschenen magnetische Kügelchen, 200 ul der Probe zu extrahieren vorbereitet, verwenden Sie eine Magnetic-Bead-Röhrchen für jede Probe. Wiederholen Sie diesen Vorgang für jeden Standard-Lösung. Geben Sie 200 ul des monoklonalen Antikörpers Lösung für jedes Magnetic-Bead-Rohr. Lassen magnetischen Beads für eine halbe Stunde auf der rotierenden Probe Mischer bei Raumtemperatur inkubieren;
- Remove from Eppendorf-Röhrchen die Lösung für die Wettbewerbs-Schritt verwendet;
- Labeling Schritt: Fügen Sie 400μl der markierten sekundären Antikörper gegen jedes Magnetic-Bead-Eppendorf-Röhrchen. Lassen magnetischen Beads für eine halbe Stunde auf der rotierenden Probe Mischer bei Raumtemperatur inkubieren;
- Entfernen Sie die Kennzeichnung Lösung von Eppendorf-Röhrchen;
- Wash magnetischen Beads dreimal mit PBS / Tween ® 20 Waschlösung. Entfernen Sie die Flüssigkeit;
- Resuspendieren mit 100 &mgr; l der DEA-Puffer jedem Aliquot von magnetischen Kügelchen. Nun ist die magnetische Kügelchen sind bereit zur elektrochemischen Messung Schritt;
3) Montage von PalmSens mit Multiplexer (Mux) Optionen
Bitte beachten Sie: enzymatische Produkt Substrathydrolyse Fouls der Elektrodenoberfläche, aus diesem Grund eine neue Elektrode ist für jede Messung benötigt.
- Schließen Sie einen PC Laptop PalmSens über das serielle Kabel;
- Verbinden Sie den 9-DIN-Stecker des CH8 Multiplexer mit PalmSens.
- Schließen Sie serielle Kabel der Acht-Kanal Mux elektrischen Kontakt mit CH8 Multiplexer;
- Die Elektrodenspitze Streifen auf den acht Magneten blockieren. Achten Sie auf jeden Magneten unter jedem Arbeitstag Elektroden Ort (beachten Sie, dass die Notwendigkeit eines einzigen Magneten für jede Elektrode Imperativ sonst die magnetischen Partikel werden nicht auf der Arbeitselektrode Bereich konzentriert werden);
- Stecken Sie in Elektroden Streifen in Acht-Kanal-Mux elektrischen Kontakt;
Für DPV-Messung die folgenden Parameter in die entsprechenden Felder:
E beginnen: 0 (V); E Ende: 0,6 (V); E Schritt: 0,016 (V); E-Impuls: 0,0339 (V); E Konditionierung: 0 (V); E Deposition: 0 (V); Scan-Rate : 0,1 (V / s); T Puls: 0,06 (s); T Konditionierung: 0 (s); T Deposition: 0 (s); T Equilibrierung: 8 (s).
4) Die enzymatische Reaktion und elektrochemischen Messung
- Homogenisieren durch leichtes Schütteln jedes Eppendorf-Röhrchen mit magnetischen Beads bereit zur elektrochemischen Messung Schritt, um eine gut dispergierte Suspension von magnetischen Kügelchen zu erhalten;
- Pipette aus jedem Eppendorf, unmittelbar nach der Homogenisierung, ein Aliquot von 20 ul des Magnetic-Bead-Dispersion auf der entsprechenden Arbeitsgruppe Elektrodenoberfläche. Für jede Elektrode einen Streifen verwenden 20 ul magnetische Perlen aus verschiedenen Eppendorf-Röhrchen (zB für acht Elektrode verwendet acht verschiedene Eppendorf) übernommen;
- Add 80 ul der enzymatischen Substrat-Lösung auf der ersten Elektrode. Start 2 min count down. Nach 14 sec, fügen Sie 80 ul der enzymatischen Substrat-Lösung auf der zweiten Elektrode. Nach weiteren 14 sec, fügen Sie 80 ul der enzymatischen Substrat-Lösung auf der dritten Elektrode. Gehen Sie zur gleichen Zeit intErval (14 Sekunden), bis der letzte Elektrode (das heißt: drop jedem Aliquot des Substrates mit Intervallen von 14 sec). Das Intervall von 14 Sekunden wird die Zeit durch den Potentiostaten um die Messung durchzuführen benötigt berechnet; der Anmerkung, die 80 ul Lösung auf jeden Sensor sollte die Arbeits-, Referenz-und Gegenelektrode zu decken. Darüber hinaus sollten die Lösungen für jeden Sensor nicht in Berührung kommen, mit Lösungen von benachbarten Elektroden.
- Nach dem 2 min Countdown von der ersten Zugabe von enzymatischen Substrat-Lösung, starten Sie den elektrochemischen Messung;
- Verwenden Sie die PalmSens Lite Software Stromspitzen (uA) für jede Lösung zu erhalten.
5) Berechnung
Stellen Sie eine Eichkurve mit einer logistischen 4 Parameter-Gleichung und berechnen Sie die Konzentration der gesamten HT-2/T-2 Toxin Menge in Nanogramm pro Milliliter für jedes Eppendorf-Röhrchen mit unbekannten Probe.
Die experimentellen Daten, Peakhöhe (uA) gegen die Konzentration der Kalibrierstandards (ng / ml), müssen ausgestattet mit einem nicht-linearen Vier-Parameter logistische (4-PL) Gleichung Grundstück (1) (mit Sigma Plot 8.0 oder sein Kaleidagraph). Die nichtlineare 4-PL-Modell ist in der Regel angenommen, um Ligandenbindungsassays (LBAs) 6 beschreiben.
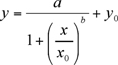 (1)
(1)
a, b, x0, y0 sind logistische Parameter wie die Sigma Plot Kurvenanpassung Programms.
Verwenden Sie die Formel expliziert, um den Inhalt HT-2/T-2 Toxin Gesamtbetrag in der verdünnten Probe Extraktlösung berechnen  (2)
(2)
x ist die Massenkonzentration der Gesamtbetrag der HT-2/T-2 Toxine in die verdünnte Extrakt-Lösung, aus der Logistik-4 Parameter Gleichung in Nanogramm pro milliltre (ng / ml) berechnet
y wird der aktuelle Wert in uA für die unbekannte Probe erhalten
Appendix
6) beschichteten magnetischen Kügelchen
Gehen Sie wie folgt zu beschichteten magnetischen Kügelchen haben:
Waschverfahren
- Homogenisieren tosylactivated Dynabeads ® M-280 (Stammlösung 2 x 109 Beads / ml) durch Schütteln und Vortexen (max. Geschwindigkeit) für 1 min (Schaumbildung vermeiden) (bitte beachten Sie die Konzentration von magnetischen Kügelchen muss dabei immer die gleichen, um die Reproduzierbarkeit zu gewährleisten in der Messung);
- Unmittelbar Pipette 1 ml der oben homogenisiert Perlen in ein 2 ml Eppendorf-Röhrchen;
- Das Röhrchen wird in magnetische Partikel-Konzentrator mit den magnetischen Teil legte für 2 min (siehe magnetische Kügelchen kleben an der Seitenwand der Röhre);
- Sorgfältig Pipette aus dem Überstand, so dass Perlen ungestört;
- Entfernen Sie die Eppendorf-Röhrchen aus der magnetischen Partikel-Konzentrator und Resuspendieren der Beads in 1 ml 0,1 M Boratpuffer pH 9,5. Vorsichtig mischen für 2 min in der rotierenden Probe-Mischer für 2 min;
- Pipette aus dem Überstand;
- 1 ml Boratpuffer-Lösung in das Eppendorf-Röhrchen. Magnetic Beads sind nun bereit für die Beschichtung Schritt;
Coating Verfahren
- Add 600 ml HT-2 konjugiert mit KLH (Keyhole Limpet Hämocyanin) Stammlösung auf 1 ml der magnetischen Beads) (final HT-2-KLH-Konzentration von 375 mg / ml); inkubieren magnetischen Beads und HT-2-KLH-Lösung für 20h bei 37 ° C * mit langsamen Neigung Rotation auf rotierenden Probe Mischer;
- Nach der Inkubation wird das Reagenzglas in die magnetischen Partikel-Konzentrator und Pipette aus dem Überstand;
Wash beschichteten Beads zweimal mit 1 ml PBS / BSA-Puffer-Lösung. Zwischen jedem Waschen entfernen PBS / BSA-Lösung. Alle Waschschritt durchgeführt Einstellung magnetischen Beads und PBS / BSA auf rotierenden Mischer für 5 min; - Wash magnetischen Beads einmal mit 1 ml TRIS / BSA-Puffer-Lösung. Entfernen TRIS / BSA-Lösung. Führen Sie diesen Schritt, indem magnetischen Beads und TRIS / BSA-Puffer auf rotierenden Mischer für 4 h bei 37 ° C *;
- Wash magnetischen Beads einmal mit 1 ml aktualisiert (gehalten im Kühlschrank bei 4 ° C) PBS / BSA-Puffer-Lösung. Entfernen PBS / BSA-Lösung. Führen Sie diesen Schritt Einstellung magnetischen Beads und PBS / BSA-Puffer auf rotierenden Mischer für 5min bei Raumtemperatur;
- Nach dem Waschen Schritt entfernen Sie alle Waschflüssigkeit und 1 ml PBS-Puffer + NaN 3 + BSA als Speicher Flüssigkeit;
- Shop beschichteten magnetischen Kügelchen bei 4 ° C (bitte beachten Sie, dass beschichteten magnetischen Kügelchen stabil sind für mindestens 2 Monate bei 4 ° C);
* Zu diesem Zweck wird der Mischer in den Ofen mit einem Loch, die das Einführen des Kabels für die Stromversorgung ermöglicht ausgestattet ist. Alternativ kann der Mixer konnte in einem thermostatisierten Raum bei 37 ° C.
7) Probenvorbereitung und Extraktion
25 g fein gemahlene Probe (Babynahrung oder Müsli) sind wirighed in einen Mixbecher und extrahiert mit 100 ml Acetonitril / Wasser-Lösung (86/14) für 3 min in einem High-Speed-Mixer. Nach Zentrifugation bei 4000 rpm (3000 g) für 5 min, 8 ml des Überstands wurden entnommen und mit Mycosep Säule wurden 4 ml des gereinigten Extrakt unter einem Stickstoffstrom getrocknet. Getrocknete Proben können bei -30 ° C gelagert werden bis zu mehreren Monaten.
8) Beispiel Rekonstitution
Frühstückscerealien
Bereiten Sie die getrockneten Frühstücksflocken-Extrakt (Lebensmittel mit Getreideflocken für erwachsene Verzehr bestimmt sind) mit 40 ml PBS pH 7,4. Auf diese Weise eine Probe mit einer Konzentration von Toxin gleich den vermeintlichen gesetzlichen Grenzwert (200 ng / g) wird in der Messung Schritt ein Signal geben, fällt in der Mitte des Arbeitsbereiches.
Babynahrung
Bereiten Sie die getrockneten Babynahrung Extrakt (Lebensmittel mit Getreideflocken für Kleinkinder Verzehr bestimmt sind) mit 4 ml PBS. Auf diese Weise eine Probe mit einer Konzentration von Giftstoffen in Höhe der angeblichen gesetzlichen Grenzwert (20-25 ng / g) wird in der Messung Schritt ein Signal geben, fällt in der Mitte des Arbeitsbereiches.
Access restricted. Please log in or start a trial to view this content.
Diskussion
Die Verwendung von Antikörpern als biomolekularen Erkennung Sonde hat eine breite Anwendung zur Erfassung von Technologien gesehen; immunchemischen Nachweis Methoden, wie z. B. ELISAs und MEIAs sind heutzutage unter den am häufigsten verwendeten und angewandte Plattformen in vielen Labors 7.
Während diese Ansätze zu erzielen außergewöhnliche Sensitivität und Spezifität, ein primäres Ziel vieler Forschergruppen in den letzten Jahren hat sich der Verbesserung und Optimierun...
Access restricted. Please log in or start a trial to view this content.
Danksagungen
Autoren möchten Nancy Downer und alle Mitglieder aus dem Labor für Analytische Chemie an der Universität Rom "Tor Vergata" Danke für ihre Mitarbeit und logistische Unterstützung. Diese Arbeit wurde durch das EU-Projekt "Biocop" unterstützt.
Access restricted. Please log in or start a trial to view this content.
Materialien
Reagenzien
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
| Kaliumchlorid | Sigma | P9333 | |
| Kaliumdihydrogenphosphat | Sigma | P9791 | |
| Dinatriumhydrogenphosphat | Sigma | S3264 | |
| Kochsalz | Sigma | S3014 | |
| MgCl 2 wasserfrei | Sigma | M8266 | |
| DEA (99,5%) | Sigma | 31589 | |
| HCl 37% | Sigma | 320331 | |
| H 3 BO 3 | Sigma | B6768 | |
| Tris [hydroxymethyl]-aminomethan | Sigma | 252859 | |
| BSA (Rinderserum-Albumin) | Sigma | A4503 | |
| NaOH | Sigma | S5881 | |
| Tween 20 | Sigma | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-Naphthyl-Phosphat Dinatriumsalz | Fluka | N7255 | |
| Magermilch blockiert Lösung - nicht Magermilchpulver | Bio-Rad | 170-6404 | |
| HT-2 konjugiert mit KLH (Keyhole Limpet Hämocyanin), Stammlösung (1 mg / ml in PBS): | Biopure | 004050 | Die HT-2-KLH-Konjugat wurde durch CDI-Methode, bei der die freie OH-Gruppen auf Position 3 und 4 an der HT-2 Toxin, das von N, N'-Carbonyldiimidazol (CDI) und der aktivierten HT-2 Toxin wurde aktiviert wurden erhalten lassen sich mit Aminogruppen des Proteins (KLH) reagieren, um eine stabile carbammate Verknüpfung erzeugen. |
| Sekundäre markierte Antikörper: Anti-Maus IgG (H + L) vom Pferd, konjugiert mit alkalischer Phosphatase, Konzentration 1 mg / ml. | Vector Laboratories | AP-2000 | |
| HT-2-Toxin | Biopure | ||
| Magnetic Beads: Dynabeads ® | Dynal | M-280 Tosylactivated | Konzentration 2 x 10 9 Beads / ml. |
Lösungen
| Name des Reagenzes | Vorbereitung | Kommentare (optional) |
| Phosphat-gepufferte Kochsalzlösung (PBS), pH 7,4 | Dissolve 0,20 g Kaliumchlorid, 0,20 g Kaliumdihydrogenphosphat, 1,16 g Dinatriumhydrogenphosphat und 8,00 g Natriumchlorid in 900 ml Wasser | |
| Diethanolaminpuffer, DEA, 0,97 M + 1 mM MgCl 2 + 0.15 M KCl, pH 9,8 | Lösen Sie 0.0476g von MgCl 2 wasserfrei und 7.3.59 g KCl in ~ 300 ml Wasser. Nach der Auflösung add 51 ml DEA (99,5%). Der pH-Wert auf 9,8 mit HCl (6 M). Verdünnen auf 500 ml mit Wasser. | |
| Borat-Puffer, 0,1 M, pH 9,5 | Dissolve 3,09 g H 3 BO 3 in ~ 300 ml destilliertem Wasser, pH-Wert auf 9,5 mit NaOH und / oder HCl (6 M oder niedrigere Konzentrationen). Verdünnen auf 500 ml mit destilliertem Wasser. | |
| TRIS-Puffer, 0,2 M, pH 8,5 | Dissolve 3,85 g Tris [hydroxymethyl]-aminomethan in 100 ml Wasser. Passen Sie auf pH 8,5 mit NaOH und / oder HCl (6 M oder niedrigere Konzentrationen). Verdünnen auf 200 ml mit Wasser. | |
| TRIS-Puffer + BSA-Lösung (0,1%), pH 8,4 | Lösen Sie 0,050 g BSA in 50 ml Tris-Puffer pH 8,4. | Diese Lösung muss frisch am Tag der Verwendung hergestellt werden. |
| PBS-Puffer + Tween ® 0,05% | Lösen Sie 0,250 g Tween 20 in 500 ml der zuvor hergestellten PBS-Puffer, pH 7,4 | |
| PBS-Puffer + BSA-Lösung 0,1% | Lösen Sie 0,050 g BSA in 50 ml PBS-Puffer, pH 7,3. | Diese Lösung muss frisch am Tag der Verwendung hergestellt werden. |
| PBS-Puffer + 0,1% BSA + NaN 3 0,02% | Lösen Sie 0,050 g BSA und 0,010 von NaN 3 in 50 ml PBS-Puffer, pH 7,3. | Storage-Solution |
| Enzymatische Substrat | Lösen Sie 0,010 g 1-Naphthyl-Phosphat-Natriumsalz in 100 ml DEA-Puffer pH 9,8. Der Kolben wird fest in Alufolie. | Diese Lösung muss frisch am Tag der Verwendung hergestellt werden. |
| Magermilch Blockierungslösung | Add 0,20 g Blotting Grade Blocker fettfreie trockene Milch (Bio-Rad, Hercules, CA, USA) zu 200 ml PBS-Puffer pH 7,3. | Diese Lösung muss frisch am Tag der Verwendung hergestellt werden. |
| HT-2-Stammlösung | Lösen Sie 10 mg Trichothecen HT-2-Toxin Fläschchen, in 10 ml Acetonitril zu geben eine Lösung mit einer Konzentration von 1 mg / ml. | Split bis diese Lösung in Einweg-Aliquots von 30 ml und speichern sie auf weniger als -30 ° C. |
| HT-2-Working-Standard-Lösung | Pipette 20 ml der HT-2-Toxin-Stammlösung in ein 2 ml-Messkolben und verdünnt mit Acetonitril zu einer HT-2 funktionierende Lösung mit 10 ug / ml Trichothecene Toxin zu erhalten. | Diese Lösung sollte frisch am Tag der Verwendung hergestellt werden. |
| HT-2-Working Kalibrierlösung Lösungen | Verdünnen Sie die HT-2 arbeitet Standard-Lösung (10 pg / ml) auf die Zusammenarbeit Kalibrierlösung 100 ng / ml herzustellen. Verdünnen HT-2 arbeiten Kalibrierlösung 100 ng / ml auf die Arbeitsunterlagen vorzubereiten Kalibrierlösung Lösungen der folgenden Konzentrationen 0 (leer), 0,5, 1, 2, 4, 10 ng / ml. | Diese Lösungen müssen bereit sein, am Tag der Verwendung frisch. |
| HT-2 konjugiert mit KLH | Split up HT-2 konjugiert mit KLH (Keyhole Limpet Hämocyanin) Stammlösung (1 mg / ml in PBS) in Einweg-Aliquots von 350 ul. | Shop Aliquots bei -30 ° C. |
| Spezifischer monoklonaler Antikörper | Verdünnen 1:350 (v: v) die Aktie Konzentration (1,383 mg / ml) des monoklonalen Antikörpers in PBS, um im Wettbewerb Schritt verwenden | Diese Lösung muss bereit sein zum Zeitpunkt der Verwendung frischer werden. 10 ml Antikörper-Stammlösung in PBS für ein Endvolumen von 3,5 ml, reichen bis 17 Normen und / oder Proben zu analysieren. |
| Sekundärer markierter Antikörper | Anti-Maus IgG (H + L) konjugiert mit alkalischer Phosphatase wird verdünnt 1:100 (v: v) in PBS, um im Wettbewerb Schritt zu verwenden. | 100 ul Antikörper-Stammlösung in PBS für ein Endvolumen von 10 ml, reichen bis 25 Normen und / oder Proben zu analysieren. Diese Lösung muss bereit sein zum Zeitpunkt der Verwendung frischer werden. |
Apparat
| Name des Reagenzes | Firma | Kommentare (optional) |
| Magnetic Particle Concentrator: MPC ®-S | Dynal | |
| PalmSens Instrument | PalmSens | Ausgestattet mit PalmSens Lite, Serial-Kabel verbindet PC Laptop und Mux Optionen Software |
| CH8 PalmSens Multiplexer | PalmSens | |
| Acht-Kanal Mux elektrischen Kontakt | Hand gemacht | |
| Streifen mit acht Siebdruck-Elektroden (SPEs) | Hand gemacht | |
| Speziell entwickelt für Elektroden Streifen | Hand gemacht | Inklusive 8 Neodym-Magneten von denen jeder unter jedem Arbeitstag Elektrodenfläche der SPE gelegt wird |
| Kalibriert Mikroliterpipetten | Gilson | |
| Magnetrührer und Rührstäbchen. | ||
| Bechergläser (100, 50, 20 ml). | ||
| Messkolben (2 ml). | ||
| 0,2 und 2 ml Eppendorf-Röhrchen. | Eppendorf | |
| Falcon ™ Tuben 5ml und 15ml. | Falke | |
| Laboratory Vortex Mixer | Verwenden Sie keine Vortex-Mixer an magnetische Kügelchen mit HT2-KLH beschichtet oder in Verbindung mit immunologischen Kette resuspendieren zu vermeiden Denaturierung von Proteinadsorption Teile | |
| Laborofen oder thermostatisierten Raum | Wählen Sie einen Ofen in der Lage, eine Temperatur von 37 ± 3 ° C zu halten |
Referenzen
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten