É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
ELIME Método (Enzyme Linked Immuno Magnetic eletroquímica) para Detecção de micotoxinas
Neste Artigo
Resumo
Um protocolo para detectar tricotecenos (micotoxinas de interesse para a saúde humana), utilizando um método de triagem recém-desenvolvido com base em um método imunoquímico competitiva e uma detecção eletroquímica final é demonstrada.
Resumo
Imunoensaios são uma alternativa válida para o mais caro e demorado quantitativa HPLC ou GC 1, 2 métodos para a detecção de triagem de micotoxinas perigosas em commodities de alimentos. Neste protocolo, mostramos como fabricar e interrogar uma enzima eletroquímica competitivas ligadas imunomagnética ensaio baseado no uso de esferas magnéticas como suporte sólido para a cadeia imunoquímicos 3 e eletrodos serigrafados como sensoriamento plataforma.
Nosso método visa determinar a quantidade total de HT-2 e T-2 toxinas, as micotoxinas, pertencente à família tricotecenos e de grande preocupação para a saúde humana 4. A utilização de um clone de anticorpo com uma reatividade cruzada de 100% para HT-2 e T-2 permite detectar simultaneamente tanto toxinas com sensibilidade similar 5.
O primeiro passo do nosso teste é a etapa de revestimento em que imobilizar HT2-KLH toxina conjugada na superfície das esferas magnéticas. Depois de uma etapa de bloqueio, necessário para evitar a não-específica absorções, a adição de um anticorpo monoclonal permite a competição entre imobilizada HT-2 e do presente livre HT-2 ou T-2 na amostra ou dissolvido em uma solução padrão.
No final da etapa de competição, a quantidade de anticorpo monoclonal ligado ao imobilizado HT-2 será inversamente proporcional à quantidade de toxina na solução da amostra.
Um anticorpo secundário marcado com fosfatase alcalina (AP) é usado para revelar a ligação entre o anticorpo específico ea imobilizada HT-2. A etapa de medição final é realizada por deixar cair uma alíquota de suspensão grânulo magnético, correspondente a uma determinada amostra de solução / standard, na superfície de um eletrodo serigrafado de trabalho; esferas magnéticas são imobilizados e concentrada por meio de um ímã colocado exatamente sob o serigrafado eletrodo. Após dois minutos de incubação entre as esferas magnéticas e um substrato para a AP, o produto enzimático é detectado por voltametria de pulso diferencial (DPV), utilizando um instrumento portátil (PalmSens) também capaz de iniciar automaticamente oito medidas dentro de um intervalo de poucos segundos.
Protocolo
1) Bloqueio de esferas magnéticas revestidas:
Proceder como a seguir para bloquear Revestido esferas magnéticas:
- Preparar um conjunto de 2 tubos Eppendorf ml;
- Homogeneizar (balançando, mas não vórtice) revestido esferas magnéticas (veja o apêndice para a preparação de esferas magnéticas revestidas) utilizando a amostra rotativa misturador;
- Imediatamente após a homogeneização, pipetar 10 ml de esferas magnéticas revestidas em cada tubos separados Eppendorf;
- Adicionar 1 ml de leite desnatado solução de bloqueio em cada tubo Eppendorf do conjunto;
- Deixe esferas magnéticas incubar por 30 min em temperatura ambiente no mixer amostra rotativa;
- Remover solução de bloqueio: para fazê-lo colocar o tubo no concentrador de partículas magnéticas com a parte magnética colocar por 2 min (ver esferas magnéticas que adere na parede lateral do tubo); cuidadosamente pipeta fora o sobrenadante, deixando contas inalteradas;
- Adicionar 1 ml de tampão PBS + NaN 3 + BSA como solução de armazenamento para cada tubo;
- Loja revestido e bloqueou esferas magnéticas a 4 ° C (note que revestido esferas magnéticas são estáveis por pelo menos 2 meses a 4 ° C);
2) cadeia imunológica em esferas magnéticas para a construção da curva de calibração e análise de amostras
Proceder como a seguir a ter esferas magnéticas pronto para a medição:
- Pegue um tubo de Eppendorf (2 ml) de solução revestido e bloqueado para cada extracto de amostra que você vai analisar;
- Pegue um tubo Eppendorf extra para cada solução de calibração de trabalho;
- Homogeneizar as esferas magnéticas por 2 min no mixer amostra girando antes de usar;
- Remover o líquido de armazenamento usando concentrador de partículas magnéticas;
- Lavar as esferas magnéticas três vezes com PBS / BSA a solução de lavagem. Retirar a roupa líquido;
- Passo competição: Adicionar para cada tubo contendo as contas lavados magnético, extrato de 200μl da amostra preparada, uso um tubo magnético talão para cada amostra. Repita o mesmo procedimento para cada solução padrão. Adicione 200 ml de solução de anticorpo monoclonal para cada tubo magnético talão. Deixe esferas magnéticas incubar por meia hora no misturador de rotação da amostra em temperatura ambiente;
- Remover a partir de tubos Eppendorf a solução utilizada para a competição passo;
- Rotulagem passo: Adicionar 400μl de anticorpo marcado secundária a cada magnética tubo Eppendorf talão. Deixe esferas magnéticas incubar por meia hora no misturador de rotação da amostra em temperatura ambiente;
- Remover rotulagem solução de tubos Eppendorf;
- Lavar as esferas magnéticas três vezes com PBS / Tween ® 20 solução de lavagem. Remover o líquido;
- Ressuspender com 100μl de tampão DEA cada alíquota de esferas magnéticas. Agora, a esferas magnéticas estão prontos para a etapa de medição eletroquímica;
3) Assembléia de PalmSens ao Multiplexer (Mux) opções
Por favor note: produto de hidrólise enzimática do substrato faltas a superfície do eletrodo, por esta razão um novo eletrodo é necessário para cada medição.
- Conectar um laptop PC para PalmSens através do cabo serial;
- Ligue a ficha 9-DIN de CH8 Multiplexer com PalmSens.
- Conecte o cabo de série dos Oito canal de contato elétrico com Mux CH8 Multiplexer;
- Colocar a tira de eletrodo no bloco ímã oito. Preste atenção para colocar cada um ímã em cada eletrodos de trabalho (de nota, a necessidade de um ímã único para cada eletrodo é imperativo caso contrário, a partícula magnética não será concentrado na área do eletrodo de trabalho);
- Conecte os eletrodos strip em oito canal de contato Mux elétrica;
Para a medição DPV usar os seguintes parâmetros nas caixas apropriadas:
E começar: 0 (V); fim E: 0,6 (V); passo E: 0,016 (V); E pulso: 0,0339 (V); E condicionado: 0 (V); deposição E: 0 (V); Taxa de leitura : 0,1 (V / s); T pulso: 0,06 (s); condicionado T: 0 (s); T deposição: 0 (s); equilíbrio T: 8 (s).
4) reação enzimática e Eletroquímica Medição
- Homogeneizar agitando cada tubo Eppendorf contendo esferas magnéticas pronto para etapa de medição eletroquímica, a fim de obter uma suspensão bem dispersa de esferas magnéticas;
- Pipeta de cada Eppendorf, imediatamente após a homogeneização, uma alíquota de 20 mL da dispersão magnética talão para a superfície do eletrodo de trabalho correspondente. Para cada eletrodo de uma tira de usar 20 l de esferas magnéticas tomadas a partir de tubos Eppendorf diferentes (por exemplo, por oito use eletrodo oito Eppendorf diferentes);
- Adicionar 80 ml de solução substrato enzimático no primeiro eletrodo. Iniciar 2 min contagem regressiva. Após 14 segundos, adicione 80 ml de solução substrato enzimático sobre o segundo eletrodo. Após mais 14 segundos, adicione 80 ml de solução substrato enzimático sobre o terceiro eletrodo. Proceder ao int mesmo tempoErval (14 segundos) até o último eletrodo (que significa: queda cada alíquota de substrato com intervalos de 14 seg). O tempo de intervalo de 14 segundos é calculado como o tempo exigido pelo potenciostato para executar a medição; de nota, a solução 80 mL em cada sensor deve cobrir o eletrodo de referência de trabalho, e contador. Além disso, as soluções para cada sensor não deve entrar em contato com soluções de eletrodos vizinhos.
- Após a 2 min contagem decrescente a partir da primeira adição da solução do substrato enzimático, inicie a medição eletroquímica;
- Use o PalmSens Lite software para obter picos de corrente (mA) para cada solução.
5 Cálculo)
Estabelecer uma curva de calibração usando uma equação logística quatro parâmetros e calcular a concentração da quantidade total de toxina HT-2/T-2 em nanogramas por mililitro de cada tubo Eppendorf contendo amostra desconhecida.
Os dados experimentais, a altura máxima (mA) contra a concentração dos calibradores (ng / ml), têm de estar equipados com um não-linear logístico quatro parâmetros-(4-PL) enredo equação (1) (usando Sigma Plot 8.0 ou Kaleidagraph). O modelo de 4-PL não-linear é usualmente adotado para descrever ligante ensaios de ligação (LBAs) 6.
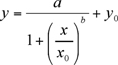 (1)
(1)
a, b, x0, y0 são parâmetros logística como dado pelo programa Sigma Plot caber curva.
Use a fórmula explicada para calcular o teor de HT-2/T-2 montante total de toxina na solução de amostra diluída extrair  (2)
(2)
x é a concentração em massa da quantidade total de HT-2/T-2 toxinas na solução extrato diluído, calculado a partir da equação 4 parâmetros logística em nanograma por milliltre (ng / ml)
y é o valor atual em mA obtidos para a amostra desconhecida
Apêndice
6) revestido esferas magnéticas
Proceder como a seguir a ter revestido esferas magnéticas:
Procedimento de lavagem
- Homogeneizar Dynabeads tosylactivated ® M-280 (solução 2 x 109 grânulos / ml) por agitação e vórtex (velocidade máxima) por 1 min (para evitar a formação de espuma) (observe a concentração de esferas magnéticas deve ser sempre o mesmo para garantir reprodutibilidade em a medição);
- Imediatamente pipetar 1 ml das esferas acima homogeneizada em um tubo Eppendorf 2 ml;
- Colocar o tubo no concentrador de partículas magnéticas com a parte magnética colocar por 2 min (ver esferas magnéticas furar na parede lateral do tubo);
- Cuidadosamente pipeta fora do sobrenadante, deixando contas inalteradas;
- Retire o tubo Eppendorf do concentrador de partículas magnéticas e ressuspender as contas em 1 ml de 0,1 M de borato pH 9,5. Misture delicadamente por 2 minutos no liquidificador amostra rotativa por 2 min;
- Pipeta fora do sobrenadante;
- Pipetar 1 ml de solução tampão borato no tubo Eppendorf. Esferas magnéticas está agora pronto para a etapa de revestimento;
Procedimento de revestimento
- Adicione 600 ml de HT-2 conjugado com KLH solução-mãe (Keyhole Limpet Hemocianina) a 1 ml de esferas magnéticas) (final de concentração HT-2-KLH de 375 mg / ml); incubar esferas magnéticas e HT-2-KLH solução para 20h a 37 ° C * com rotação lenta em tilt giratório misturador amostra;
- Depois de colocar o tubo de incubação no concentrador de partículas magnéticas e pipetar fora do sobrenadante;
Lavar contas revestido duas vezes com 1 ml de PBS / BSA solução tampão. Entre cada lavagem remover PBS / BSA solução. Todos etapa de lavagem foram realizados configuração esferas magnéticas e PBS / BSA em rotação misturador por 5 min; - Lavar as esferas magnéticas, uma vez com 1 ml de TRIS / BSA solução tampão. Remover TRIS / solução BSA. Realizar esta etapa definindo esferas magnéticas e TRIS / BSA em tampão rotação misturador para 4 h a 37 ° C *;
- Lavar as esferas magnéticas, uma vez usando 1ml de atualizado (mantido na geladeira a 4 ° C) PBS / BSA solução tampão. Remover PBS / BSA solução. Realizar esta etapa configuração esferas magnéticas e PBS / BSA em tampão rotação misturador para 5min à temperatura ambiente;
- Após a lavagem passo remover todo o líquido de lavagem e adicionar 1 ml tampão PBS + NaN 3 + BSA como líquido de armazenamento;
- Loja esferas magnéticas revestidas a 4 ° C (note que revestido esferas magnéticas são estáveis por pelo menos 2 meses a 4 ° C);
* Para este efeito, o mixer é colocado no forno equipado com um buraco que permite a inserção do cabo para o fornecimento de energia. Alternativamente, o misturador pode ser colocado em uma sala termostatizado a 37 ° C.
7) A preparação das amostras e extração
25 g de amostra finamente moída (cereais bebê comida ou café da manhã) estamosighed em um copo do liquidificador e extraídas com 100 ml de acetonitrila / solução de água (86/14) por 3 min em um misturador de alta velocidade. Após centrifugação a 4000 rpm (3000 g) por 5 min, 8 ml do sobrenadante foram tomadas e purificados com coluna Mycosep, 4 ml do extrato limpas foram secas sob fluxo de nitrogênio. Amostras secas podem ser armazenadas a -30 ° C até vários meses.
8) a reconstituição da amostra
Cereais de pequeno almoço
Reconstituir o extrato de cereais secos pequeno-almoço (comida à base de cereais destinados ao consumo adulto) com 40 ml de PBS pH 7,4. Desta forma uma amostra com uma concentração de toxina igual ao limite legal suposto (200 ng / g) dará na etapa de medição um sinal de queda no meio da faixa de trabalho.
Alimentos para bebês
Reconstituir o extrato de alimentos secos baby (alimentos à base de cereais destinados ao consumo infantil) com 4 ml de PBS. Desta forma uma amostra com uma concentração de toxinas igual ao limite legal suposto (20-25 ng / g) dará na etapa de medição um sinal de queda no meio da faixa de trabalho.
Access restricted. Please log in or start a trial to view this content.
Discussão
O uso de anticorpos como sonda de reconhecimento biomolecular viu um uso generalizado de tecnologias de sensoriamento; metodologias de detecção imunoquímica, como os testes ELISA e Meias, são, hoje em dia, entre as plataformas mais utilizadas e aplicadas em muitos laboratórios 7.
Embora essas abordagens alcançar a sensibilidade excepcional e especificidade, o objetivo principal dos muitos grupos de pesquisa nos últimos anos tem sido a melhoria e otimização de suas perform...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Autores gostariam de agradecer a Nancy Downer e todos os membros do laboratório de Química Analítica, Universidade de Roma "Tor Vergata" por sua colaboração e apoio logístico. Este trabalho foi financiado pelo projecto da União Europeia "BioCop".
Access restricted. Please log in or start a trial to view this content.
Materiais
Reagentes
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Cloreto de potássio | Sigma | P9333 | |
| Dihidrogenofosfato de potássio | Sigma | P9791 | |
| Hidrogenofosfato dissódico | Sigma | S3264 | |
| Cloreto de sódio | Sigma | S3014 | |
| MgCl 2 anidro | Sigma | M8266 | |
| DEA (99,5%) | Sigma | 31589 | |
| HCl 37% | Sigma | 320331 | |
| H 3 BO 3 | Sigma | B6768 | |
| Tris [hidroximetil]-aminometano | Sigma | 252859 | |
| BSA (soro albumina bovina) | Sigma | A4503 | |
| NaOH | Sigma | S5881 | |
| Tween 20 | Sigma | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-naftil fosfato dissódico de sal | Fluka | N7255 | |
| Solução de leite desnatado bloqueio - gordura do leite não seca | Bio-Rad | 170-6404 | |
| HT-2 conjugado com KLH (Keyhole Limpet Hemocianina), solução estoque (1 mg / ml em PBS): | Biopure | 004050 | O conjugado HT-2-KLH foi obtida por CDI-método em que o livre OH-grupos na posição 3 e 4 da toxina HT-2 foram ativados por N, N'-carbonyldiimidazole (CDI) ea toxina HT ativado-2 foi deixe-a reagir com aminogroups da proteína (KLH) para gerar uma ligação carbammate estável. |
| Anticorpo marcado secundário: Anti-rato IgG (H + L) de cavalo, conjugado com fosfatase alcalina, a concentração de 1 mg / ml. | Vector Laboratories | AP-2000 | |
| HT-2 | Biopure | ||
| Esferas magnéticas: Dynabeads ® | Dynal | M-280 Tosylactivated | Concentração de 2 x 10 9 esferas / ml. |
Soluções
| Nome do reagente | Preparação | Comentários (opcional) |
| Tampão fosfato salino (PBS), pH 7,4 | Dissolver 0,20 g de cloreto de potássio, 0,20 g de dihidrogenofosfato de potássio, 1,16 g de fosfato dissódico de hidrogênio e 8,00 g de cloreto de sódio em 900 ml de água | |
| Dietanolamina buffer, DEA, 0,97 M + 1 mM MgCl 2 + 0,15 M KCl, pH 9,8 | Dissolver 0.0476g de MgCl 2 anidro e 7.3.59 g de KCl em ~ 300 ml de água. Após a dissolução, adicionar 51 ml da DEA (99,5%). Ajustar o pH para 9,8 com HCl (6 M). Diluir para 500 ml com água. | |
| Borato tampão, 0,1 M, pH 9.5 | Dissolver 3,09 g de H 3 BO 3 em ~ 300 ml de água destilada; ajustar o pH para 9,5 com NaOH e / ou HCl (6 M ou concentrações mais baixas). Diluir para 500 ml com água destilada. | |
| TRIS buffer, 0,2 M, pH 8,5 | Dissolver 3,85 g de Tris [hidroximetil] aminometano-in 100 ml de água. Acertar a pH 8,5 com NaOH e / ou HCl (6 M ou concentrações mais baixas). Diluir para 200 ml com água. | |
| Tampão TRIS + BSA solução (0,1%), pH 8,4 | Dissolver 0,050 g de BSA em 50 ml de TRIS pH 8.4. | Esta solução deve ser preparada no dia de uso. |
| Tampão PBS + Tween ® 0,05% | Dissolver 0,250 g de Tween 20 em 500 ml do preparado anteriormente tampão PBS, pH 7,4 | |
| Tampão PBS + BSA solução 0,1% | Dissolver 0,050 g de BSA em 50 ml de tampão PBS, pH 7.3. | Esta solução deve ser preparada no dia de uso. |
| Tampão PBS + BSA 0,1% + 0,02% NaN 3 | Dissolver 0,050 g de BSA e 0,010 de NaN 3, em 50 ml de tampão PBS, pH 7.3. | Armazenamento de solution |
| Substrato enzimático | Dissolver 0,010 g de 1-naftil sal fosfato de sódio em 100 ml de DEA pH 9.8. Envolver o balão firmemente em papel alumínio. | Esta solução deve ser preparada no dia de uso. |
| Solução de leite desnatado bloqueio | Adicionar 0,20 g de Blotting Grade Bloqueador de leite desnatado seco (Bio-Rad, Hercules, CA, EUA) para 200 ml de tampão PBS pH 7.3. | Esta solução deve ser preparada no dia de uso. |
| HT-2 solução estoque | Dissolver 10 mg de tricotecenos frasco toxina HT-2, em 10 ml de acetonitrila para dar uma solução com uma concentração de 1 mg / ml. | Dividir essa solução em um único uso alíquotas de 30 ml e armazená-los em menos de -30 ° C. |
| HT-2 Working solução padrão | Colocar 20 ml de HT-2 toxina solução estoque em uma de 2 ml calibrados balão volumétrico e diluir com acetonitrila para obter uma solução HT-2 de trabalho contendo 10 mg / ml de toxina tricotecenos. | Esta solução deve ser preparada no dia de uso. |
| HT-2 Trabalhando soluções de calibração | Diluir o HT-2 solução padrão de trabalho (10 mcg / ml) para preparar solução de trabalho de calibração de 100 ng / ml. Diluir HT-2 trabalham solução de calibração de 100 ng / ml para preparar soluções de calibração de trabalho das seguintes concentrações 0 (branco), 0,5, 1, 2, 4, 10 ng / ml. | Estas soluções devem ser renovadas no dia de uso. |
| HT-2 conjugado com KLH | Dividir HT-2 conjugado com KLH solução-mãe (Keyhole Limpet Hemocianina) (1 mg / ml em PBS) para uso único alíquotas de 350 mL. | Alíquotas armazenar a -30 ° C. |
| Anticorpo monoclonal específico | Diluir 1:350 (v: v) a concentração de ações (1,383 mg / ml) de anticorpo monoclonal em PBS para utilização na etapa da concorrência | Esta solução deve ser preparada no momento do uso. 10 ml de solução estoque de anticorpos em PBS para um volume final de 3,5 ml, são suficientes para analisar 17 normas e / ou amostras. |
| Anticorpo marcado secundário | IgG anti-rato (H + L), conjugada com fosfatase alcalina, diluído 1:100 (v: v) em PBS para utilização na etapa competição. | 100 mL de solução stock de anticorpos em PBS para um volume final de 10 ml, são suficientes para analisar 25 normas e / ou amostras. Esta solução deve ser preparada no momento do uso. |
Aparelho
| Nome do reagente | Companhia | Comentários (opcional) |
| Concentrador de partículas magnéticas: MPC-S ® | Dynal | |
| Instrumento PalmSens | PalmSens | Fornecido com PalmSens Lite, cabo Serial laptop PC de conexão e software opções Mux |
| CH8 PalmSens Multiplexer | PalmSens | |
| Oito canais de contato elétrico Mux | feitas à mão | |
| Tira com oito eletrodos serigrafados (SPEs) | feitas à mão | |
| Suporte especialmente concebido para strip eletrodos | feitas à mão | Inclui 8 ímãs de neodímio cada um dos quais é colocado abaixo de cada superfície do eletrodo de trabalho da SPE |
| Calibrado pipetas microlitro | Gilson | |
| Agitador magnético e bares mexa. | ||
| Copos de vidro (100, 50, 20 ml). | ||
| Balões volumétricos (2ml). | ||
| 0,2 e 2 ml tubos Eppendorf. | Eppendorf | |
| Tubos Falcon ™ de 5ml e 15ml. | Falcão | |
| Laboratório Vortex Mixer | Não use vortex para voltar a suspender as esferas magnéticas revestidas com HT2-KLH ou ligado a cadeia imunológica para evitar a desnaturação protéica de peças | |
| Forno de laboratório ou sala de termostatizado | Escolha um forno capaz de manter uma temperatura de 37 ± 3 ° C. |
Referências
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados