È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
ELIME (Enzyme Linked Immuno magnetica elettrochimici) metodo di rilevazione micotossine
In questo articolo
Riepilogo
Un protocollo per rilevare tricoteceni (micotossine di preoccupazione per la salute umana), utilizzando un metodo di screening di nuova concezione basata su un metodo competitivo immunochimici e una rilevazione finale elettrochimica è dimostrata.
Abstract
Immunologici sono una valida alternativa al più costoso e richiede tempo quantitativa HPLC o GC 1, 2 metodi di screening per la rilevazione di micotossine pericolose nei prodotti alimentari. In questo protocollo si mostra come fabbricare e interrogare un enzima competitivo elettrochimica alla prova di immunomagnetica basato sull'uso di sfere magnetiche come supporto solido per la catena di immunochimica 3 e elettrodi serigrafati come piattaforma di rilevamento.
Il nostro metodo mira a determinare la quantità totale di HT-2 e tossine T-2, micotossine appartenente alla famiglia tricoteceni e di grande preoccupazione per la salute umana 4. L'uso di un clone di anticorpo con una reattività incrociata del 100% verso HT-2 e T-2 consente di rilevare simultaneamente sia le tossine con sensibilità simili 5.
Il primo passo della nostra analisi è la fase di rivestimento in cui si immobilizzare HT2-KLH tossina coniugato sulla superficie di sfere magnetiche. Dopo una fase di blocco, necessario per evitare assorbimenti non specifici, l'aggiunta di un anticorpo monoclonale permette la competizione tra immobilizzato HT-2 e liberi presenti HT-2 o T-2 nel campione o disciolte in una soluzione standard.
Al termine della fase di concorso, la quantità di anticorpo monoclonale legato alla immobilizzato HT-2 sarà inversamente proporzionale alla quantità di tossina nella soluzione campione.
Un anticorpo secondario marcato con fosfatasi alcalina (AP) è usato per rivelare il legame tra l'anticorpo specifico e la immobilizzato HT-2. Il passo finale di misurazione viene eseguita lasciando cadere una aliquota di sospensione magnetica tallone, corrispondente ad uno specifico campione / soluzione standard, sulla superficie di uno schermo-stampa dell'elettrodo di lavoro; sfere magnetiche sono immobilizzati e concentrato per mezzo di un magnete posizionato proprio sotto l' serigrafato elettrodo. Dopo due minuti di incubazione tra sfere magnetiche e un substrato per AP, il prodotto enzimatico viene rilevato da Voltammetria Differential Pulse (DPV) utilizzando uno strumento portatile (PalmSens) anche in grado di avviare automaticamente otto misure in un intervallo di pochi secondi.
Protocollo
1) Il blocco rivestito sfere magnetiche:
Procedere come segue per bloccare patinata sfere magnetiche:
- Preparare una serie di tubi Eppendorf da 2 ml;
- Omogeneizzare (agitazione, ma non vortex) rivestito sfere magnetiche (si veda l'appendice per la preparazione di carta patinata sfere magnetiche) con il campione di rotazione mixer;
- Immediatamente dopo omogeneizzazione, pipettare 10 ml di rivestimento sfere magnetiche in ogni tubi separati Eppendorf;
- Aggiungere 1 ml di latte scremato blocco soluzione in ciascuna provetta Eppendorf del set;
- Lasciate sfere magnetiche incubare per 30 minuti a temperatura ambiente sul mixer campione rotante;
- Rimuovere il blocco soluzione: farlo posto il tubo di concentratore di particelle magnetiche con la parte magnetica messo su per 2 min (vedere sfere magnetiche attaccare sulla parete laterale del tubo); pipetta con attenzione il sopranatante, lasciando indisturbato perline;
- Aggiungere 1 ml di tampone PBS + NaN 3 + BSA come soluzione di storage per ogni tubo;
- Conservare patinata e bloccato sfere magnetiche a 4 ° C (si noti che rivestiti sfere magnetiche sono stabili per almeno 2 mesi a 4 ° C);
2) catena immunologici su sfere magnetiche per la costruzione della curva di calibrazione e analisi dei campioni
Procedere come segue per avere sfere magnetiche pronte per la misura:
- Prendete un tubo Eppendorf (2 ml) di soluzione rivestito e bloccati per ogni campione che si sta per analizzare;
- Prendete un tubo Eppendorf in più per ogni soluzione calibrante di lavoro;
- Omogeneizzare sfere magnetiche per 2 minuti sul mixer campione rotanti prima dell'uso;
- Rimuovere il liquido di storage utilizzando concentratore magnetico delle particelle;
- Lavare le sfere magnetiche tre volte con PBS / BSA soluzione di lavaggio. Rimuovere il liquido di lavaggio;
- Passo concorso: Aggiungere per ogni tubo contenente le sfere magnetiche lavate, 200μl di campione preparato, utilizzare un tubo perla magnetica per ogni campione. Ripetete la stessa procedura per ogni soluzione standard. Aggiungere 200 microlitri di soluzione di anticorpo monoclonale ad ogni provetta perla magnetica. Lasciate sfere magnetiche incubare per mezz'ora sul mixer campione rotante a temperatura ambiente;
- Rimuovere dai tubi Eppendorf la soluzione utilizzata per la concorrenza-passo;
- Etichettatura passo: Aggiungere 400μl di anticorpo secondario ad ogni magnetico tubo Eppendorf tallone. Lasciate sfere magnetiche incubare per mezz'ora sul mixer campione rotante a temperatura ambiente;
- Rimuovere l'etichettatura soluzione da tubi Eppendorf;
- Lavare le sfere magnetiche tre volte con PBS / Tween ® 20 soluzione di lavaggio. Asportare il liquido;
- Risospendere con 100μl di tampone DEA ciascuna aliquota di sfere magnetiche. Ora le sfere magnetiche sono pronti per il passo di misura elettrochimica;
3) Assemblea dei PalmSens con Multiplexer (Mux) Opzioni
Si prega di notare: prodotto di idrolisi enzimatica del substrato falli la superficie dell'elettrodo, per questo motivo un nuovo elettrodo è necessario per ogni misurazione.
- Collegare un PC portatile per PalmSens attraverso il cavo seriale;
- Collegare il 9-connettore DIN di CH8 Multiplexer con PalmSens.
- Collegare il cavo seriale del canale Mux Otto contatto elettrico con CH8 Multiplexer;
- Luogo striscia elettrodo sul blocco magnete otto. Prestare attenzione al luogo in ogni magnete sotto ogni elettrodi di lavoro (di nota, la necessità di un magnete unico per ogni elettrodo è indispensabile altrimenti la particella magnetica non sarà concentrata sulla superficie degli elettrodi di lavoro);
- Collegare striscia elettrodi in otto contatto canale Mux elettrici;
Per la misurazione DPV utilizzare i seguenti parametri nelle caselle appropriate:
E comincia: 0 (V); fine E: 0,6 (V); passo E: 0,016 (V); E impulso: 0,0339 (V); E condizionata: Velocità di scansione;:: 0 (V) 0 (V) E deposizione : 0,1 (V / s); T impulso: 0,06 (s); condizionata T: 0 (s); deposizione T: 0 (s); equilibrio T: 8 (s).
4) reazione enzimatica ed elettrochimica di misura
- Omogeneizzare agitando delicatamente ogni tubo Eppendorf contenente microsfere magnetiche pronte per il passo di misura elettrochimiche in modo da ottenere una sospensione e dispersi di grani magnetici;
- Pipetta da ogni Eppendorf, subito dopo omogeneizzazione, una aliquota di 20 microlitri della dispersione magnetica tallone sulla superficie dell'elettrodo di lavoro corrispondente. Per ogni elettrodo di un uso striscia 20 l di sfere magnetiche presi da diverse provette Eppendorf (ad esempio l'uso di elettrodi per otto otto diversi Eppendorf);
- Aggiungere 80 ml di soluzione di substrato enzimatico sul primo elettrodo. Start 2 min il conto alla rovescia. Dopo 14 secondi, aggiungere 80 ml di soluzione di substrato enzimatico sul secondo elettrodo. Dopo altri 14 secondi, aggiungere 80 ml di soluzione di substrato enzimatico sul terzo elettrodo. Procedere al tempo stesso interval (14 secondi) fino all'ultimo l'elettrodo (che significa: ogni goccia aliquota del substrato con intervalli di 14 sec). L'intervallo di tempo di 14 sec è calcolato come il tempo richiesto dalla potenziostato per eseguire la misura; di nota, le 80 ul di soluzione per ogni sensore dovrebbe coprire l'elettrodo di lavoro di riferimento e contatore. Inoltre, le soluzioni per ogni sensore non deve venire in contatto con le soluzioni di elettrodi vicini.
- Dopo il conto alla rovescia 2 min dalla prima aggiunta della soluzione di substrato enzimatico, avviare la misurazione elettrochimica;
- Utilizzare il PalmSens Lite software per ottenere i picchi di corrente (mA) per ogni soluzione.
5) Calcolo
Costruire una curva di calibrazione utilizzando una equazione logistica 4 parametri e calcolare la concentrazione del totale HT-2/T-2 quantità di tossine in nanogrammi per millilitro per ogni tubo Eppendorf contenente campione incognito.
I dati sperimentali, altezza del picco (mA) contro la concentrazione dei calibratori (ng / ml), devono essere montati con un non-lineare a quattro parametri logistici (4-PL) plot equazione (1) (utilizzando Plot Sigma 8.0 o Kaleidagraph). Il non lineare 4-PL modello è di solito adottato per descrivere ligando saggi vincolanti (LBA) 6.
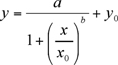 (1)
(1)
a, b, x0, y0 sono parametri logistici come indicato dal programma Sigma Plot forma curva.
Utilizzare la formula per calcolare esplicitato il contenuto di tossina HT-2/T-2 quantità totale presente nella soluzione diluita campione  (2)
(2)
x è la concentrazione di massa della quantità totale di HT-2/T-2 tossine nella soluzione di estratto diluito, calcolato dalla equazione logistica 4 parametri in nanogrammi per milliltre (ng / ml)
y è il valore corrente in μA ottenuti per il campione sconosciuto
Appendice
6) rivestito sfere magnetiche
Procedere come segue per avere rivestito sfere magnetiche:
Procedura di lavaggio
- Omogeneizzare Dynabeads tosylactivated ® M-280 (magazzino soluzione 2 x 109 perline / ml), agitando e vortex (velocità max) per 1 min (evitare la formazione di schiuma) (notare la concentrazione di sfere magnetiche deve essere sempre lo stesso per garantire la riproducibilità in la misura);
- Immediatamente pipetta 1 ml di perline sopra omogeneizzato in una provetta Eppendorf da 2 ml;
- Porre il tubo in concentratore di particelle magnetiche con la parte magnetica messo su per 2 min (vedere sfere magnetiche attaccare sulla parete laterale del tubo);
- Con attenzione pipetta il sopranatante, lasciando indisturbato perline;
- Togliere la provetta Eppendorf da concentratore di particelle magnetiche e risospendere le sfere in 1 ml di 0,1 M tampone borato pH 9.5. Mescolare delicatamente per 2 minuti nel mixer campione rotante per 2 minuti;
- Pipetta il sopranatante;
- Pipettare 1 ml di soluzione tampone borato nel tubo Eppendorf. Biglie magnetiche sono ora pronti per la fase di rivestimento;
Procedura di rivestimento
- Aggiungere 600 ml di HT-2, coniugato con KLH (Keyhole Hemocyanin Patella), soluzione madre di 1 ml di perline magnetiche) (finale HT-2-KLH concentrazione di 375 mg / ml); incubare sfere magnetiche e HT-2-KLH soluzione per 20h a 37 ° C * con rotazione lenta inclinazione sulla rotazione mixer campione;
- Dopo luogo di incubazione del tubo nel concentratore di particelle magnetiche e pipetta il sopranatante;
Lavare perline ricoperto due volte con 1 ml di PBS / BSA soluzione tampone. Tra ogni lavaggio rimuovere PBS / BSA soluzione. Tutti fase di lavaggio sono state effettuate impostando sfere magnetiche e PBS / BSA in un miscelatore rotante per 5 minuti; - Lavare sfere magnetiche, una volta con 1 ml di TRIS / BSA soluzione tampone. Rimuovere TRIS / soluzione BSA. Effettuare questa operazione impostando sfere magnetiche e TRIS / BSA tampone sulla rotazione mixer per 4 ore a 37 ° C *;
- Lavare sfere magnetiche, una volta con 1 ml di aggiornare (conservato in frigorifero a 4 ° C) PBS / BSA soluzione tampone. Rimuovere PBS / BSA soluzione. Eseguire questo passo impostazione sfere magnetiche e PBS / BSA tampone sulla rotazione mixer per 5 minuti a temperatura ambiente;
- Dopo il lavaggio passo rimuovere tutto il liquido di lavaggio e aggiungere 1 ml di tampone PBS + NaN 3 + BSA come liquido di stoccaggio;
- Conservare rivestito sfere magnetiche a 4 ° C (si noti che rivestiti sfere magnetiche sono stabili per almeno 2 mesi a 4 ° C);
* A tal fine il miscelatore è posto in forno dotato di un foro che permette l'inserimento del cavo per l'alimentazione. In alternativa, il mixer può essere inserito in una camera termostatata a 37 ° C.
7) Preparazione dei campioni e l'estrazione
25 g di campione macinato finemente (per bambini cereali alimentari o prima colazione) siamoighed in un vaso frullatore ed estratti con 100 ml di acetonitrile / soluzione acquosa (86/14) per 3 minuti in un frullatore ad alta velocità. Dopo centrifugazione a 4000 giri (3000 g) per 5 minuti, 8 ml di surnatante sono state prese e purificata con colonna Mycosep, 4 ml di estratto sono stati puliti essiccato sotto flusso di azoto. Campioni essiccati possono essere conservati a -30 ° C fino a diversi mesi.
8) la ricostituzione del campione
Cereali per la colazione
Ricostituire l'estratto secco di cereali prima colazione (alimentari a base di cereali destinati al consumo degli adulti) con 40 ml di PBS pH 7,4. In questo modo, un campione con una concentrazione di tossina pari al limite legale supposta (200 ng / g), si cede il passo misura un segnale cade nel mezzo del campo di lavoro.
Alimenti per bambini
Ricostituire il cibo secco estratto per l'infanzia (alimenti a base di cereali destinati al consumo infantile) con 4 ml di PBS. In questo modo, un campione con una concentrazione di tossine pari al limite legale presunta (20-25 ng / g), si cede il passo misura un segnale cade nel mezzo del campo di lavoro.
Access restricted. Please log in or start a trial to view this content.
Discussione
L'uso di anticorpi come sonde biomolecolari riconoscimento ha visto un ampio utilizzo di tecnologie di rilevamento, metodologie di rilevazione immunochimica, quali ELISA e MEIAs, sono, al giorno d'oggi, tra le piattaforme più utilizzate e applicate in molti laboratori 7.
Anche se questi approcci raggiungere una sensibilità eccezionale e specificità, un obiettivo primario di molti gruppi di ricerca negli ultimi anni è stato il miglioramento e l'ottimizzazione delle ...
Access restricted. Please log in or start a trial to view this content.
Riconoscimenti
Autori desiderano ringraziare Nancy Downer e tutti i membri del laboratorio di Chimica Analitica, Università di Roma "Tor Vergata" per la loro collaborazione e supporto logistico. Questo lavoro è stato supportato dal progetto UE "Biocop".
Access restricted. Please log in or start a trial to view this content.
Materiali
Reagenti
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
| Cloruro di potassio | Sigma | P9333 | |
| Potassio fosfato monobasico | Sigma | P9791 | |
| Idrogeno fosfato disodico | Sigma | S3264 | |
| Cloruro di sodio | Sigma | S3014 | |
| MgCl2 anidro | Sigma | M8266 | |
| DEA (99,5%) | Sigma | 31589 | |
| HCl 37% | Sigma | 320331 | |
| H 3 BO 3 | Sigma | B6768 | |
| Tris [idrossimetil]-amminometano | Sigma | 252859 | |
| BSA (albumina sierica bovina) | Sigma | A4503 | |
| NaOH | Sigma | S5881 | |
| Tween 20 | Sigma | P9416 | |
| NaN 3 | Aldrich | 71290 | |
| 1-naftil fosfato sale disodico | Fluka | N7255 | |
| Soluzione di latte scremato in blocco - non grassa del latte secco | Bio-Rad | 170-6404 | |
| HT-2 coniugato con KLH (Keyhole Hemocyanin Patella), soluzione madre (1 mg / ml in PBS): | Biopure | 004050 | L'HT-2-KLH coniugato è stato ottenuto da CDI-metodo in cui sono stati attivati i gruppi-OH libero in posizione 3 e 4 alla tossina HT-2 da N, N'-carbonyldiimidazole (CDI) e l'attivazione HT-2 tossina è stata lasciare a reagire con aminogroups della proteina (KLH) per generare un legame stabile carbammati. |
| Secondaria anticorpo marcato: Anti-mouse IgG (H + L) dal cavallo, coniugato con fosfatasi alcalina, concentrazione 1 mg / ml. | Laboratori Vector | AP-2000 | |
| HT-2 tossina | Biopure | ||
| Biglie magnetiche: Dynabeads ® | Dynal | M-280 Tosylactivated | Concentrazione di 2 x 10 9 sfere / ml. |
Soluzioni
| Nome del reagente | Preparazione | Commenti (opzionale) |
| Tampone fosfato (PBS), pH 7,4 | Sciogliere 0,20 g di cloruro di potassio, 0,20 g di potassio fosfato monobasico, 1,16 g di fosfato acido disodico e 8,00 g di cloruro di sodio in 900 ml di acqua | |
| Dietanolammina buffer, DEA, 0,97 M + 1 mM MgCl 2 + 0,15 M di KCl, pH 9,8 | Sciogliere 0.0476g di MgCl2 anidro e 7.3.59 g di KCl in ~ 300 ml di acqua. A dissoluzione avvenuta aggiungere 51 ml di DEA (99,5%). Regolare il pH a 9,8 con HCl (6 M). Diluire a 500 ml con acqua. | |
| Borato tampone, 0,1 M, pH 9,5 | Sciogliere 3,09 g di H 3 BO 3 a ~ 300 ml di acqua distillata, aggiustare il pH a 9,5 con NaOH e / o HCl (6 M o concentrazioni più basse). Diluire a 500 ml con acqua distillata. | |
| TRIS buffer, 0,2 M, pH 8,5 | Sciogliere 3,85 g di Tris [idrossimetil]-amminometano in 100 ml di acqua. Aggiustare il pH 8.5 con NaOH e / o HCl (6 M o concentrazioni più basse). Diluire a 200 ml con acqua. | |
| TRIS tampone + soluzione di BSA (0,1%), pH 8,4 | Sciogliere 0,050 g di BSA in 50 ml di tampone TRIS pH 8.4. | Questa soluzione deve essere preparata il giorno di utilizzo. |
| PBS + 0,05% Tween ® | Sciogliere 0,250 g di Tween 20 in 500 ml del preparato in precedenza tampone PBS, pH 7,4 | |
| PBS + BSA soluzione 0,1% | Sciogliere 0,050 g di BSA in 50 ml di tampone PBS, pH 7.3. | Questa soluzione deve essere preparata il giorno di utilizzo. |
| PBS + BSA 0,1% + 0.02% NaN3 | Sciogliere 0,050 g di BSA e 0,010 di NaN 3 in 50 ml di tampone PBS, pH 7.3. | Stoccaggio soldistribuzione pesi |
| Substrato enzimatico | Sciogliere 0,010 g di sale 1-naftil fosfato di sodio in 100 ml di pH tampone DEA 9.8. Avvolgere il pallone strettamente in un foglio di alluminio. | Questa soluzione deve essere preparata il giorno di utilizzo. |
| Soluzione di latte scremato in blocco | Aggiungere 0,20 g di Blotting grado Blocker non-Fat Milk secco (Bio-Rad, Hercules, CA, USA) a 200 ml di tampone PBS pH 7.3. | Questa soluzione deve essere preparata il giorno di utilizzo. |
| HT-2 Soluzione | Sciogliere 10 mg di tricoteceni HT-2 fiala tossina, in 10 ml di acetonitrile per dare una soluzione con una concentrazione di 1 mg / ml. | Diviso questa soluzione in un solo usare aliquote di 30 ml e conservarli a meno di -30 ° C. |
| HT-2 Soluzione standard | Pipettare 20 ml di HT-2 soluzione di tossina magazzino in un ml 2 calibrato pallone tarato e diluire con acetonitrile per ottenere un HT-2 soluzione di lavoro contenente 10 mg / ml di tossina tricoteceni. | Questa soluzione deve essere preparata il giorno di utilizzo. |
| HT-2 soluzioni calibrante di lavoro | Diluire il HT-2 soluzione standard di lavoro (10 mg / ml) per preparare la soluzione di lavoro calibrante 100 ng / ml. Diluire HT-2 soluzione di lavoro calibrante 100 ng / ml per preparare soluzioni di lavoro calibrante delle seguenti concentrazioni 0 (bianco), 0,5, 1, 2, 4, 10 ng / ml. | Queste soluzioni devono essere preparato fresco il giorno di utilizzo. |
| HT-2 coniugato con KLH | Suddivisi HT-2 coniugato con KLH (Keyhole Hemocyanin Patella) soluzione madre (1 mg / ml in PBS) in monouso aliquote di 350 microlitri. | Aliquote conservare a -30 ° C. |
| Anticorpo monoclonale specifico | Diluire 1:350 (v: v) la concentrazione stock (1,383 mg / ml) di anticorpo monoclonale in PBS da utilizzare in fase concorrenza | Questa soluzione va preparata di fresco al momento dell'uso. 10 ml di soluzione di anticorpi magazzino in PBS per un volume finale di 3,5 ml, sono sufficienti per analizzare 17 norme e / o campioni. |
| Secondaria anticorpo marcato | Anti-topo IgG (H + L) coniugato con fosfatasi alcalina è diluito 1:100 (v: v) in PBS da utilizzare in fase concorrenza. | 100 ul soluzione madre di anticorpi in PBS per un volume finale di 10 ml, sono sufficienti per analizzare 25 norme e / o campioni. Questa soluzione va preparata di fresco al momento dell'uso. |
Apparato
| Nome del reagente | Azienda | Commenti (opzionale) |
| Particelle magnetiche concentratore: MPC ®-S | Dynal | |
| PalmSens strumento | PalmSens | Dotato di PalmSens Lite, seriale PC portatile cavo di collegamento e software Mux opzioni |
| CH8 PalmSens Multiplexer | PalmSens | |
| Otto canali Mux contatto elettrico | fatti a mano | |
| Striscia con otto elettrodi serigrafati (SPE) | fatti a mano | |
| Supporto appositamente progettato per nastro elettrodi | fatti a mano | Comprende 8 magneti al neodimio ciascuno dei quali è posto al di sotto di ogni superficie dell'elettrodo di lavoro della SPE |
| Pipette calibrate microlitro | Gilson | |
| Agitatore magnetico e bar mescolare. | ||
| Bicchieri di vetro (100, 50, 20 ml). | ||
| Matracci tarati (2 ml). | ||
| 0,2 e 2 ml Eppendorf tubi. | Eppendorf | |
| Provette Falcon ™ di 5 ml e 15 ml. | Falco | |
| Laboratorio di Vortex Mixer | Non usare vortex per risospendere le sfere magnetiche rivestite con HT2-KLH o legati con catena immunologica ad evitare denaturazione proteica delle parti | |
| Laboratorio forno o camera termostatati | Scegli un forno in grado di mantenere una temperatura di 37 ± 3 ° C. |
Riferimenti
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon