このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ELIME(免疫磁気電気化学的にリンクされた酵素)マイコトキシンの検出方法
要約
競争力のある免疫化学的方法に基づいて新たに開発されたスクリーニング方法を用いてトリコテセン(ヒトの健康に対する懸念のマイコトキシン)を検出すると、最終的な電気化学的検出が実証されているプロトコル。
要約
イムノアッセイは、より高価で時間のかかる定量的なHPLCやGC 1、食料品の危険なマイコトキシンのスクリーニング検出のための2つの方法への有効な代替手段です。このプロトコルでは、プラットフォームを感知するなど、免疫化学チェーン3とスクリーン印刷電極の固体支持体として磁性ビーズの使用に基づいて、リンクされた免疫アッセイを作製し、電気化学的競争力のある酵素を尋問する方法を示します。
提案手法では、HT - 2とT - 2毒素の総量、トリコテセンの家族と人間の健康4の大きな懸念の属するマイコトキシンを決定することを目的とする。 HT - 2とT - 2に向かって100%の交差反応性抗体のクローンの使用は、同時に同じような感度5で両方の毒素を検出することができます。
私たちの分析の最初のステップは、我々は磁気ビーズの表面にHT2 - KLH複合体の毒素を固定化コーティングのステップです。非固有の吸収を避けるために必要なブロッキングのステップ、後に、モノクローナル抗体の添加は、HT - 2とフリーHT - 2やT - 2試料中に存在するか、標準液に溶解固定化との間の競争が可能になります。
競争のステップの終了時に、固定化HT - 2にリンクされているモノクローナル抗体の量は、試料溶液中の毒素の量に反比例します。
アルカリホスファターゼ(AP)で標識二次抗体を特異的抗体と固定化HT - 2の間の結合を明らかにするために使用されます。最後の測定ステップは、スクリーン印刷された作用電極の表面に、特定のサンプル/標準溶液に対応する磁気ビーズ懸濁液のアリコートを、ドロップすることによって実行されます。磁気ビーズは、下に正確に配置磁石により固定化し、そして濃縮されていますスクリーン印刷電極。磁気ビーズとAPの基質との間のインキュベーションの2分後、酵素製品は、ポータブル機器(PalmSens)数秒以内の間隔で自動的にeight測定を開始することを用いて微分パルスボルタンメトリー(DPV)によって検出されます。
プロトコル
1)被覆磁気ビーズをブロッキング:
被覆磁気ビーズをブロックするために以下のように進んでください:
- 2ミリリットルエッペンドルフチューブのセットを準備します。
- (揺れがボルテックスではない)ミキサーを回転させるサンプルを用いてコーティングされた磁気ビーズを(被覆磁性ビーズの調製のための付録を参照)ホモジナイズ。
- すぐにホモジナイズ後、ピペットそれぞれ別々のエッペンドルフチューブに被覆磁性ビーズ10μlの;
- セットの各エッペンドルフチューブに脱脂乳ブロッキング溶液の1mlを追加します。
- 回転サンプルミキサーに室温で30分間インキュベートした磁気ビーズを許可しなさい;
- ソリューションブロッキング削除:2分(チューブの側壁に付着した磁性ビーズを参照)のために置くの磁気部分に磁性粒子のコンセントレータにチューブを置くそのようにして、慎重にビーズが邪魔されずに残し、上清をピペットで。
- PBS緩衝液1ml + NaN 3を + BSA、各チューブのためのストレージソリューションとして追加します。
- 4で被覆した、ブロックされた磁気ビーズを保存° C(被覆磁性ビーズは4℃で少なくとも2ヶ月間安定であることに注意してください)。
2)検量線の建設及び試料分析のための磁気ビーズで免疫チェーンは、
測定の準備ができて磁気ビーズを持っている以下のように進んでください:
- を分析しようとしている各サンプルの抽出のためのコーティングとブロックされたソリューションの1つのエッペンドルフチューブ(2 ml)を取る。
- 各ワーキング較正ソリューションのための余分なエッペンドルフチューブを取る;
- 使用前に回転するサンプルミキサーで2分間磁性ビーズをホモジナイズ。
- 磁性粒子の集配信装置を使用してストレージの液体を取り除く。
- PBS / BSA洗浄液で磁気ビーズを3回洗浄する。液体洗濯取り外します。
- 競争のステップ :調製した抽出試料の200μlの洗浄、磁気ビーズを含む各チューブのために追加、各サンプルごとに1つの磁気ビーズチューブを使用。各標準溶液についても同じ手順を繰り返します。それぞれの磁気ビーズチューブにモノクローナル抗体溶液200μlを追加。磁気ビーズは、室温で回転するサンプルミキサーで半時間インキュベートを許可しなさい;
- エッペンドルフチューブから競争段階に使用する溶液を除去し;
- ラベリングのステップ:各磁気ビーズをエッペンドルフチューブに標識二次抗体の400μlを追加する。磁気ビーズは、室温で回転するサンプルミキサーで半時間インキュベートを許可しなさい;
- エッペンドルフチューブから標識溶液を取り除く。
- 磁気ビーズをPBS / Tweenで三回® 20洗浄液を洗浄してください。液体を取り除く。
- DEA緩衝液100μlと磁性ビーズの各アリコートを再懸濁します。今すぐ磁気ビーズは、電気化学測定のステップの準備ができています。
マルチプレクサ(MUX)のオプションとPalmSens 3)組立
ご注意:基質加水分解の酵素製品は、電極表面を汚す、この理由のために新しい電極は、測定ごとに必要とされる。
- シリアルケーブルを介してPalmSensにPCのラップトップを接続してください。
- PalmSensとCH8マルチプレクサの9 - DINプラグを接続します。
- CH8マルチプレクサ付き8チャネルマルチプレクサ電気接点のシリアルケーブルを接続します。
- eight磁石ブロックの電極ストリップを配置。各作用電極の下にそれぞれの磁石を配置するために注意を払う(音符の、各電極のための単一の磁石の必要性は特に磁性粒子が作用電極の面積に集中されませんが必須です)。
- 8チャンネルマルチプレクサ電気接点に電極ストリップのプラグイン;
DPV測定のために適切なボックスに次のパラメータを使用します。
E:0から始まります(V)、Eの端:0.6(V)、Eステップ:0.016(V)、Eパルス:0.0339(V)、Eコンディショニング:0(V)、Eの堆積:0(V)、スキャン速度を:0.1(V /秒)、Tパルス:0.06(秒)、Tエアコン:0(S)、T堆積:0(S)、Tの平衡:8(S)。
4)酵素反応と電気化学測定
- 静かに磁気ビーズの十分に分散懸濁液を得るために、電気化学測定のステップの準備ができて磁気ビーズを含む各エッペンドルフチューブを振とうすることによりホモジナイズ;
- すぐに均質化後の各エッペンドルフからピペット、、対応する作用電極の表面に磁気ビーズ分散の20μlのアリコート。つのストリップの使用の各電極に異なるエッペンドルフチューブ(8電極を使用する8種類のエッペンドルフ用など)から採取した磁性ビーズを20μlのための;
- 第一の電極上に酵素基質溶液80μlを加え。 2分がカウントダウン開始。 14秒後に、第二の電極上に酵素基質溶液80μlを加える。さらに14秒後に、第三の電極に酵素基質溶液80μlを加える。同じ時間int型で進む最後の電極(14秒の間隔で基板の各アリコートを落とすことを意味する)までerval(14秒)。 14秒のインターバル時間は、測定を実行するためにポテンシオスタットが必要とする時間として計算されます。音符で、各センサーで80μlのソリューションは、作業、参照と対極をカバーする必要があります。また、各センサーのためのソリューションは、隣接する電極のソリューションと接触してはいけません。
- 2分は、酵素基質溶液の最初の添加からカウントダウンした後、電気化学測定を開始します。
- ソリューションごとに電流のピーク値(μA)を取得するためにPalmSens Liteソフトウェアを使用してください。
5)計算
ロジスティック4パラメータの式を用いて検量線を確立し、未知のサンプルを含む各エッペンドルフチューブ用ミリリットルあたりナノグラムのトータルHT-2/T-2毒素の量の濃度を計算する。
シグマプロット8.0を使用して実験データ、calibrants(ng / ml)の濃度に対するピーク高さ(μA)、非線形的に4パラメータロジスティック(4 - PL)式のプロット(1)(使用して装着しなければならないかカレイダグラフ)。非線形4 - PLのモデルは、通常、リガンド結合アッセイ(LBAの)6を記述するために採用されています。
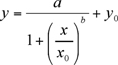 (1)
(1)
シグマプロットのカーブフィッティングプログラムによって与えられるように、B、X0、Y0はロジスティックパラメータです。
希釈されたサンプルの抽出液でHT-2/T-2毒素総量の含有量を計算するexplicated式を使用して、  (2)
(2)
xはmilliltreあたりナノグラム(ng / ml)の中の物流の4つのパラメータの式から計算希釈抽出液中のHT-2/T-2毒素の合計量の質量濃度、です。
yは、未知試料に対して得られたμAの電流値です
付録
6)被覆磁気ビーズ
被覆磁気ビーズを持っている以下のように進んでください:
洗浄法
- 磁性ビーズの濃度は常に再現性を保証するために、同じである必要がある注意してくださいtosylactivated Dynabeads ®は、1分間(最大速度)しながら、ボルテックスでM - 280を(ストック溶液2 × 109ビーズ/ ml)を(発泡避ける)(ホモジナイズ測定);
- すぐに2ミリリットルエッペンドルフチューブに上記の均質化ビーズを1mlのピペット。
- 2分(チューブの側壁に付着した磁性ビーズを参照)のために置くの磁気部分に磁性粒子のコンセントレータにチューブを置きます。
- 慎重にビーズが邪魔されずに残し、上清をピペットで。
- 磁性粒子のコンセントレータからエッペンドルフチューブを外し、0.1 Mホウ酸バッファーpH9.5 1mlにビーズを懸濁します。 2分間回転サンプルミキサーで2分間穏やかに混ぜる。
- 上清をピペットで。
- エッペンドルフチューブにホウ酸緩衝液のピペット1ミリリットル。磁気ビーズは、今のコーティング工程のための準備ができています。
コーティングの手順
- インキュベート磁気ビーズとHT - 2 - KLHのためのソリューション、KLH(キーホールリンペットヘモシアニン)磁気ビーズを1mlのストック溶液)(375 mg / mlの最終的なHT - 2 - KLH濃度)とHT - 2共役600 mlを加え20H 37℃*サンプルミキサーを回転させる上でゆっくりとチルトの回転と、
- インキュベーションの場清オフ磁性粒子濃縮器とピペットでチューブの後に;
PBS / BSA緩衝液1mlでコーティングされたビーズを2回洗浄する。それぞれの洗浄の間にPBS / BSA溶液を取り除く。すべての洗浄工程を5分間ミキサーを回転させることで磁気ビーズを設定し、PBS / BSA行った。 - TRIS / BSA緩衝液1mlを用いて一度磁気ビーズを洗浄してください。 TRIS / BSA溶液を取り外します。 37℃で4時間のためにミキサーを回転させることで磁気ビーズとTRIS / BSAバッファーを設定することにより、このステップを行う° C *;
- リフレッシュの1mlを用いて一度磁気ビーズを洗浄してください(4で冷蔵庫で保管° C)PBS / BSA緩衝液。 PBS / BSA溶液を除去。室温で5分間ミキサーを回転させることで磁気ビーズとPBS / BSAバッファーを設定するこの手順を行う。
- ステップは、すべての洗浄液を削除し、追加の洗浄後、1mlのPBS緩衝液+ NaN 3を + BSAストレージ液として;
- 4 ° C(被覆磁気ビーズは、4で少なくとも2ヶ月間℃で安定していることに注意してください)でコーティングされた磁気ビーズを格納します。
*この目的のために、ミキサーは電源供給用ケーブルを挿入できる穴を装備したオーブンに入れられます。またミキサー℃を37℃恒温室内に配置することができます
7)サンプル調製と抽出
細かく粉砕されたサンプルの25gは、(ベビーフードや朝食シリアル)我々です。ブレンダージャーにighedと高速ブレンダーで3分間、アセトニトリル/水の溶液(14分の86)の100mlで抽出した。 5分を4000 rpm(3000 G)、上清を8 mlの遠心分離がMycosepカラムで撮影し、精製した後、洗浄したエキスを4 mlを窒素気流下で乾燥させた。乾燥試料は、数ヶ月に-30℃まで保存することができます。
8)サンプルの再構成
朝食シリアル
再構成するPBS pH7.4の40mlで乾燥朝食用シリアルのエキス(穀物ベースの食品は、成人の消費に向かう)。このように仮定法的限界(200 ng / gであった)に等しい毒素の濃度のサンプルでは、測定ステップでの作業範囲の中央に立ち下がり信号を与える。
ベビーフード
PBS 4 mlで再構成する乾燥ベビーフード抽出物(穀物ベースの食品は、乳児の消費に向かう)。このようになっ法定上限(20〜25 ng / gであった)に等しい毒素の濃度のサンプルでは、測定ステップでの作業範囲の中央に立ち下がり信号を与える。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
生体分子認識プローブとしての抗体の使用は、センシング技術の普及を見ている、そのようなELISAおよびMEIAsなどの免疫化学的検出手法は、多くの研究室7で最も使用されると適用されるプラットフォームの間で、今日では、です。
これらのアプローチは、優れた感度と特異性を達成しながら、過去数年間で多くの研究グループの主な目的は、彼らのパフォーマン?...
Access restricted. Please log in or start a trial to view this content.
謝辞
著者は、彼らのコラボレーションと後方支援のために分析化学、ローマ大学"トルヴェルガータ"の研究室からナンシーダウナーとすべてのメンバーに感謝したいと思います。この作品は、EUのプロジェクト"BioCop"によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
試薬
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
| カリウム塩化 | シグマ | P9333 | |
| カリウムリン酸二水素 | シグマ | P9791 | |
| リン酸水素二ナトリウム | シグマ | S3264 | |
| ナトリウム塩化 | シグマ | S3014 | |
| MgCl 2の無水 | シグマ | M8266 | |
| DEA(99.5%) | シグマ | 31589 | |
| 塩酸37パーセント | シグマ | 320331 | |
| H 3 BO 3 | シグマ | B6768 | |
| トリス[ヒドロキシメチル]アミノメタン | シグマ | 252859 | |
| BSA(ウシ血清アルブミン) | シグマ | A4503 | |
| NaOHで | シグマ | S5881 | |
| Tween 20 | シグマ | P9416 | |
| NaN 3を | アルドリッチ | 71290 | |
| 1 - ナフチルりん酸二ナトリウム塩 | フルカ | N7255 | |
| スキムミルクをブロッキング溶液 - 非脂肪ドライミルク | Bio - Rad社 | 170-6404 | |
| :KLH(キーホールリンペットヘモシアニン)、ストック溶液(PBS中の1 mg / ml)を持つHT - 2共役 | ピュア | 004050 | HT - 2 - KLH複合体は、HT - 2トキシンでの位置3と4の遊離OH基がN、N' -カルボニルジイミダゾール(CDI)と活性化HT - 2毒素WASによってアクティブ化されたCDI法によって得られた安定したcarbammateリンケージを生成するタンパク質(KLH)のアミノ基と反応することができます。 |
| 二次標識抗体:馬から抗マウスIgG(H + L)、アルカリ性ホスファターゼと結合した、濃度1 mg / mlの。 | ベクターラボラトリーズ | AP - 2000 | |
| HT - 2トキシン | ピュア | ||
| 磁気ビーズ:Dynabeads ®は | DYNAL | M - 280 Tosylactivated | 濃度2 × 10 9ビーズ/ mlの。 |
ソリューション
| 試薬の名前 | 準備 | コメント(省略可能) |
| リン酸緩衝生理食塩水(PBS)、pH7.4の緩衝化 | 水900 mlに塩化カリウム0.20gの、リン酸二水素カリウム0.20gの、リン酸水素二ナトリウムの1.16 gおよび塩化ナトリウムの8.00グラムを溶かす | |
| ジエタノールアミンバッファー、DEA、0.97 M + 1mMのMgCl 2 + 0.15 MのKCl、pHは9.8 | 水の〜300mlの塩化マグネシウム無水およびKClの7.3.59 gの0.0476グラム溶かす。解散後はDEAの51ミリリットル(99.5%)を追加します。塩酸(6M)で9.8にpHを調整する。水で500 mlに希釈する。 | |
| ホウ酸緩衝液、0.1 M、pH9.5の | 蒸留水の約300 mlのH 3 BO 3の3.09グラムを溶かし、NaOHおよび/ または塩酸(6 Mまたはより低い濃度)で9.5にpHを調整する。蒸留水で500 mlに希釈する。 | |
| トリス緩衝液、0.2 M、pH 8.5の | 水100ml中のトリス[ヒドロキシメチル]アミノメタンの3.85グラムを溶かす。 NaOHおよび/または塩酸(6 Mまたはより低い濃度)でpH8.5に調整してください。水で200mlに希釈する。 | |
| TRIS緩衝+ BSA溶液(0.1%)、pHは8.4 | トリス緩衝液pH 8.4の50ml中にBSAの0.050グラムを溶かす。 | このソリューションは、新鮮な使用の当日に準備する必要があります。 |
| PBSバッファー+ TWEEN ® 0.05パーセント | 事前に準備したPBS緩衝液(pH7.4)500mlにTween 20の0.250グラムを溶かす | |
| PBSバッファー+ BSA液0.1% | PBS緩衝液、pH7.3に50mlのBSAの0.050グラムを溶かす。 | このソリューションは、新鮮な使用の当日に準備する必要があります。 |
| PBS緩衝液+ 0.1%BSA + NaN 3を 0.02パーセント | PBS緩衝液、pH7.3に50ml中のNaN 3のBSAおよび0.010 0.050グラムを溶かす。 | ストレージゾルution |
| 酵素基質 | DEA緩衝液pH 9.8 100 mlの1 - ナフチルりん酸ナトリウム塩0.010 gを溶かす。アルミホイルでしっかりとフラスコを巻きます。 | このソリューションは、新鮮な使用の当日に準備する必要があります。 |
| スキムミルクブロッキング溶液 | PBS緩衝液、pH7.3の200mlにグレードブロッカー脱脂粉乳(Bio - Rad社、ヘラクレス、CA、米国)をブロッティング0.20gのを追加。 | このソリューションは、新鮮な使用の当日に準備する必要があります。 |
| HT - 2ストック溶液 | をアセトニトリル10mlに、トリコテセンHT - 2毒素のバイアル10 mgを溶かし 1 mg / mlの濃度の溶液。 | 30mlの単回使用アリコートにこのソリューションを分割し、-30℃未満で保管します |
| HT - 2は、標準溶液の作業 | ピペット2ミリリットル校正されたメスフラスコにHT - 2トキシンのストック溶液20ml及びトリコテセン毒素の10μg/ mlを含むHT - 2ワーキング溶液を調製するためにアセトニトリルで希釈する。 | このソリューションは、新鮮な使用の当日に準備する必要があります。 |
| 較正ソリューションワーキングHT - 2 | ワーキング較正液100 ng / mlに調製するためにHT - 2作業標準溶液(10μg/ ml)を希釈する。下記の濃度0(ブランク)、0.5、1、2、4、10 ng / mlの較正ソリューションを作業準備するHT - 2営業較正液100 ng / mlに希釈する。 | これらのソリューションは、使用当日に新しく調製する必要があります。 |
| KLHとHT - 2共役 | 350μlのの単回使用アリコートにKLH(キーホールリンペットヘモシアニン)ストック溶液(PBSで1 mg / ml)でHT - 2共役分割。 | -30℃で保存のアリコート |
| 特異的モノクローナル抗体 | 競争のステップで使用するPBS中のモノクローナル抗体のストック濃度(1.383 mg / ml)を:1:350(V V)を希釈する | この溶液は使用時の瞬間に新しく調製する必要があります。 3.5ミリリットルの最終体積のPBSで10 mlの抗体ストック溶液は、17の規格及び/またはサンプルを分析するのに十分です。 |
| 二次標識抗体 | PBSでの競争のステップで使用する:アルカリフォスファターゼで標識抗マウスIgG(H + L)を1:100(V V)が希釈される。 | 10mlの最終容量のPBSで100μlの抗体ストック溶液は、25の規格及び/またはサンプルを分析するのに十分です。この溶液は使用時の瞬間に新しく調製する必要があります。 |
装置
| 試薬の名前 | 会社 | コメント(省略可能) |
| 磁性粒子コンセントレータ:MPC ® - S | DYNAL | |
| PalmSensの楽器 | PalmSens | PalmSens Liteは、シリアルケーブル接続しているPCのラップトップおよびマルチプレクサのオプションのソフトウェアで提供 |
| CH8 PalmSensマルチプレクサ | PalmSens | |
| 8チャンネルマルチプレクサの電気的接触 | ハンドメイド | |
| eightスクリーン印刷電極(SPEは)とストリップ | ハンドメイド | |
| 電極ストリップのために特別に設計サポート | ハンドメイド | SPEの各作用電極表面の下に配置され、それぞれが8ネオジウム磁石が含まれています |
| 校正済みマイクロタイターピペット | ギルソン | |
| マグネチックスターラーとスターラーバー。 | ||
| ガラスビーカー(100、50、20ml)に。 | ||
| メスフラスコ(2ミリリットル)。 | ||
| 0.2〜2ミリリットルエッペンドルフチューブ。 | エッペンドルフ | |
| 5ミリリットルと15ミリリットルのファルコン™チューブ。 | ファルコン | |
| 実験室ボルテックスミキサー | proteic部品の変性を避けるために免疫学的なチェーンでHT2 - KLHでコーティングされたまたはリンクされた磁気ビーズを再懸濁するためにボルテックスミキサーを使用しないでください。 | |
| 実験室のオーブンやサーモスタット部屋 | 温度37 ± 3℃を維持することができるオーブンを選ぶ |
参考文献
- Koch, P. State of the art of trichothecenes analysis. Toxicol. Letters. 153, 109-112 (2004).
- Krska, R., Baumgartner, S., Josephs, R. State of the art in the analysis of type-A and-B trichothecene mycotoxins in cereals. Fresenius J. Anal. Chem. 371, 285-299 (2001).
- Morozova, T. Y., Morozov, V. N. Force differentiation in recognition of cross-reactive antigens by magnetic beads. Anal. Biochem. , 263-271 (2008).
- FAO Food and Nutrition Paper 74. JOINT FAO/WHO EXPERT COMMITTEE ON FOOD ADDITIVES Fifty-sixth meeting. 2001 Feb 6-15, Geneva, , Food & Agricultural Organization of the United Nations. 115 (2001).
- Piermarini, S., Volpe, G., Ricci, F., Micheli, L., Moscone, D., Palleschi, G., Fuhrer, M., Krska, R., Baumgartner, S. Rapid Screening Electrochemical Methods for Aflatoxin B1 and Type-A Trichothecenes: a preliminary study. Anal. Lett. 40, 1333-1346 (2007).
- Findlay, J. W. A., Dillard, R. F. Appropriate calibration curve fitting in ligand binding assays. AAPS J. 9 (2), E260-E267 (2007).
- Ricci, F., Volpe, G., Micheli, l, Palleschi, G. A review on novel developments and applications of immunosensors in food analysis. Anal. Chim. Acta. 605 (2), 111-129 (2007).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved