Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Todo el montaje El análisis inmunohistoquímico de la piel del miembro Vasculatura embrionarias: un sistema modelo para estudiar la morfogénesis vascular ramificación en embriones
En este artículo
Resumen
Se introduce un inmunohistoquímica todo el montaje y la microscopía confocal de barrido láser con múltiples etiquetas para analizar la formación de complejos de la red vascular de la piel del ratón extremidades embrionarias.
Resumen
Todo el montaje análisis inmunohistoquímico para obtener imágenes de todo el sistema vascular es fundamental para la comprensión de los mecanismos celulares de la ramificación morfogénesis. Hemos desarrollado el modelo de la piel del miembro vasculatura para estudiar el desarrollo vascular en el que un pre-existentes primitivo plexo capilar se reorganiza en una red jerárquica ramificada vascular. Todo el montaje de microscopía confocal con el etiquetado múltiple permite a la imagen robusta de los vasos sanguíneos intactos, así como sus componentes celulares incluyendo las células endoteliales, pericitos y células de músculo liso, utilizando marcadores fluorescentes específicos. Los avances en este modelo las extremidades vasculatura la piel con los estudios genéticos han permitido comprender los mecanismos moleculares del desarrollo vascular y el patrón. La piel del miembro vasculatura modelo ha sido utilizado para estudiar cómo los nervios periféricos proporcionan un modelo espacial para la diferenciación y el patrón de las arterias. En este artículo se describe un protocolo de vídeo sencillo y robusto para teñir los vasos sanguíneos intactos con vascular anticuerpos específicos y anticuerpos fluorescentes secundaria, que es aplicable para vascularizado órganos embrionarios en los que son capaces de seguir el proceso de desarrollo vascular.
Protocolo
1. Ratón recogida de la piel del miembro embrionarias (E13.5 E17.5 ~)
- Eutanasia conectado mujeres mediante el procedimiento de aprobación. De acuerdo con el protocolo aprobado animales, las hembras se sacrifican por el CO 2 de exposición y luego aseguró por dislocación cervical. Coloque el animal en su toalla de papel absorbente y disfrutar a fondo en el 70% de EtOH / H 2 O de un frasco.
- Diseccionar el útero intacto y colocarlo en un 100 x 15 mm placa de Petri que contiene solución salina equilibrada de helado de Hanks (HBSS) para limpiarla de sangre.
- Separados y diseccionar el embrión. Quitar el amnios muy delgada a partir del embrión.
- (Opción) la disección de un solo embrión en un plato de 35 x 10 mm Petri si cada embrión debe ser genotipo. Cola disecados se transfiere a un tubo de PCR de 0,2 ml para el genotipado.
- Cortar las extremidades anteriores del embrión y la transferencia de las extremidades anteriores con una pinza de anillo en 24 pocillos con 2 ml de helado de dulce 4% paraformaldehído (PFA) en tampón fosfato salino (PBS).
- Fijar las patas delanteras con una suave mezcla en el mezclador Nutator a 4 ° C durante la noche.
- Al día siguiente, retire la PFA y lavar tres veces durante 5 minutos en 2 ml de PBS con agitación suave en el mezclador de Nutator a temperatura ambiente.
- Transferencia de las patas delanteras en el 100% de metanol (MeOH) y almacenarlas a -20 ° C congelador enzima (el congelador con el control de la temperatura crítica y sin función automática de descongelación). Anticuerpos primarios en la tabla 1 el trabajo después del tratamiento con MeOH al 100%.
- La piel de fuera de la extremidad anterior con unas pinzas finas. La piel del miembro, cuando se deshidrata, deben separarse fácilmente de la extremidad. En primer lugar la extremidad con la cara ventral (lado de la palma) hacia arriba. Luego, usando unas pinzas finas, cortar la piel, como se muestra en el video. A continuación diseccionar alrededor de toda la extremidad, el pelado de la piel de suavidad sin ningún tipo de daño.
2. Todo el montaje la tinción inmunohistoquímica de Skins extremidades
- Rehidratar la piel de las extremidades en polipropileno de 5 ml de fondo redondo de tubo mediante la incubación a través de la serie graduada de MeOH / PBT (PBS + 0,2% Triton X-100) (75%, 50%, 25%) durante 5 minutos cada uno. Tenga en cuenta que el intercambio de soluciones debe tener cuidado para no dañar las pieles de las extremidades.
- Lavar dos veces durante 5 min en PBT con una suave mezcla en el mezclador de Nutator a temperatura ambiente.
- Bloquear la piel del miembro, ya sea con 10% de suero de cabra / PBS 0,2% TX100 tampón de bloqueo para detectar anticuerpos de cabra secundaria o el 10% de suero burro / PBS 0,2% TX100 tampón de bloqueo para detectar anticuerpos burro secundaria durante 2 horas con agitación suave en el mezclador en Nutator a temperatura ambiente.
- Colocar las cáscaras en una extremidad 35 x 10 mm placa de Petri y la transferencia con una pinza de anillo en el tubo de 2 ml-microcentrífuga con 800μl de anticuerpos primarios (dilución adecuada como se indica en las tablas) en el tampón de bloqueo (ya sea de cabra 10% de suero / PBS 0,2 TX100% o 10% de suero de burro / PBS 0,2% TX100). Incubar las pieles de las extremidades con una suave mezcla en el mezclador de Nutator a 4 ° C durante la noche. Tenga en cuenta que varios anticuerpos primarios derivados de las diferentes especies (por ejemplo, el anticuerpo monoclonal de rata + anticuerpo policlonal de conejo) se pueden utilizar simultáneamente.
- Al día siguiente, el lugar de la piel del miembro en un 35 x 10 mm placa de Petri y la transferencia con una pinza de anillo en polipropileno de 5 ml de fondo redondo de tubo con 4 ml de la solución de lavado (ya sea de cabra 2% de suero / PBS 0,2% o 2 TX100 % burro suero / PBS 0,2% TX100).
- Lavar cinco veces durante 15 minutos con la mezcla suave en el mezclador de Nutator a temperatura ambiente.
- Colocar las cáscaras en una extremidad 35 x 10 mm placa de Petri y la transferencia con una pinza de anillo en el tubo de 2 ml-microcentrífuga con 800μl de secundaria de anticuerpos en el amortiguador de bloqueo (ya sea de cabra 10% de suero / PBS 0,2% TX100 o el 10% burro suero / PBS 0,2% TX100). Normalmente se utiliza anticuerpos secundarios de Jackson ImmunoResearch (Cy3, Cy5, 1:300 diluciones) o Invitrogen (Alexa Fluor 488, Alexa Fluor 568, Alexa Fluor 633, 1:250 dilución). Filtrar la solución secundaria de anticuerpos con 0.22μm PVDF filtros de jeringa de membrana para eliminar las partículas de agregados de la secundaria de anticuerpos. Incubar la piel de las extremidades en la oscuridad o envuelto con papel de aluminio durante 1 hora con agitación suave en el mezclador de Nutator a temperatura ambiente. Tenga en cuenta que diferentes anticuerpos conjugados fluorescentes secundarios derivados de las diferentes especies se pueden utilizar simultáneamente.
- Colocar las cáscaras en una extremidad 35 x 10 mm placa de Petri y la transferencia con una pinza de anillo en polipropileno de 5 ml de fondo redondo de tubo con 4 ml de la solución de lavado (ya sea de cabra 2% de suero / PBS 0,2% o 2% TX100 burro suero / PBS 0,2% TX100). Lavar cinco veces durante 15 minutos en la oscuridad o envuelto con papel de aluminio con mezclado suave en el mezclador de Nutator a temperatura ambiente.
- (Opción para contratinción contra el núcleo) Incubar las pieles de las extremidades con 4 ml de la solución de lavado (ya sea de cabra 2% de suero / PBS 0,2% o 2% TX100 burro suero / PBS 0,2% TX100) con A-Pro-3 (Invitrogen T3605 , dilución 1:3000) en la oscuridad o envuelto con papel de aluminio durante 10 minutos con la mezcla suave en el mezclador de Nutator en la sala de temre. A continuación, lavar tres veces por 5 min con 4 ml de la solución de lavado (ya sea de cabra 2% de suero / PBS 0,2% o 2% TX100 burro suero / PBS 0,2% TX100) en la oscuridad o envuelto con papel de aluminio con mezcla suave el mezclador Nutator a temperatura ambiente. Tenga en cuenta que la tinción fuerte y específica para los núcleos que se observa para To-Pro-3 en una emisión específica (HeNe 633 nm de excitación).
3. Montaje de los Skins en la extremidad de diapositivas
- Colocar las cáscaras en una extremidad 35 x 10 mm plato de Petri. Eliminar el polvo, los cristales, las fibras de la capa interna de la piel con unas pinzas finas bajo el microscopio estereoscópico con poca iluminación para evitar la foto de un extenso descoloramiento.
- Transferencia de las pieles de las extremidades para portaobjetos adhesivos con una pinza de anillo. Coloque las pieles con la capa interna mentir al alza en la diapositiva (es decir, hacia cubreobjetos). Aplanar la piel cuidadosamente con unas pinzas finas y eliminar traspaso de tampón de lavado por Kimwipe.
- Monte en la lucha contra la decoloración medios de montaje sin burbujas de aire. Utilizamos 25 "x25" cubreobjetos. Cura en una superficie plana en la oscuridad (por ejemplo, las muestras montadas con prolongar el reactivo de oro se colocan durante la noche en la oscuridad a temperatura ambiente antes de ver). Para almacenamiento a largo plazo, sellar el cubreobjetos a la diapositiva y se almacenan a 4 ° C.
4. Microscopía Confocal
- Establecer láser adecuado para fluoróforos. Utilizamos microscopio Leica TCS SP5 confocal con tres fuentes láser de argón incluyendo 488nm (por Alexa Fluor 488 y GFP), 561nm DPSS (por Alexa Fluor 568 y Cy3) y HeNe 633 nm (por Alexa Fluor 633, Cy5 y To-Pro-3) .
- Use la herramienta de búsqueda secuencial para evitar o reducir la interferencia en la que todos los colorantes en las muestras de doble o triple del manchar-se entusiasma al mismo tiempo. En el modo de exploración secuencial, las imágenes se grabarán en un orden secuencial.
- Más información general sobre los tintes fluorescentes y láser para la excitación puede ser fundada en "Microscopía Confocal de Biología" por Hibbs (2004)
5. Resultados representante
Todo el montaje immnofluorescence microscopía confocal de triple sello en la piel del ratón en el miembro anterior E15.5 con anticuerpos para el marcador de células endoteliales pan-PECAM-1 (Figura 1-C, D azul), el marcador de neurofilamentos 2H3 (Figura 1 verde), y las células de músculo liso marcador αSMA (Figura 1 A, B rojo) revela un patrón característico de ramificación de las arterias αSMA +, alineado con 2H3 + nervios periféricos en la piel del miembro. Además de la ramificación de los vasos sanguíneos, la piel esta extremidad modelo vascular se utiliza para estudiar los patrones de ramificación de vasos linfáticos con anticuerpos para el marcador de las células endoteliales linfáticas LYVE-1 (Figura 1 D, E de color rojo) y Neuropilin2 (NRP2) (Figura 1 D, F verde ).
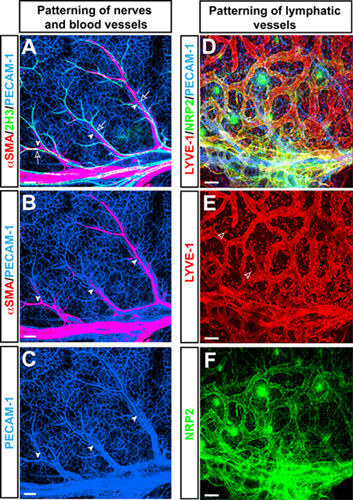
Figura 1. (AC) Las arterias se alinean con los nervios periféricos en la piel del miembro embrionario. Todo el montaje de triple sello microscopía confocal immnofluorescence con anticuerpos para el marcador de células endoteliales pan-PECAM-1 (AC, azul), el marcador de neurofilamentos 2H3 (A, verde), y el marcador de las células musculares lisas αSMA (A y B, de color rojo ) se muestra. En E15.5, 2H3 + nervios periféricos (flechas abiertas) asociados con las arterias (puntas de flecha), que están cubiertos por αSMA + en las células del músculo liso. (DF) linfático vascular en la piel del miembro embrionario. Triple-etiqueta de la microscopía confocal immnofluorescence con anticuerpos para el marcador de células endoteliales pan-PECAM-1 (D, azul), el marcador de las células endoteliales linfáticas LYVE-1 (D y E, de color rojo) y Neuropilin2 (NRP2) (D y F, verde ) se muestra. Los vasos linfáticos son visualizados por tanto LYVE-1 y NRP2, mientras que LYVE-1 también se expresa por una parte de los macrófagos (puntas de flecha abierta). Barra de escala: 100μm.
Access restricted. Please log in or start a trial to view this content.
Discusión
El sistema vascular es fundamental para el desarrollo de órganos durante la embriogénesis, así como para el mantenimiento de órganos y funciones de reproducción en los adultos, ya que proporciona suficiente oxígeno y nutrientes a los órganos. Red vascular adecuado es bien establecido, con procesos complejos y múltiples pasos por la angiogénesis en el que se reorganiza pre-existentes de la red capilar con estructuras muy ramificadas y jerárquica. A pesar de numerosos trabajos han demostrado que una variedad de ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Damos las gracias a K. Gill para obtener ayuda con la cría del ratón y el cuidado y la gestión de laboratorio. Gracias también a los miembros Mukoyama laboratorio para ayuda técnica. El financiamiento fue proporcionado por el Programa de Investigación Intramural del Instituto de Salud Naitonal.
Access restricted. Please log in or start a trial to view this content.
Materiales
Anticuerpos
Pan-marcador de las células endoteliales
| Name | Company | Catalog Number | Comments | |
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| PECAM-1 | Hamster Armenia (M) | Chemicon | MAB1398Z | Dilución 1:100 # 1 |
| PECAM-1 | Rata (M) | BD | 553369 | 1:300 dilución |
| VEGFR2 | Rata (M) | eBioscience | 14-5821-82 | Dilución 1:200 |
| CD34 | Rata (M) | eBioscience | 13-0341 | 1:300 dilución |
| Colágeno IV | Conejo (P) | AbD Serotec | 2150-1470 | 1:300 dilución # 2 |
Marcador de células endoteliales arteriales
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| Neuropilin1 | Conejo (P) | El laboratorio de la Kolodkin Alex # 3 | Dilución 1:3000 | |
| Unc5H2 | Cabra (P) | I + D | AF1006 | Dilución 1:200 |
Venosa marcador de células endoteliales
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| EphB4 | Cabra (P) | I + D | AF446 | Dilución 1:100 |
Linfático marcador de células endoteliales
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| LYVE-1 # 4 | Conejo (P) | Abcam | ab14917 | Dilución 1:200 |
| LYVE-1 # 4 | Rata (M) | MBL | D225-3 | Dilución 1:200 |
| Prox-1 | Conejo (P) | Chemicon | AB5475 | Dilución 1:1000 |
| Prox-1 | Cabra (P) | I + D | AF2727 | Dilución 1:50 |
| Neuropilin2 | Conejo (P) | Señalización Celular | 3366 | 1, 100 de dilución |
| Podoplanin | Hámster sirio (M) | Banco hibridoma | 8.1.1 | Dilución 1:200 |
Células del músculo liso / pericitos marcador
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| αSMA-Cy3 | Ratón (M) # 5 | Sigma | c-6198 | Dilución 1:500 # 6 |
| NG2 | Conejo (P) | Chemicon | AB5320 | Dilución 1:200 |
| SM22α | Conejo (P) | Abcam | ab14106 | Dilución 1:200 |
Los anticuerpos para el reportero GFP
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| Las buenas prácticas agrarias | Conejo (P) | Invitrogen | A11122 | 1:300 dilución |
| Las buenas prácticas agrarias | Rata (M) | Nacalai Tesque | 04404-84 | Dilución 1:1000 |
| Las buenas prácticas agrarias | Pollo (P) | Chemicon | P42212 | 1:300 dilución |
Los anticuerpos para el reportero LacZ
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| β-gal | Conejo (P) | MP Biomédica | 55976 | Dilución 1:5000 |
| β-gal | Cabra (P) | AbD Serotec | 4600-1409 | Dilución 1:500 |
| β-gal | Pollo (P) | Abcam | ab9361 | Dilución 1:200 |
Los anticuerpos de los axones periféricos
| Anticuerpo | Especies | Empresa | Catálogo # | Condiciones de trabajo |
| 2H3 | Ratón (M) # 7 | Banco hibridoma | 2H3 | Dilución 1:200 |
| Tuj1 | Ratón (M) # 8 | Covance | MMS-435P | Dilución 1:500 |
| Periferina | Conejo (P) | Chemicon | AB1530 | Dilución 1:1000 |
Anticuerpos para la migración de las células de Schwann
| BFABP | Conejo (P) | El laboratorio de Thomas Müller es # 9 | Dilución 1:3000 |
(P): anticuerpo policlonal (M): anticuerpo monoclonal
# 1: de cabra anti-armenio hámster-Cy3 (Jackson ImmunoResearch 127-165-160) de anticuerpos debe ser utilizado como anticuerpo secundario.
# 2: Los anticuerpos colágeno IV puede ser utilizado para detectar los vasos sanguíneos después de la hibridación in situ.
# 3: El anticuerpo es Neuropilin1 amablemente proporcionados por el laboratorio de la Kolodkin de Alex en la Universidad Johns Hopkins. De oveja anti-anticuerpos humanos Neuropilin1 está disponible en I + D (AF3870), aunque no lo he probado todavía.
# 4: Los anticuerpos LYVE-1 también se detecta un subconjunto de los macrófagos en la piel embrionaria.
# 5: El anticuerpo anti-ratón de anticuerpos es αSMA monoclonal IgG2a.
# 6: El anticuerpo conjugado con Cy3 αSMA se incuba durante 1 hora a temperatura ambiente, junto con el secanticuerpos secundaria de otros anticuerpos primarios.
# 7: 2H3 anticuerpo IgG1 monoclonal de ratón de anticuerpos contra neurofilamentos.
# 8: Tuj1 anticuerpo monoclonal IgG2a de ratón de anticuerpos contra las neuronas específicas de la clase III beta-tubulina.
# 9: El BFABP (cerebro-específica de ácidos grasos de unión a proteínas) de anticuerpos es amablemente proporcionados por el laboratorio Thomas Müller en Max-Delbrück-Center de Medicina Molecular.
Referencias
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados