È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Con tutto il supporto per l'analisi immunoistochimica vasi embrionali pelle degli arti: un sistema modello per studiare morfogenesi vascolare diramazione in embrione
In questo articolo
Riepilogo
Introduciamo un tutto-mount immunoistochimica e microscopia confocale a scansione laser con l'etichettatura per analizzare più intricata la formazione della rete vascolare nella pelle degli arti embrionali di topo.
Abstract
Tutto-mount analisi immunoistochimica per l'imaging la vascolarizzazione intera è fondamentale per la comprensione dei meccanismi cellulari di ramificazione morfogenesi. Abbiamo sviluppato la pelle modello vascolarizzazione degli arti per lo studio dello sviluppo vascolare in cui viene riorganizzato un preesistente primitivo plesso capillare in una rete ramificata gerarchicamente vascolare. Tutto-mount microscopia confocale con etichettatura più permette l'imaging con robusto dei vasi sanguigni intatti così come i loro componenti cellulari, comprese le cellule endoteliali, periciti e cellule muscolari lisce, utilizzando specifici marcatori fluorescenti. I progressi in questo modello vascolarizzazione della pelle degli arti con studi genetici hanno migliorato la comprensione dei meccanismi molecolari di sviluppo vascolare e patterning. La pelle modello vascolarizzazione degli arti è stato utilizzato per studiare come i nervi periferici fornire un modello spaziale per la differenziazione ed il modello delle arterie. In questo articolo video descrive un protocollo semplice e robusto per colorare i vasi sanguigni intatti vascolare con anticorpi specifici e anticorpi secondari fluorescenti, che è applicabile per vascolarizzato organi embrionali dove siamo in grado di seguire il processo di sviluppo vascolare.
Protocollo
1. La raccolta degli arti pelle embrionali di topo (~ E13.5 E17.5)
- Euthanize collegato femmine con procedura approvata. Secondo il nostro protocollo animali approvati, le femmine sono eutanasia da CO 2 l'esposizione e poi assicurata dalla dislocazione cervicale. Giaceva l'animale al tovagliolo di carta assorbente e immergerlo completamente nel 70% EtOH / H 2 O da una bottiglia a spruzzo.
- Sezionare l'utero intatto e mettetelo in un piatto da 100 mm x 15 Petri contenenti soluzione equilibrata Salt ghiacciata Hanks '(HBSS) per lavare nel sangue.
- Separati e sezionare l'embrione. Rimuovere il amnios molto sottile dall'embrione.
- (Opzione) Dissect un singolo embrione in un piatto x 35 10 millimetri Petri se ogni embrione deve essere genotipizzati. Coda sezionato viene trasferito in un tubo da 0,2 ml PCR per la genotipizzazione.
- Tagliare le zampe anteriori di embrione ed il trasferimento arti anteriori da una pinza l'anello in 24 pozzetti contenenti 2 ml di ghiacciata paraformaldeide fresca 4% (PFA) in tampone fosfato salino (PBS).
- Fissare le zampe anteriori con miscelazione delicata sulla Mixer Nutator a 4 ° C durante la notte.
- Il giorno seguente, togliere la PFA e lavare tre volte per 5 min in 2 ml di PBS con miscelazione delicata sulla Mixer Nutator a temperatura ambiente.
- Trasferimento degli arti anteriori in 100% di metanolo (MeOH) e memorizzarli congelatore a -20 ° C enzima (il congelatore con controllo della temperatura critica e senza funzione di sbrinamento automatico). Anticorpi primari indicati nella tabella 1 lavoro dopo il trattamento MeOH 100%.
- Pelle a buccia fuori dalla zampa anteriore con una pinzetta sottile. Cutanee degli arti, quando disidratato, dovrebbe separare facilmente dal arto. In primo luogo l'arto con il lato ventrale (lato palmo) verso l'alto. Quindi, utilizzando una pinzetta sottile, tagliare la pelle, come mostrato nel video. Avanti sezionare intorno tutto l'arto, desquamazione della pelle fuori delicatamente senza alcun danno.
2. Tutto-mount la colorazione immunoistochimica di Skins Limb
- Reidratare le pelli arto in polipropilene da 5 ml a fondo rotondo tubo incubando attraverso la serie graduata di MeOH / PBT (PBS + 0,2% Triton X-100) (75%, 50%, 25%) per 5 minuti ciascuno. Si noti che lo scambio di soluzioni dovrebbero fare attenzione a non danneggiare le bucce degli arti.
- Lavare due volte per 5 min in PBT con miscelazione delicata sulla Mixer Nutator a temperatura ambiente.
- Bloccare le pelli di capra arto o con 10% di siero / PBS +0,2% TX100 tampone di bloccaggio per gli anticorpi di capra secondario o al 10% Donkey siero / PBS +0,2% TX100 tampone di bloccaggio per gli anticorpi asino secondaria di 2 ore con miscelazione delicata sulla Mixer Nutator a a temperatura ambiente.
- Mettere le bucce arto su un piatto da 35 mm x 10 Petri e il trasferimento da una pinza ad anello in 2ml-microcentrifuga tubo con 800μl di anticorpi primari (diluizione appropriato tra quelli riportati nelle tabelle) nel tampone di bloccaggio (o di capra 10% di siero / PBS 0,2 TX100% o 10% Donkey siero / PBS TX100 +0,2%). Incubare le pelli arto con miscelazione delicata sulla Mixer Nutator a 4 ° C durante la notte. Si noti che più gli anticorpi primari derivati da specie diverse (ad esempio, anticorpo monoclonale di ratto + anticorpo policlonale di coniglio) possono essere utilizzati contemporaneamente.
- Il giorno seguente, posizionare le bucce arto su un piatto da 35 mm x 10 Petri e il trasferimento da una pinza l'anello in polipropilene da 5 ml a fondo rotondo tubo con 4 ml di tampone di lavaggio (sia il 2% siero di capra / PBS +0,2% TX100 o 2 Donkey% siero / PBS TX100 +0,2%).
- Lavare cinque volte per 15 minuti mescolando con delicato sulla Mixer Nutator a temperatura ambiente.
- Mettere le bucce arto su un piatto da 35 mm x 10 Petri e il trasferimento da una pinza ad anello in 2ml-microcentrifuga tubo con 800μl di anticorpi secondari nel buffer di blocco (o 10% siero di capra / PBS TX100 +0,2% o al 10% Donkey siero / PBS TX100 +0,2%). Di solito si usa anticorpi secondari da Jackson ImmunoResearch (Cy3, Cy5, diluizioni 1:300) o Invitrogen (Alexa Fluor 488, Alexa Fluor 568, Alexa Fluor 633, 1:250 diluizione). Filtrare la soluzione secondaria di anticorpi utilizzando 0.22μm PVDF filtri a membrana siringa per rimuovere le particelle aggregate degli anticorpi secondari. Incubare le bucce arto al buio o avvolti con fogli di alluminio per 1 ora mescolando con delicato sulla Mixer Nutator a temperatura ambiente. Si noti che diversi fluorescente anticorpi coniugati secondari derivati da specie diverse possono essere utilizzati contemporaneamente.
- Mettere le bucce arto su un piatto da 35 mm x 10 Petri e il trasferimento da una pinza l'anello in polipropilene da 5 ml a fondo rotondo tubo con 4 ml di tampone di lavaggio (sia il 2% siero di capra / PBS TX100 +0,2% o 2% Donkey siero / PBS +0,2% TX100). Lavare cinque volte per 15 minuti al buio o avvolti in fogli di alluminio con miscelazione delicata sulla Mixer Nutator a temperatura ambiente.
- (Opzione per la contro-contro nucleo) Incubare le pelli degli arti con 4 ml di tampone di lavaggio (sia Capra 2% siero / PBS TX100 +0,2% o 2% Donkey siero / PBS TX100 +0,2%), con A-Pro-3 (Invitrogen T3605 , diluizione 1:3000) al buio o avvolti con fogli di alluminio per 10 minuti mescolando con delicato sulla Mixer Nutator a temperatura temperare. Poi, lavare tre volte per 5 min con 4ml del buffer di lavaggio (sia il 2% siero di capra / PBS TX100 +0,2% o 2% Donkey siero / PBS TX100 +0,2%), al buio o avvolta da un foglio di alluminio con miscelazione delicata sulla Mixer Nutator a temperatura ambiente. Si noti che la colorazione forte e specifico per i nuclei si osserva per To-pro-3 in una emissione specifica (HeNe 633 nm di eccitazione).
3. Montaggio del Skins Limb su Slide
- Mettere le bucce arto su un piatto x 35 10 millimetri Petri. Rimuovere polveri, cristalli, fibre dallo strato interno della pelle con una pinzetta sottile con lo stereomicroscopio, con illuminazione bassa per evitare foto esteso sbiancamento.
- Trasferire le pelli arto per adesivo microscopio da una pinza ad anello. Posizionare le bucce con lo strato interno disteso verso l'alto della diapositiva (cioè verso coprioggetto). Appiattire la pelle accuratamente con una pinzetta sottile e rimuovere riporto il tampone di lavaggio da Kimwipe.
- Montare in supporti di montaggio anti-sbiadimento senza bolle d'aria. Utilizziamo 25 coprioggetto "x25". Cure su una superficie piana al buio (per esempio, i campioni montato utilizzando Prolungare reagente oro sono poste una notte al buio a temperatura ambiente prima linea). Per la conservazione a lungo termine, sigillare il coprioggetto alla diapositiva e conservare a 4 ° C.
4. Microscopia confocale
- Impostare laser appropriato per fluorofori. Noi usiamo microscopio confocale Leica TCS SP5 con tre sorgenti laser compresa Argon 488 nm (per Alexa Fluor 488 e GFP), DPSS 561nm (per Alexa Fluor 568 e Cy3) e HeNe 633nm (per Alexa Fluor 633, Cy5 e To-Pro-3) .
- Utilizzare lo strumento di scansione sequenziale per evitare o ridurre le interferenze, in cui tutti i coloranti in campioni di doppia o tripla macchiati saranno entusiasti al tempo stesso. Nella modalità di scansione sequenziale, le immagini verranno registrate in ordine sequenziale.
- Altre informazioni relative al coloranti fluorescenti e laser per l'eccitazione può essere fondata in "Microscopia confocale per biologi" di Hibbs (2004)
5. Rappresentante Risultati
Tutto-mount microscopia confocale tripla etichetta immnofluorescence in pelle di topo anteriore al E15.5 con anticorpi pan-marker delle cellule endoteliali PECAM-1 (Fig. 1A-C, D blu), il marker neurofilamenti 2H3 (Figura 1A verde), e le cellule muscolari lisce marcatore αSMA (Figura 1A, B rossa) ha rivelato un quadro caratteristico di ramificazione di αSMA arterie +, in linea con 2H3 + nervi periferici nella pelle degli arti. Oltre al vaso sanguigno ramificazione, questa skin modello vascolarizzazione degli arti vengono usati per studiare patterning di vasi linfatici branching tramite anticorpi per il marcatore delle cellule endoteliali linfatiche LYVE-1 (Figura 1D, E rosso) e Neuropilin2 (NRP2) (Figura 1D, F verde ).
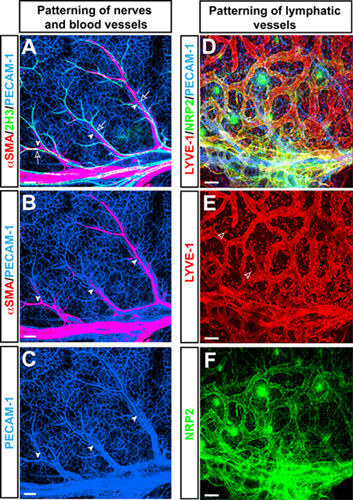
Figura 1. (AC) Arterie allinearsi con i nervi periferici nella pelle degli arti embrionali. Tutto-mount tripla etichetta microscopia confocale immnofluorescence con anticorpi pan-marker delle cellule endoteliali PECAM-1 (AC, blu), il marker neurofilamenti 2H3 (A, verde), e il buon marker delle cellule muscolari αSMA (A e B, rosso ) viene visualizzato. A E15.5, 2H3 + nervi periferici (frecce aperte) associare arterie (punte di freccia), che sono coperti da αSMA + cellule muscolari lisce. (DF) vasi linfatici nella pelle degli arti embrionali. Triple-label microscopia confocale immnofluorescence con anticorpi pan-marker delle cellule endoteliali PECAM-1 (D, blu), il marker delle cellule endoteliali linfatiche LYVE-1 (D ed E, rosso) e Neuropilin2 (NRP2) (D e F, verde ) viene visualizzato. Vasi linfatici sono visualizzate da entrambi LYVE-1 e NRP2, mentre LYVE-1 è espressa anche da un sottoinsieme di macrofagi (punte di freccia aperta). Scala grafica: 100μm.
Access restricted. Please log in or start a trial to view this content.
Discussione
Il sistema vascolare è fondamentale per lo sviluppo degli organi durante l'embriogenesi, nonché per la manutenzione degli organi e delle funzioni riproduttive negli adulti, in quanto fornisce sufficiente ossigeno e nutrienti agli organi. Adeguata rete vascolare è ben stabilita con processi complessi e multi-passo per l'angiogenesi in cui viene riorganizzato pre-esistente rete capillare di strutture fortemente ramificate e gerarchica. Sebbene numerose opere sono state dimostrato che una varietà di molecole è...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Riconoscimenti
Ringraziamo K. Gill per l'assistenza con l'allevamento del mouse e cura e per la gestione del laboratorio. Grazie anche a Mukoyama membri laboratorio per assistenza tecnica. Il finanziamento è stato fornito dal programma di ricerca intramurale degli Istituti Naitonal della Salute.
Access restricted. Please log in or start a trial to view this content.
Materiali
Anticorpi
Pan-marker delle cellule endoteliali
| Name | Company | Catalog Number | Comments | |
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| PECAM-1 | Criceto armeno (M) | Chemicon | MAB1398Z | Diluizione 1:100 # 1 |
| PECAM-1 | Rat (M) | BD | 553369 | Diluizione 1:300 |
| VEGFR2 | Rat (M) | eBioscience | 14-5821-82 | Diluizione 1:200 |
| CD34 | Rat (M) | eBioscience | 13-0341 | Diluizione 1:300 |
| Collagene IV | Coniglio (P) | ABD Serotec | 2150-1470 | Diluizione 1:300 # 2 |
Arterioso marker delle cellule endoteliali
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| Neuropilin1 | Coniglio (P) | Laboratorio del Kolodkin Alex # 3 | Diluizione 1:3000 | |
| Unc5H2 | Capra (P) | R & S | AF1006 | Diluizione 1:200 |
Venoso marker delle cellule endoteliali
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| EphB4 | Capra (P) | R & S | AF446 | Diluizione 1:100 |
Linfatico marker delle cellule endoteliali
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| LYVE-1 # 4 | Coniglio (P) | Abcam | ab14917 | Diluizione 1:200 |
| LYVE-1 # 4 | Rat (M) | MBL | D225-3 | Diluizione 1:200 |
| Prox-1 | Coniglio (P) | Chemicon | AB5475 | Diluizione 1:1000 |
| Prox-1 | Capra (P) | R & S | AF2727 | Diluizione 1:50 |
| Neuropilin2 | Coniglio (P) | Cell Signaling | 3366 | 1; 100 diluizione |
| Podoplanin | Criceto siriano (M) | Ibridomi Banca | 8.1.1 | Diluizione 1:200 |
Delle cellule muscolari lisce / periciti marcatore
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| αSMA-Cy3 | Mouse (M) # 5 | Sigma | c-6198 | Diluizione 1:500 # 6 |
| NG2 | Coniglio (P) | Chemicon | AB5320 | Diluizione 1:200 |
| SM22α | Coniglio (P) | Abcam | ab14106 | Diluizione 1:200 |
Anticorpi per giornalista GFP
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| GFP | Coniglio (P) | Invitrogen | A11122 | Diluizione 1:300 |
| GFP | Rat (M) | Nacalai tesque | 04404-84 | Diluizione 1:1000 |
| GFP | Chick (P) | Chemicon | P42212 | Diluizione 1:300 |
Anticorpi per giornalista LacZ
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| β-gal | Coniglio (P) | MP Biomedica | 55976 | Diluizione 1:5000 |
| β-gal | Capra (P) | ABD Serotec | 4600-1409 | Diluizione 1:500 |
| β-gal | Chick (P) | Abcam | ab9361 | Diluizione 1:200 |
Anticorpi per assoni periferici
| Anticorpo | Specie | Azienda | Catalogo # | Condizione di lavoro |
| 2H3 | Mouse (M) # 7 | Ibridomi Banca | 2H3 | Diluizione 1:200 |
| Tuj1 | Mouse (M) # 8 | Covance | MMS-435P | Diluizione 1:500 |
| Peripherin | Coniglio (P) | Chemicon | AB1530 | Diluizione 1:1000 |
Anticorpi per la migrazione di cellule di Schwann
| BFABP | Coniglio (P) | Il laboratorio di Thomas Müller # 9 | Diluizione 1:3000 |
(P): anticorpo policlonale, (M): anticorpo monoclonale
# 1: capra anti-armeno criceto-Cy3 (Jackson ImmunoResearch 127-165-160) anticorpo deve essere usato come anticorpo secondario.
# 2: l'anticorpo collagene IV può essere utilizzato per rilevare i vasi sanguigni dopo ibridazione in situ.
# 3: L'anticorpo Neuropilin1 è gentilmente fornito da laboratorio del Kolodkin di Alex nella Johns Hopkins University. Pecora anti-umano degli anticorpi Neuropilin1 è disponibile in R & S (AF3870), anche se non l'abbiamo ancora testato.
# 4: Il LYVE-1 anticorpi anche rilevare un sottoinsieme dei macrofagi nella pelle embrionale.
# 5: L'anti-αSMA anticorpo monoclonale di topo IgG2a.
# 6: Il Cy3-anticorpo coniugato αSMA è incubato per 1 ora a temperatura ambiente insieme al secanticorpi secondaria per gli altri anticorpi primari.
# 7: 2H3 anticorpo è topo monoclonale IgG1 contro neurofilamenti.
# 8: Tuj1 anticorpo è topo IgG2a anticorpi monoclonali contro Neuron specifica classe III beta-tubulina.
# 9: (cervello-specifiche di acidi grassi legame con le proteine) BFABP anticorpo è gentilmente fornito da laboratorio del Müller Thomas in Max-Delbrück-Centro di Medicina Molecolare.
Riferimenti
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon