É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Todo-mount Análise imuno-histoquímica para Vascularização embrionárias Limb pele: um sistema modelo para estudar Morfogênese Branching Vascular em Embrião
Neste Artigo
Resumo
Nós introduzimos um conjunto de montagem imunohistoquímica e microscopia confocal de varredura a laser com vários rotulagem para analisar a formação de uma intrincada rede vascular em pele de rato membro embrionárias.
Resumo
Todo-mount análise imunohistoquímica para a imagem latente toda a vasculatura é fundamental para a compreensão dos mecanismos celulares de ramificação morfogênese. Nós desenvolvemos o membro modelo vascularização da pele para estudar o desenvolvimento vascular em que um pré-existentes primitiva do plexo capilar é reorganizado em uma rede hierarquicamente ramificada vascular. Todo-mount microscopia confocal com rotulagem múltiplos permite imagem robusta dos vasos sanguíneos intacta, assim como seus componentes celulares, incluindo células endoteliais, pericitos e células musculares lisas, usando marcadores fluorescentes específicos. Avanços neste modelo vasculatura membro pele com estudos genéticos têm melhorado a compreensão dos mecanismos moleculares do desenvolvimento vascular e padronização. O membro modelo vasculatura da pele tem sido usada para estudar como os nervos periféricos fornecer um modelo espacial para a diferenciação e padronização das artérias. Este artigo descreve um protocolo de vídeo simples e robusto para corar vasos sanguíneos vascular intacto com anticorpos específicos e fluorescentes anticorpos secundários, que é aplicável para os órgãos vascularizados embrionárias, onde somos capazes de acompanhar o processo de desenvolvimento vascular.
Protocolo
1. Coleta de rato Pele Limb embrionárias (E13.5 E17.5 ~)
- Euthanize conectado fêmeas através de um procedimento aprovado. De acordo com nosso protocolo aprovado animais, as fêmeas são sacrificados por exposição ao CO 2 e, em seguida, assegurada por deslocamento cervical. Lay o animal à sua toalha de papel absorvente e deixe-o completamente em 70% EtOH / H 2 O de uma garrafa squeeze.
- Dissecar o útero intacto e coloque-o em um prato 100 15 mm x Petri contendo solução gelada de Hanks salina balanceada (HBSS) para lavar o sangue.
- Separado e dissecar o embrião. Remover o âmnio muito fina a partir do embrião.
- (Opção) Dissecar um único embrião em um 35 10 mm x placa de Petri se cada embrião deve ser genotipados. Dissecados cauda é transferido para um tubo de 0,2 ml PCR para genotipagem.
- Cortar as patas dianteiras do embrião e transferência forelimbs por uma pinça de anel em 24 placa bem contendo 2 ml de gelado paraformaldeído frescos 4% (PFA) em tampão fosfato salino (PBS).
- Corrigir o forelimbs com suave mistura na Mixer Nutator a 4 ° C durante a noite.
- No dia seguinte, retire a PFA e lavar três vezes por 5 min em 2 ml de PBS com leve mistura no Mixer Nutator à temperatura ambiente.
- Transferir os membros anteriores em metanol 100% (MeOH) e armazená-los freezer a -20 ° C enzima (o freezer com controle de temperatura crítica e sem função de descongelação automática). Anticorpos primárias constantes da Tabela 1 trabalho após o tratamento MeOH 100%.
- Peeling off do membro anterior, usando uma pinça fina. Pele dos membros, quando desidratado, deve separar facilmente a partir do membro. Primeiro lugar o membro com o lado ventral (lado da palma) voltado para cima. Em seguida, usando uma pinça fina, cortar a pele, como mostrado no vídeo. Próxima dissecar todo o membro inteiro, descascando a pele suavemente, sem qualquer dano.
2. Toda montagem de coloração imuno-histoquímica de Skins Limb
- Hidratar as peles de membros em 5ml de polipropileno tubos de fundo redondo, incubando através da série graduada de MeOH / PBT (PBS + 0,2% Triton X-100) (75%, 50%, 25%) por 5 min cada. Note-se que a troca de soluções deve ser cuidadoso para não danificar as peles dos membros.
- Lavar duas vezes por 5 min em PBT com suave mistura na Mixer Nutator à temperatura ambiente.
- Bloquear o membro com peles de cabra ou 10% de soro / PBS 0,2% TX100 tampão de bloqueio por anticorpos de cabra secundário ou 10% Donkey soro / PBS 0,2% TX100 tampão de bloqueio por anticorpos burro secundário por 2 horas com a mistura suave no Mixer Nutator em temperatura ambiente.
- Coloque as cascas dos membros em um prato de 35 10 mm x Petri e transferência por uma pinça anel em microcentrífuga-2ml tubo com 800μl de anticorpos primários (diluição adequada, conforme listado nas tabelas) no tampão de bloqueio (ou 10% de soro de cabra / PBS 0,2 TX100% ou 10% Donkey soro / PBS 0,2% TX100). Incubar as peles membro com suave mistura na Mixer Nutator a 4 ° C durante a noite. Note-se que vários anticorpos primários derivados de espécies diferentes (por exemplo, anticorpo monoclonal de rato + anticorpo policlonal de coelho) podem ser usados simultaneamente.
- No dia seguinte, coloque as peles do membro em um prato de 35 10 mm x Petri e transferência por uma pinça anel em polipropileno 5ml de fundo redondo de tubo com 4ml da solução de lavagem (ou 2% de soro de cabra / PBS 0,2% ou 2 TX100 Donkey% de soro / PBS 0,2% TX100).
- Lavar cinco vezes por 15 minutos com a mistura suave no Mixer Nutator à temperatura ambiente.
- Coloque as cascas dos membros em um prato de 35 10 mm x Petri e transferência por uma pinça anel em microcentrífuga-2ml tubo com 800μl de anticorpos secundária no tampão de bloqueio (ou 10% de soro de cabra / PBS 0,2% ou 10% TX100 Donkey soro / PBS 0,2% TX100). Normalmente usamos anticorpos secundários a partir de Jackson ImmunoResearch (Cy3, Cy5, 1:300 diluições) ou Invitrogen (Alexa Fluor 488, Alexa Fluor 568, Alexa Fluor 633, 1:250 diluição). Filtrar a solução usando anticorpo secundário 0.22μm PVDF filtros de membrana seringa para remover as partículas agregadas dos anticorpos secundários. Incubar as peles dos membros no escuro ou envolto com papel alumínio por 1 hora com a mistura suave na Mixer Nutator à temperatura ambiente. Note-se que diferentes fluorescentes conjugados anticorpos secundários derivados de espécies diferentes podem ser usados simultaneamente.
- Coloque as cascas dos membros em um prato de 35 10 mm x Petri e transferência por uma pinça anel em 5ml de polipropileno tubos de fundo redondo com 4ml da solução de lavagem (ou 2% de soro de cabra / PBS 0,2% ou 2% TX100 Donkey soro / PBS 0,2% TX100). Lavar cinco vezes por 15 min no escuro ou envolto com folha de alumínio com a mistura suave no Mixer Nutator à temperatura ambiente.
- (Opção para contracoloração contra núcleo) Incubar as peles membro com 4ml da solução de lavagem (ou cabra 2% de soro / PBS 0,2% ou 2% TX100 Donkey soro / PBS 0,2% TX100) com To-Pro-3 (Invitrogen T3605 , 1:3000 diluição) no escuro ou envolto com papel alumínio por 10 minutos com a mistura suave no Mixer Nutator na sala de temperature. Então, lave três vezes por 5 min com 4ml da solução de lavagem (ou 2% de soro de cabra / PBS 0,2% ou 2% TX100 Donkey soro / PBS 0,2% TX100) no escuro ou envolto por folhas de alumínio com a mistura suave no o Mixer Nutator à temperatura ambiente. Note-se que a coloração forte e específica para núcleos é observado para To-pro-3 em uma emissão específica (HeNe excitação nm 633).
3. Montagem do Skins Limb no slide
- Coloque as cascas em um membro 35 10 mm x placa de Petri. Remover poeiras, cristais, fibras da camada interna da pele, usando uma pinça fina sob o estereomicroscópio com iluminação baixa para evitar a foto branqueamento extensivo.
- Transferir os skins membro para lâmina de microscópio adesiva por uma pinça de anel. Coloque as peles com a camada interna deitada para cima no slide (ou seja, para lamela). Achate as peles cuidadosamente usando uma pinça fina e remover carry-over tampão de lavagem por Kimwipe.
- Montagem em anti-fade meios de montagem sem bolhas de ar. Nós usamos 25 "x25" lamela. Cura em uma superfície plana no escuro (por exemplo, as amostras montado usando Prolongar reagente de ouro são colocadas durante a noite no escuro à temperatura ambiente antes de visualizar). Para armazenamento a longo prazo, vedar a lamela para o slide e armazenar a 4 ° C.
4. Microscopia confocal
- Criar lasers apropriados para fluoróforos. Usamos Leica TCS microscópio confocal SP5 com três fontes de laser de argônio, incluindo 488nm (para Alexa Fluor 488 e GFP), 561nm DPSS (por Alexa Fluor 568 e Cy3) e 633 nm HeNe (por Alexa Fluor 633, Cy5 e Para-Pro-3) .
- Use a ferramenta de busca sequencial para evitar ou reduzir a interferência em que todos os corantes em amostras de dobrar ou triplicar manchada será animado ao mesmo tempo. No modo de varredura seqüencial, as imagens serão gravadas em uma ordem seqüencial.
- Mais informações gerais sobre corantes fluorescentes e lasers para a excitação pode ser fundada em "Microscopia Confocal para biólogos" por Hibbs (2004)
5. Resultados representante
Todo-mount microscopia confocal triple-label immnofluorescence em pele de rato forelimb em E15.5 com anticorpos para o marcador de células pan-endotelial PECAM-1 (Figura 1A-C, D azul), o marcador neurofilamento 2H3 (Figura 1A verde), e o marcador de células musculares lisas αSMA (Figura 1A, B vermelho) revelou um padrão característico de ramificação das artérias αSMA +, alinhado com 2H3 + nervos periféricos na pele dos membros. Além de ramificação dos vasos sanguíneos, este membro modelo vascularização da pele é usada para estudar padrões de ramificação de vasos linfáticos utilizando anticorpos para o marcador de células endoteliais linfáticas lyve-1 (Figura 1D, E vermelha) e Neuropilin2 (NRP2) (Figura 1D, F verde ).
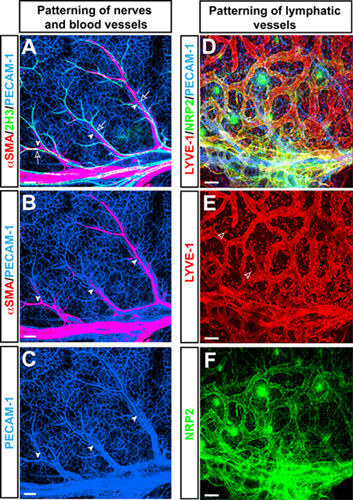
Figura 1. (AC) Artérias alinhar com os nervos periféricos na pele dos membros embrionárias. Todo-mount-label triple microscopia confocal immnofluorescence com anticorpos para o marcador de células pan-endotelial PECAM-1 (AC, azul), o marcador neurofilamento 2H3 (A, verde), eo marcador de células musculares lisas αSMA (A e B, vermelho ) é mostrado. No E15.5, 2H3 + nervos periféricos (setas abertas) associado com artérias (setas), que são cobertos por αSMA + células musculares lisas. (DF) vasculatura linfática na pele dos membros embrionárias. Label triple-microscopia confocal immnofluorescence com anticorpos para o marcador de células pan-endotelial PECAM-1 (D, azul), o marcador de células endoteliais linfáticas lyve-1 (D e E, vermelho) e Neuropilin2 (NRP2) (D e F, verde ) é mostrado. Vasos linfáticos são visualizados por ambos lyve-1 e NRP2, enquanto lyve-1 também é expressa por um subconjunto de macrófagos (setas abertas). Barra de escala: 100μm.
Access restricted. Please log in or start a trial to view this content.
Discussão
O sistema vascular é fundamental para o desenvolvimento do órgão durante a embriogênese, bem como para a manutenção de órgãos e funções reprodutivas nos adultos, pois fornece oxigênio e nutrientes suficientes para os órgãos. Rede vascular adequada é bem estabelecido com processos complexos e multi-passo a angiogênese em que o pré-existentes da rede capilar é reorganizada com estruturas altamente ramificada e hierarquizada. Apesar de inúmeros trabalhos têm demonstrado que uma variedade de moléculas es...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecimentos
Agradecemos a K. Gill para a assistência com a criação do mouse e os cuidados e para a gestão de laboratório. Agradeço também aos membros Mukoyama laboratório para assistência técnica. O financiamento foi fornecido pelo Programa de Pesquisa Intramural dos Institutos de Saúde Naitonal.
Access restricted. Please log in or start a trial to view this content.
Materiais
Anticorpos
Pan-endotelial marcador de células
| Name | Company | Catalog Number | Comments | |
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| PECAM-1 | Hamster Armenian (M) | Chemicon | MAB1398Z | Diluição 1:100 # 1 |
| PECAM-1 | Rat (M) | BD | 553369 | 1:300 diluição |
| VEGFR2 | Rat (M) | eBioscience | 14-5821-82 | Diluição de 1:200 |
| CD34 | Rat (M) | eBioscience | 13-0341 | 1:300 diluição |
| Colágeno IV | Coelho (P) | AbD Serotec | 2150-1470 | 1:300 diluição # 2 |
Marcador de células endoteliais arteriais
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| Neuropilin1 | Coelho (P) | O laboratório Kolodkin Alex # 3 | 1:3000 diluição | |
| Unc5H2 | Bode (P) | R & D | AF1006 | Diluição de 1:200 |
Venosa marcador de células endoteliais
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| EphB4 | Bode (P) | R & D | AF446 | Diluição 1:100 |
Linfática marcador de células endoteliais
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| Lyve-1 # 4 | Coelho (P) | Abcam | ab14917 | Diluição de 1:200 |
| Lyve-1 # 4 | Rat (M) | MBL | D225-3 | Diluição de 1:200 |
| Prox-1 | Coelho (P) | Chemicon | AB5475 | 1:1000 diluição |
| Prox-1 | Bode (P) | R & D | AF2727 | 01:50 diluição |
| Neuropilin2 | Coelho (P) | Sinalização celular | 3366 | 1, 100 de diluição |
| Podoplanin | Hamster sírio (M) | Hibridoma Banco | 8.1.1 | Diluição de 1:200 |
Músculo liso marcador de células / pericyte
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| αSMA-Cy3 | Mouse (M) # 5 | Sigma | c-6198 | 1:500 diluição # 6 |
| NG2 | Coelho (P) | Chemicon | AB5320 | Diluição de 1:200 |
| SM22α | Coelho (P) | Abcam | ab14106 | Diluição de 1:200 |
Anticorpos para repórter GFP
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| GFP | Coelho (P) | Invitrogen | A11122 | 1:300 diluição |
| GFP | Rat (M) | Nacalai tesque | 04404-84 | 1:1000 diluição |
| GFP | Chick (P) | Chemicon | P42212 | 1:300 diluição |
Anticorpos para repórter LacZ
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| β-gal | Coelho (P) | MP Biomédica | 55976 | 1:5000 diluição |
| β-gal | Bode (P) | AbD Serotec | 4600-1409 | 1:500 diluição |
| β-gal | Chick (P) | Abcam | ab9361 | Diluição de 1:200 |
Anticorpos para axônio periférico
| Anticorpo | Espécies | Companhia | Catálogo # | Condição de trabalho |
| 2H3 | Mouse (M) # 7 | Hibridoma Banco | 2H3 | Diluição de 1:200 |
| Tuj1 | Mouse (M) # 8 | Covance | MMS-435P | 1:500 diluição |
| Periferina | Coelho (P) | Chemicon | AB1530 | 1:1000 diluição |
Anticorpos para as células de Schwann migrando
| BFABP | Coelho (P) | O laboratório de Thomas Müller # 9 | 1:3000 diluição |
(P): anticorpo policlonal, (M): anticorpo monoclonal
# 1: Goat anti-armênio hamster-Cy3 anticorpos (Jackson ImmunoResearch 127-165-160) deve ser usado como um anticorpo secundário.
# 2: O Colágeno IV anticorpos podem ser usados para detectar os vasos sanguíneos após a hibridização in situ.
# 3: O anticorpo Neuropilin1 é gentilmente cedidas pelo laboratório do Kolodkin Alex na Johns Hopkins University. Ovelhas anti-anticorpo humano Neuropilin1 está disponível em P & D (AF3870), embora não tenha testado ainda.
# 4: Os anticorpos lyve-1 também detectar um subconjunto de macrófagos na pele embrionárias.
# 5: O anticorpo anti-rato αSMA é anticorpo monoclonal IgG2a.
# 6: O Cy3-conjugados de anticorpos αSMA é incubada por 1 hora à temperatura ambiente, juntamente com secanticorpos secundária para outros anticorpos primários.
# 7: 2H3 anticorpo é rato anticorpo IgG1 monoclonal contra neurofilamento.
# 8: Tuj1 anticorpo é rato de anticorpos monoclonais contra IgG2a Neuron-specific classe III beta-tubulina.
# 9: O BFABP anticorpos (cérebro-específica de ácidos graxos binding protein) é gentilmente cedidas pelo laboratório do Thomas Müller em Max-Delbrück-Center de Medicina Molecular.
Referências
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados