JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
배아 림브 스킨 Vasculature에 대한 전체 마운트 Immunohistochemical 분석 : 엠브료에 혈관 분기 Morphogenesis를 공부하는 모델 시스템
요약
우리는 전체 마운트 immunohistochemistry를 소개하고 레이저 마우스 배아 사지 피부에 복잡한 혈관 네트워크 형성을 분석하는 데 여러 상표와 공촛점 현미경을 검사합니다.
초록
이미지에 대한 전체 마운트 immunohistochemical 분석은 전체 vasculature는 morphogenesis을 분기의 세포 메커니즘을 이해하는 데 필수적입니다. 우리는 기존의 원시 모세관 신경 얼기가 계층 브랜츠드 혈관 네트워크에 개편되는 혈관 개발을 연구하기 위해 사지 피부 vasculature 모델을 개발했습니다. 여러 개의 라벨과 함께 전체 - 마운트 공촛점 현미경 특정 형광 마커를 사용하여 내피 세포, pericytes 및 평활근 세포를 포함하여 그대로 혈관뿐만 아니라 자신의 세포 구성 요소의 강력한 이미징을 허용합니다. 유전자 연구와 함께 사지 피부 vasculature 모델의 발전은 혈관 개발 및 patterning의 분자 메커니즘을 이해하고 개선합니다. 사지 피부 vasculature 모델은 말초 신경이 동맥의 차별과 patterning을위한 공간 템플릿을 제공하는 방법을 연구하는 데 사용되었습니다. 이 동영상이 문서에서는 우리가 혈관 개발의 과정에 따라 수 있습니다 vascularized 배아 기관에 대한 적용 혈관 특정 항체 및 형광 항체 보조와 완전한 혈관을 얼룩이 간단하고 강력한 프로토콜을 설명합니다.
프로토콜
1. 수집 마우스 배아 림브 스킨 (E13.5 ~ E17.5)
- 안락사는 승인 절차에 의해 암컷을 연결. 우리의 승인된 동물 프로토콜에 따르면, 여자는 CO 2 노출에 의해 euthanized하고 다음 경추 전위에 의해 안심하시기 바랍니다. 의 흡수 종이 타월에 동물을 배치하고 스퀴즈 병에서 70% EtOH / H 2 O에서 철저하게 그것을 만끽해보세요.
- 자궁은 그대로 해부하다 피로를 씻어 차가운 행크스 '밸런스드 소금 솔루션 (HBSS)이있는 100 X 15mm 페트리 접시에 놓으십시오.
- 배아를 분리하고 해부하다. 배아에서 매우 얇은 양막을 제거합니다.
- 각각의 배아는 genotyped해야하는 경우 (옵션) 35 X 10mm 페트리 접시에서 단일 배아를 해부하다. 해부 꼬리는 genotyping의 0.2 ML PCR 튜브로 전송됩니다.
- 배아의 앞발로를 차단하고 전송 인산 버퍼 살린 (PBS)에 얼음처럼 차가운 신선한 4 % Paraformaldehyde (PFA) 2 ML을 포함한 24 잘 접시에 고리 집게로 앞발.
- 4 ° C 하룻밤에 Nutator 믹서에 부드러운 믹싱으로 앞발을 고정.
- 다음날, PFA를 제거하고 실온에서 Nutator 믹서에서 부드러운 혼합과 PBS 2 ML 5 분 세 번 씻으십시오.
- 100 % 메탄올 (MeOH)에 앞발을 전송하고 -20 ° C의 효소 냉동고 (임계 온도 제어와 자동 서리를 없애다 기능없이 냉동실)에 그들을 저장할 수 있습니다. 차 항체는 100 % MeOH 치료 후 표 1에 나열된 작업.
- 고급 핀셋을 사용하여 forelimb에서 출발 피부 껍질. 림브 피부, 탈수, 갈기갈기 쉽게 분리해야합니다. 우선 직면 복부 측면 (손바닥 쪽)와 다리를 놓으십시오. 동영상과 같이 다음 고급 핀셋을 사용하여 피부를 잘라. 다음 손상없이 부드럽게 피부를 벗겨내는, 전체를 사지 주변 해부하다.
2. 림브 스킨 전체 - 마운트 Immunohistochemical 스테 이닝
- MeOH / PBT (PBS + 0.2 % 트리톤 X - 100) (75 %, 50 %, 25 %) 5 분 각각의 등급 시리즈를 통해 잠복기에 의해 5ml 폴리 프로필렌 왕복 아래 튜브의 사지 스킨을 Rehydrate. 솔루션을 교환하면 사지 스킨 손상을 방지하기 위해주의를 기울여야합니다.
- 상온에서 Nutator 믹서에서 부드러운 혼합과 PBT에서 5 분 두 번 씻으십시오.
- Nutator 믹서에서 부드러운 혼합 2 시간 동안 당나귀 차 항체에 대한 10 %의 염소 차 항체에 대한 혈청 / PBS 0.2 % TX100 차단 버퍼 염소 또는 10% 돈키 혈청 / PBS 0.2 % TX100 차단 버퍼에서 하나와 사지 스킨 블럭 상온.
- 차단 버퍼의 기본 항체의 800μl (테이블에 나열된 적절한 희석) (와 2ml - microcentrifuge 관에 고리 집게로 35 X 10mm 페트리 접시와 전송에 사지 스킨을 플레이스 중 10 % 염소 혈청 / PBS 0.2 % TX100 또는 10% 돈키 혈청 / PBS 0.2 % TX100). 4 ° C 하룻밤에 Nutator 믹서에 부드러운 믹싱으로 사지 스킨을 품어. 종 (예를 들어, 쥐의 단클론 항체 polyclonal 항체 + 토끼)에서 파생된 여러 기본 항체를 동시에 사용할 수 있습니다.
- 다음날, 세척 버퍼의 4ml (중 2 %의 염소 혈청 / PBS 0.2 % TX100 또는 2 왕복 하단 튜브 5ml 폴리 프로필렌으로 고리 집게로 35 X 10mm 페트리 접시와 전송에 사지 스킨을 장소 % 동키 혈청 / PBS 0.2 % TX100).
- 부드러운 실온에서 Nutator 믹서에서 혼합과 함께 15 분 다섯 번 씻으십시오.
- 차단 버퍼 이차 항체의 800μl (중 10 % 염소 혈청 / PBS 0.2 % TX100하거나 10% 돈키 혈청 /를 함께 2ml - microcentrifuge 관에 고리 집게로 35 X 10mm 페트리 접시와 전송에 사지 스킨을 플레이스 PBS 0.2 % TX100). 일반적으로 우리는 잭슨 ImmunoResearch (Cy3, Cy5, 1:300 dilutions) 또는 Invitrogen (알렉사 플루어 488, 알렉사 플루어 568, 알렉사 플루어 633, 1:250 희석)에서 보조 항체를 사용합니다. 보조 항체의 집계 입자를 제거하는 0.22μm PVDF 막 주사기 필터를 사용하여 보조 항체 솔루션을 필터링합니다. 상온에서 Nutator 믹서에서 부드러운 혼합 1 시간 동안 어둠이나 알루미늄 호일로 싼에서 사지 스킨을 품어. 종에서 파생된 다른 형광 복합 이차 항체를 동시에 사용할 수 있습니다.
- 세척 버퍼의 4ml (2 % 염소 혈청 / PBS 0.2 % 중 TX100 또는 2% 돈키 혈청 / PBS로 5ml 폴리 프로필렌 왕복 하단 튜브에 고리 집게로 35 X 10mm 페트리 접시와 전송에 사지 스킨을 플레이스 0.2 % TX100). 어둠이나 부드러운 실온에서 Nutator 믹서에서 혼합과 알루미늄 호일로 싸서 15 분 다섯 번 씻으십시오.
- (핵에 대한 counterstaining에 대한 옵션)는 세척 버퍼의 4ml (중 2 %의 염소 혈청 / PBS 0.2 % TX100 또는 2% 돈키 혈청 / PBS 0.2 % TX100)에 - PRO - 3 (Invitrogen T3605과 함께 사지 스킨을 품어 , 어둠 또는 객실 temperatu에서 Nutator 믹서에서 부드러운 혼합 10 분 알루미늄 호일로 싼에서 1:3000 희석)다시. 그런 다음에 부드러운 혼합과 알루미늄 호일로 어둡거나 포장의 세척 버퍼의 4ml (2 % 염소 혈청 / PBS 0.2 % TX100 또는 2% 돈키 혈청 / PBS 0.2 % TX100을)를 5 분 세 번 씻어 상온에서 Nutator 믹서. 핵에 대한 강력하고 구체적인 얼룩이 특정 방출 (HeNe 633 나노미터 여기)에서하려면 - PRO - 3에 대한 관찰됩니다.
3. 슬라이드에 림브 스킨 장착
- 35 X 10mm 페트리 접시에 사지 스킨을 놓습니다. 표백 광범위한 사진을 피하기 위해 낮은 조명과 stereomicroscope 이하 벌금 핀셋을 사용하여 스킨의 내부 계층에서 먼지, 크리스탈, 섬유를 제거합니다.
- 고리 집게에 의해 접착제 현미경 슬라이드 사지 스킨을 전송합니다. 슬라이드 (coverslip으로 IE)에서 위쪽으로 누워 내부 레이어로 피부를 놓습니다. 신중하게 잘 핀셋을 사용하여 스킨을 평평하게하고 Kimwipe하여 버퍼를 세척 - 이월 제거하십시오.
- 기포없이 안티 - 페이드 장착 매체 마운트합니다. 우리는 25 "x25"coverslip을 사용합니다. 어둠의 평평한 표면에 치료 (예 : 샘플보기 전에 실온에서 어둠 속에서 야간 배치 골드 시약을 연장 사용하여 마운트). 장기 저장을 위해, 4 슬라이드에 coverslip하고 저장을 날인 ° C.
4. 공촛점 현미경
- fluorophores에 적합한 레이저를 설정합니다. 우리는 아르곤 488nm (알렉사 플루어 488와 GFP)을, DPSS 561nm (알렉사 플루어 568와 Cy3) 및 HeNe 633nm (알렉사 플루어 633, Cy5 및 - PRO - 3)을 포함하여 세 레이저 소스 Leica TCS SP5 공촛점 현미경을 사용하여 .
- 더블 또는 트리플 묻은 샘플의 모든 염료가 동시에 흥분됩니다되는 누화를 방지하거나 줄이기 위해 순차적 스캔 도구를 사용하십시오. 순차 스캔 모드에서는, 이미지가 순차적으로 기록됩니다.
- 여기에 대한 형광 염료와 레이저에 대한 더 일반적인 정보는 힙스 (2004)에 의해 "생물학에 대한 공촛점 현미경"의 설립 수 있습니다
5. 대표 결과
팬 - 내피 세포 마커에 항체와 E15.5에서 마우스 forelimb의 피부에 전체 마운트 트리플 라벨 공촛점 immnofluorescence 현미경 PECAM - 1 (그림 1A - C, D 블루), neurofilament 마커 2H3 (그림 1A 녹색), 그리고 평활근 세포 마커 αSMA (그림 1A, B 적색)는 사지 피부에 2H3 + 주변 신경에 부합 αSMA + 동맥의 특성 분기 패턴을 공개했다. 분기 혈관뿐만 아니라,이 사지 피부 vasculature 모델은 림프 내피 세포 마커 LYVE - 1 (그림 1D, E 적색)와 Neuropilin2 (NRP2) (그림 1D, F 녹색으로 항체를 사용하여 분기 림프 혈관의 patterning을 연구하는 데 사용됩니다 ).
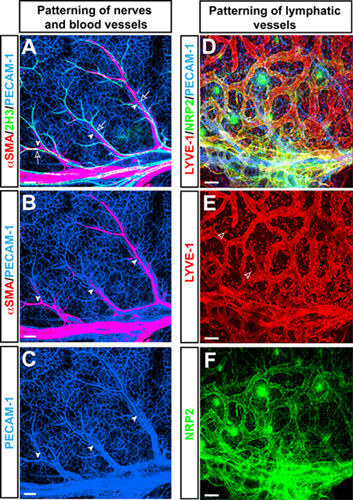
그림 1. (AC) 동맥은 태아의 사지 피부에 말초 신경로 맞춥니다. 팬 - 내피 세포 마커 PECAM - 1 (AC, 파랑), neurofilament 마커 2H3 (A, 녹색), 그리고 평활근 세포 마커 αSMA (A와 B, 빨간색으로 항체와 함께 전체 마운트 트리플 라벨 공촛점 immnofluorescence 현미경 )이 표시됩니다. E15.5, 2H3 +에서 말초 신경 (오픈 화살표) αSMA에 의해 덮여 동맥 (화살촉) + 평활근 세포와 연결합니다. 배아 사지 피부에 (DF) 림프 vasculature. 팬 - 내피 세포 마커에 항체 PECAM - 1 (D, 파랑), 림프 내피 세포 마커 LYVE - 1 (D와 E, 빨간색)와 Neuropilin2 (NRP2) (D와 F, 녹색과 함께 트리플 라벨 공촛점 immnofluorescence 현미경 )이 표시됩니다. LYVE - 1도 macrophages (오픈 화살촉)의 하위 집합에 의해 표현된다 반면에 림프 혈관은 LYVE - 1 NRP2 모두에 의해 시각입니다. 스케일 바 : 100μm.
토론
그것이 충분한 산소와 장기에 영양분을 공급하기 때문에 혈관 시스템은 embryogenesis 동안뿐만 아니라 성인의 장기 유지 보수 및 생식 기능에 대한 장기 개발을 위해 매우 중요합니다. 적절한 혈관 네트워크는 기존의 모세관이 높은 분기와 계층 구조를 개편하고있는 angiogenesis에 의해 복잡하고 여러 단계의 프로세스를 잘 설정됩니다. 다수의 작품이 분자의 다양한 이러한 과정에 관여하는 것으로 나...
공개
감사의 말
우리는 마우스 사육 및 관리와 지원 및 실험실 관리 K. 길 주셔서 감사합니다. 또한 기술적인 도움을 무코 야마 연구실 회원에게 감사드립니다. 자금은 보건 Naitonal 연구소의 교내 연구 프로그램에 의해 제공되었다.
자료
항체
판 - 내피 세포 마커
| Name | Company | Catalog Number | Comments | |
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| PECAM - 1 | 아르메니아어 햄스터 (M) | Chemicon | MAB1398Z | 1:100 희석 # 1 |
| PECAM - 1 | 랫 (M) | BD | 553369 | 1:300 희석 |
| VEGFR2 | 랫 (M) | eBioscience | 14-5821-82 | 1:200 희석 |
| CD34 | 랫 (M) | eBioscience | 13-0341 | 1:300 희석 |
| 콜라겐 IV | 래빗 (P) | AbD Serotec | 2150년부터 1470년까지 | 1:300 희석 # 2 |
아티 내피 세포 마커
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| Neuropilin1 | 래빗 (P) | 알렉스 Kolodkin의 실험실 # 3 | 1:3000 희석 | |
| Unc5H2 | 염소 (P) | R & D | AF1006 | 1:200 희석 |
정맥 내피 세포 마커
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| EphB4 | 염소 (P) | R & D | AF446 | 1:100 희석 |
림프 내피 세포 마커
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| LYVE - 1 # 4 | 래빗 (P) | Abcam | ab14917 | 1:200 희석 |
| LYVE - 1 # 4 | 랫 (M) | MBL | D225 - 3 | 1:200 희석 |
| Prox - 1 | 래빗 (P) | Chemicon | AB5475 | 1:1000 희석 |
| Prox - 1 | 염소 (P) | R & D | AF2727 | 1시 50분 희석 |
| Neuropilin2 | 래빗 (P) | 세포 신호 | 3366 | 1, 100 희석 |
| Podoplanin | 시리아 햄스터 (M) | 하이 브리 도마 뱅크 | 8.1.1 | 1:200 희석 |
평활근 세포 / pericyte 마커
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| αSMA - CY3 | 마우스 (M) # 5 | 시그마 | C - 6198 | 1:500 희석 # 6 |
| NG2 | 래빗 (P) | Chemicon | AB5320 | 1:200 희석 |
| SM22α | 래빗 (P) | Abcam | ab14106 | 1:200 희석 |
GFP 기자에 대한 항체
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| GFP | 래빗 (P) | Invitrogen | A11122 | 1:300 희석 |
| GFP | 랫 (M) | Nacalai tesque | 04404-84 | 1:1000 희석 |
| GFP | 칙 (P) | Chemicon | P42212 | 1:300 희석 |
LacZ 기자에 대한 항체
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| β - 여자 | 래빗 (P) | MP 바이오 메디컬 | 55,976 | 1:5000 희석 |
| β - 여자 | 염소 (P) | AbD Serotec | 4600-1409 | 1:500 희석 |
| β - 여자 | 칙 (P) | Abcam | ab9361 | 1:200 희석 |
주변 축삭에 대한 항체
| 항독소 | 종 | 회사 | 카탈로그 # | 근무 조건 |
| 2H3 | 마우스 (M) # 7 | 하이 브리 도마 뱅크 | 2H3 | 1:200 희석 |
| Tuj1 | 마우스 (M) # 8 | Covance | MMS - 435P | 1:500 희석 |
| Peripherin | 래빗 (P) | Chemicon | AB1530 | 1:1000 희석 |
마이 그 레이션 Schwann 세포에 대한 항체
| BFABP | 래빗 (P) | 토마스 뮐러의 실험실 # 9 | 1:3000 희석 |
(P) : polyclonal 항체 (M) : 단클론 항체
# 1 : 염소 방지 아르메니아어 햄스터 - Cy3 (잭슨 ImmunoResearch 127-165-160) 항체가 보조 항체로 사용해야합니다.
# 2 : 콜라겐 IV 항체가 원위치 하이브리드화 이후 혈관을 감지하는 데 사용할 수 있습니다.
# 3 : Neuropilin1 항체가 친절하게 존스 홉킨스 대학의 알렉스 Kolodkin의 실험실에 의해 제공됩니다. 우리는 아직 테스트하지 않았습니다 있지만, 양 안티 인간 Neuropilin1 항체는 R & D (AF3870)에서 사용할 수 있습니다.
# 4 : LYVE - 1 항체는 또한 배아 피부에 macrophages의 하위 집합을 감지합니다.
# 5 : 안티 αSMA 항체 마우스 IgG2a 단클론 항체이다.
# 6 : Cy3 - 복합 αSMA 항체는 초와 함께 실온에서 1 시간 incubated입니다다른 일차 항체에 대한 항체 ondary.
# 7 : 2H3 항체가 neurofilament에 대한 마우스 IgG1 단클론 항체이다.
# 8 : Tuj1 항체가 신경 세포 특정 클래스 III 베타 tubulin에 대한 마우스 IgG2a 단클론 항체이다.
# 9 : BFABP (두뇌 특정 지방산 결합 단백질) 항체가 친절 분자 의학에 대한 최대 - Delbrück - 센터의 토마스 뮐러의 실험실에 의해 제공됩니다.
참고문헌
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유