このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
胚肢の皮膚の血管系のためのホールマウント免疫組織化学的解析:胚における血管分岐形態形成を研究するモデルシステム
要約
我々はマウス胚の四肢の皮膚に複雑な血管網の形成を分析するために複数のラベルで共焦点顕微鏡を走査型ホールマウントの免疫組織化学とレーザーをご紹介。
要約
イメージングのためのホールマウント免疫組織化学分析は、全体の血管系は分岐形態形成の細胞メカニズムを理解するために極めて重要である。我々は、既存のプリミティブ毛細血管叢が階層的に分岐した血管網に再編成されている血管の発達を研究するために四肢の皮膚の血管系モデルを開発した。複数のラベルを持つホールマウント共焦点顕微鏡は、特定の蛍光マーカーを使用して、無傷の血管の堅牢な画像だけでなく、内皮細胞、周皮細胞および平滑筋細胞を含むそれらの細胞成分が可能になります。遺伝学的研究でこの四肢の皮膚の血管系モデルの進歩により、血管の開発とパターン形成の分子機構を理解改善している。四肢の皮膚の血管系のモデルは、末梢神経、動脈の分化とパターン形成のために空間的なテンプレートを提供する方法を研究するために使用されています。このビデオの記事では、我々は血管の開発のプロセスに従うことができる血管新生化胚の臓器に適用可能な血管特異的な抗体と蛍光二次抗体、で無傷の血管を染色するためのシンプルで堅牢なプロトコルを記述します。
プロトコル
1。マウス胚の四肢の皮膚の収集(E13.5〜E17.5)
- 安楽死は、承認された手順によって女性を差し込む。私達の承認された動物のプロトコルによると、女性はCO 2曝露により安楽死され、その後、頚椎脱臼により保証。その吸水性のペーパータオルに動物を置くと、スクイーズボトルから70%エタノール/ H 2 Oでそれを徹底的に浸します。
- 子宮はそのままに摘出し、血液を洗い流すために、氷冷ハンクス平衡塩溶液(HBSS)を含む100 × 15ミリメートルペトリ皿に入れてください。
- 胚を分離して分析する。胚から非常に薄い羊膜を取り外します。
- 各胚は遺伝子型をする必要がある場合(オプション)35 x 10 mmのシャーレに、単一の胚を摘出。解剖テールは、ジェノタイピングのために0.2ミリリットルのPCRチューブに移している。
- 胚の前肢を切断し、転送はリン酸緩衝生理食塩水(PBS)で氷冷新鮮な4%パラホルムアルデヒド(PFA)の2 mlを入れた24ウェルプレートにリングの鉗子によって前肢。
- 4℃で一晩Nutatorミキサーで穏やかに混合して前肢を固定してください。
- 翌日に、PFAを削除し、室温でNutatorミキサーで穏やかに混合したPBSを2 ml中で5分間3回洗浄する。
- 100%メタノール(MeOH)で前肢を移し、-20℃酵素の冷凍庫(臨界温度制御付きと自動霜取り機能のない冷凍庫)で保管してください。一次抗体は、100%メタノール処理後の表1の作業にリストされています。
- 細かいピンセットを使用して前肢から剥がれ皮膚。手足の皮膚は、乾燥、手足から容易に分離する必要があります。最初に上に向けて腹側(手のひら側)で手足を置く。ビデオに示されるようにし細かいピンセットを使って、皮膚をカット。次のいずれかのダメージを与えることなく穏やかに肌を剥離、全体の肢の周囲解剖。
2。リムのスキンのホールマウント免疫組織化学的染色
- 5分ごとのMeOH / PBT(PBS + 0.2%トリトンX - 100)(75%、50%、25%)の段階的な一連インキュベートすることにより、5ミリリットルポリプロピレン丸底チューブの手足の皮を水和。ソリューションを交換すると四肢の皮を損傷しないように気をつけなければならないことに注意してください。
- 室温でNutatorミキサーで穏やかに混合してPBTで5分間2回洗浄する。
- でNutatorミキサーで穏やかに混合して2時間ヤギ二次抗体またはロバ二次抗体を10%ロバ血清/ PBS 0.2パーセントTX100ブロッキング緩衝液を10%ヤギ血清/ PBS 0.2パーセントTX100ブロッキング緩衝液のいずれかと四肢のスキンをブロック室温。
- ブロッキングバッファーで一次抗体の800μl(表に記載されているように、適切な希釈)(と2ミリリットル-マイクロ遠心チューブにリングの鉗子で35 x 10 mmのペトリ皿および転送に関する手足の皮を置き、いずれかの10%ヤギ血清/ PBS 0.2 %TX100または10%ロバ血清/ PBS 0.2パーセントTX100)。 4℃で一晩Nutatorミキサーで穏やかに混合して四肢のスキンをインキュベートする。別の種(例えば、ラットモノクローナル抗体+ウサギポリクローナル抗体)から派生した複数の一次抗体を同時に使用することができることに注意してください。
- 次の日に、2%ヤギ血清/ PBS 0.2パーセントTX100または2のどちらかは、洗浄バッファー(の4ミリリットルで5ミリリットルポリプロピレン丸底チューブにリングの鉗子で35 x 10 mmのペトリ皿や転送に四肢のスキンを配置%ロバ血清/ PBS 0.2パーセントTX100)。
- 穏やかな室温でNutatorミキサーで混合しながら15分間5回洗浄する。
- ブロッキングバッファー中の二次抗体の800μl(どちらか10%ヤギ血清/ PBS 0.2パーセントTX100をまたは10%ロバ血清/を持つ2ミリリットル、マイクロ遠心チューブにリングの鉗子で35 x 10 mmのペトリ皿や転送に四肢のスキンを配置PBS 0.2パーセントTX100)。一般的に我々は、ジャクソンイムノ(Cy3標識、Cy5で、1:300希釈)またはInvitrogen社(のAlexa Fluor ® 488のAlexa Fluor 568、のAlexa Fluor 633、1:250希釈)から二次抗体を使用してください。二次抗体の凝集した粒子を除去するために0.22μmのPVDF膜シリンジフィルターを用いて二次抗体溶液をフィルタ。室温でNutatorミキサーで穏やかに混合して1時間暗いまたはアルミホイルで包んだの四肢のスキンをインキュベートする。異なる種に由来する異なる蛍光標識二次抗体を同時に使用することができることに注意してください。
- 洗浄バッファーの4ミリリットル(2%ヤギ血清/ PBS 0.2パーセントのどちらかTX100または2%ロバ血清/ PBSで5ミリリットルポリプロピレン丸底チューブにリングの鉗子で35 x 10 mmのペトリ皿や転送に四肢のスキンを配置0.2パーセントTX100)。暗いまたは穏やかな室温でNutatorミキサーで混合とアルミ箔で包んで15分間5回洗浄する。
- (核に対する対比のためのオプション)インビトロジェンT3605 TO - PRO - 3(洗浄バッファー(2%ヤギ血清/ PBS 0.2パーセントTX100または2%ロバ血清/ PBSのいずれか0.2パーセントTX100)の4ミリリットルと四肢のスキンをインキュベート、暗いまたは部屋temperatuでNutatorミキサーで穏やかに混合しながら10分間アルミホイルで包んで1:3000希釈)再。その後、上ミキシング優しいと暗いまたはアルミホイルでラップされたの洗浄バッファー(2%ヤギ血清/ PBS 0.2パーセントTX100または2%ロバ血清/ PBSのいずれか0.2パーセントTX100)の4ミリリットルで5分間3回洗浄室温でNutatorミキサー。原子核の強いと特異的染色が特定の排出(HeNeレーザ633nmの励起)でTO - PRO - 3で観察されていることに注意してください。
3。スライド上のリムのスキンの取り付け
- 35 x 10 mmのシャーレの上で手足の皮を置きます。粉塵、結晶、漂白豊富な写真を避けるために、低照度で実体顕微鏡下で微細なピンセットを使用してスキンの内側の層から繊維を取り除く。
- リングの鉗子によって接着剤顕微鏡スライドに手足の皮を転送します。スライド(カバーガラスに向かってすなわち)に上向きに横たわって内層でのスキンを置きます。慎重に細かいピンセットを使ってスキンを平らにし、キムワイプで洗浄バッファーキャリーオーバーを削除します。
- 気泡なしでアンチフェードマウントメディアにマウントします。我々は、25"X25"カバースリップを使用してください。暗闇の中で平らな場所に置き、乾燥(例えば、サンプルが表示する前に、室温で暗所で一晩置かれているゴールド試薬を延長使用してマウント)。長期保存のために、4でスライドして格納するためにカバースリップをシール℃に
4。共焦点顕微鏡
- 蛍光体の適切なレーザーを設定します。我々は、アルゴン488nmの(のAlexa Fluor ® 488およびGFPの場合)、DPSS 561nm(のAlexa Fluor 568およびCy3用)とヘリウムネオン633nm(のAlexa Fluor 633、Cy5標識およびTO - PRO - 3)を含む3つのレーザー源とライカTCS SP5共焦点顕微鏡を使用してください。
- ダブルまたはトリプル染色サンプルのすべての色素を同時に励起されるのクロストークを軽減または回避するシーケンシャルスキャンツールを使用してください。シーケンシャルスキャンモードでは、画像を順番に記録されます。
- 励起用の蛍光色素とレーザーに関する一般的な情報はヒブズによる"生物学者のための共焦点顕微鏡"(2004)年に設立されることがあります
5。代表的な結果
汎血管内皮細胞のマーカーに対する抗体とE15.5のマウス前肢の皮膚のホールマウントトリプルラベル共焦点immnofluorescence顕微鏡PECAM - 1(図1A - C、Dブルー)、ニューロフィラメントマーカー2H3(図1A緑)、および平滑筋細胞マーカーαSMA(図1A、B、赤)は、四肢の皮膚に2H3 +末梢神経に沿ったαSMA+動脈、の特徴的な分岐パターンを明らかにした。分岐血管に加えて、この四肢の皮膚の血管系のモデルは、リンパ管内皮細胞マーカーLYVE - 1(図1D、E赤)とNeuropilin2(NRP2)(図1D、F緑に対する抗体を用いて分岐リンパ管のパターニングを研究するために使用され)。
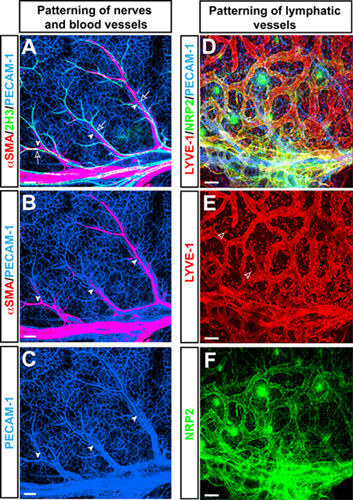
図1(AC)動脈は、胚肢の皮膚の末梢神経に合わせます。汎血管内皮細胞マーカーPECAM - 1(AC、青)に対する抗体とホールマウントトリプルラベル共焦点immnofluorescence顕微鏡、ニューロフィラメントマーカー2H3(A、緑)、および平滑筋細胞マーカーαSMA(AとB、赤)が表示されます。 E15.5、2H3で+末梢神経(オープン矢印は)αSMAでカバーされている動脈(矢頭)+平滑筋細胞に関連付ける。胚肢の皮膚の(DF)リンパ脈管。汎血管内皮細胞のマーカーに対する抗体PECAM - 1(D、青)、リンパ管内皮細胞マーカーLYVE - 1(DとE、赤)とNeuropilin2(NRP2)(DとF、緑とトリプルラベル共焦点immnofluorescence顕微鏡)が表示されます。 LYVE - 1はまた、マクロファージ(オープン矢頭)の部分集合で表されるのに対し、リンパ管は、LYVE - 1とNRP2両方により可視化。スケールバー:100μmの。
ディスカッション
それが臓器に十分な酸素と栄養を供給するので、血管系は、胚形成の間だけでなく、臓器のメンテナンスと成人の生殖機能のための器官の開発にとって極めて重要である。適切な血管網は、既存の毛細血管網が高度に分岐したと階層構造で編成されている血管新生により、複雑で多段階のプロセスで十分に確立されている。数々の作品は様々な分子がこれらのプロセスに関与しているこ?...
開示事項
謝辞
我々はマウスの繁殖と介護の支援のために、実験室の管理のためのK.ギルに感謝。また、技術的なヘルプのための向山研究室のメンバーに感謝します。資金は、保健のNaitonal研究所の学内研究プログラムによって提供されていました。
資料
抗体
汎血管内皮細胞のマーカー
| Name | Company | Catalog Number | Comments | |
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| PECAM - 1 | アルメニアハムスター(M) | ケミコン | MAB1398Z | 1:100希釈#1 |
| PECAM - 1 | ラット(M) | BD | 553369 | 1:300希釈 |
| VEGFR2 | ラット(M) | ベイバイオサイエンス | 14-5821-82 | 1:200希釈 |
| CD34 | ラット(M) | ベイバイオサイエンス | 13から0341 | 1:300希釈 |
| コラーゲンIV | ウサギ(P) | ABD Serotec | 2150-1470 | 1:300希釈#2 |
動脈内皮細胞のマーカー
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| Neuropilin1 | ウサギ(P) | アレックスKolodkinのラボ第3位 | 1:3000希釈 | |
| Unc5H2 | ヤギ(P) | R&D | AF1006 | 1:200希釈 |
静脈内皮細胞のマーカー
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| EphB4 | ヤギ(P) | R&D | AF446 | 1:100希釈 |
リンパ管内皮細胞マーカー
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| LYVE - 1#4 | ウサギ(P) | アブカム | ab14917 | 1:200希釈 |
| LYVE - 1#4 | ラット(M) | MBL | D225 - 3 | 1:200希釈 |
| PROX - 1 | ウサギ(P) | ケミコン | AB5475 | 1:1000希釈 |
| PROX - 1 | ヤギ(P) | R&D | AF2727 | 1:50希釈 |
| Neuropilin2 | ウサギ(P) | 細胞シグナリング | 3366 | 1、100希釈 |
| ポドプラニン | シリアンハムスター(M) | ハイブリドーマバンク | 8.1.1 | 1:200希釈 |
平滑筋細胞/周皮細胞マーカー
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| αSMA- CY3 | マウス(M)#5 | シグマ | C - 6198 | 1:500希釈#6 |
| NG2 | ウサギ(P) | ケミコン | AB5320 | 1:200希釈 |
| SM22α | ウサギ(P) | アブカム | ab14106 | 1:200希釈 |
GFPレポーターのための抗体
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| GFP | ウサギ(P) | インビトロジェン | A11122 | 1:300希釈 |
| GFP | ラット(M) | ナカライテスク | 04404〜84 | 1:1000希釈 |
| GFP | チック(P) | ケミコン | P42212 | 1:300希釈 |
LacZレポーターのための抗体
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| β- galを | ウサギ(P) | MPバイオメディカル | 55976 | 1:5000希釈 |
| β- galを | ヤギ(P) | ABD Serotec | 4600-1409 | 1:500希釈 |
| β- galを | チック(P) | アブカム | ab9361 | 1:200希釈 |
末梢軸索のための抗体
| 抗体 | 種 | 会社 | カタログ# | 労働条件 |
| 2H3 | マウス(M)#7 | ハイブリドーマバンク | 2H3 | 1:200希釈 |
| Tuj1 | マウス(M)#8 | Covance | MMS - 435P | 1:500希釈 |
| ペリフェリン | ウサギ(P) | ケミコン | AB1530 | 1:1000希釈 |
シュワン細胞を移行するための抗体
| BFABP | ウサギ(P) | トーマスミュラーの研究室第9位 | 1:3000希釈 |
(P):ポリクローナル抗体、(M):モノクローナル抗体
第1位:ヤギ抗アルメニアハムスター- Cy3の(ジャクソンイムノ127-165-160)抗体を二次抗体として使用する必要があります。
第2位:コラーゲンIV抗体は、in situハイブリダイゼーションの後に血管を検出するために使用することができます。
#3:Neuropilin1の抗体は、親切にジョンズホプキンス大学のアレックスKolodkinの研究室によって提供されます。我々はまだそれをテストしていないもののヒツジ抗ヒトNeuropilin1の抗体は、R&D(AF3870)で利用可能です。
#4:LYVE - 1抗体はまた、胚性皮膚におけるマクロファージのサブセットを検出する。
#5:抗αSMA抗体マウスIgG2aモノクローナル抗体です。
#6:Cy3結合αSMAの抗体は、秒と一緒に室温で1時間インキュベートする他の一次抗体のための二次抗体。
#7:2H3抗体神経フィラメントに対するマウスIgG1モノクローナル抗体です。
#8:Tuj1抗体はニューロン固有のクラスIIIβ-チューブリンに対するマウスIgG2aモノクローナル抗体である。
#9:BFABP(脳特異的脂肪酸結合タンパク質)抗体は、親切に分子医学のマックスデルブリュック - センターのトーマスミュラーの研究室によって提供されます。
参考文献
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved