Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Whole-Mont analyse immunohistochimique à la vascularisation cutanée Limb embryonnaires: un modèle pour l'étude vasculaire morphogenèse de branchement de l'embryon
Dans cet article
Résumé
Nous introduisons une immunohistochimie toute monture et laser microscopie confocale à balayage avec un étiquetage multiple pour analyser la formation de complexes réseau vasculaire dans la peau de souris membres de l'embryon.
Résumé
Whole-Mont analyse immunohistochimique pour l'imagerie du système vasculaire entier est essentielle pour la compréhension des mécanismes cellulaires de ramification morphogenèse. Nous avons développé le modèle de la vascularisation des membres de peau pour étudier le développement vasculaire dans lequel un pré-existante primitive plexus capillaire est réorganisée dans un réseau hiérarchiquement ramifiée vasculaire. Whole-Mont microscopie confocale avec étiquetage multiple permet pour l'imagerie des vaisseaux sanguins robustes intactes ainsi que leurs composants cellulaires dont les cellules endothéliales, péricytes et cellules musculaires lisses, en utilisant des marqueurs fluorescents spécifiques. Les progrès dans ce modèle la vascularisation des membres peau avec des études génétiques ont permis d'améliorer la compréhension des mécanismes moléculaires du développement vasculaire et les motifs. Le modèle vascularisation des membres peau a été utilisée pour étudier comment les nerfs périphériques fournissent un modèle spatial pour la différenciation et la structuration des artères. Cet article décrit un protocole vidéo simple et robuste pour colorer les vaisseaux sanguins intacts avec des anticorps spécifiques et vasculaires anticorps secondaires fluorescents, qui est applicable pour les organes embryonnaires vascularisées où nous sommes en mesure de suivre le processus du développement vasculaire.
Protocole
1. Collecte peau Limb embryonnaires de souris (E13.5 E17.5 ~)
- Euthanasier branchée femelles par une procédure approuvée. Selon notre protocole animales approuvées, les femelles sont euthanasiés par le CO 2 d'exposition et ensuite assurée par dislocation cervicale. Lay l'animal sur son papier absorbant et les tremper complètement dans 70% EtOH / H 2 O à partir d'un flacon souple.
- Disséquer l'utérus intact et le placer dans un plat de 100 x 15 mm de Petri contenant une solution glacée Hanks Balanced Salt (HBSS) pour laver le sang.
- Séparée et disséquer l'embryon. Retirez l'amnios très mince de l'embryon.
- (Option) Disséquer un seul embryon dans un plat de 35 x 10 mm de Petri, si chaque embryon doit être génotypés. La queue est disséqué transféré dans un tube de 0,2 ml par PCR pour le génotypage.
- Coupez les pattes avant de l'embryon et le transfert des membres antérieurs par une pince à anneau en 24 plaques à puits contenant 2 ml de glace froide paraformaldéhyde à 4% frais (PFA) dans un tampon phosphate salin (PBS).
- Fixer les pattes avant avec mélange en douceur sur la table de mixage Nutator à 4 ° C pendant la nuit.
- Le lendemain, retirer la PFA et laver trois fois pendant 5 min dans 2 ml de PBS avec mélange en douceur sur la table de mixage Nutator à température ambiante.
- Transférer les pattes avant dans le méthanol à 100% (MeOH) et les stocker à -20 ° C l'enzyme congélateur (le congélateur avec contrôle de température critique et sans fonction de dégivrage automatique). Les anticorps primaires énumérées dans le tableau 1 du travail après le traitement MeOH 100%.
- Peler la peau hors de la patte avant en utilisant une pince à épiler fine. La peau du membre, quand déshydraté, devrait se séparent facilement de la branche. Placez d'abord le membre avec la face ventrale (côté paume) vers le haut. Ensuite, en utilisant une pince à épiler fine, couper la peau comme le montre la vidéo. Suivant disséquer autour du membre entier, desquamation de la peau en douceur hors sans aucun dommage.
2. Whole-Mont coloration immunohistochimique de Skins Limb
- Réhydrater les peaux jambe en polypropylène à fond rond tube de 5ml en incubant à travers la série graduée de MeOH / PBT (PBS + 0,2% Triton X-100) (75%, 50%, 25%) pendant 5 min chacune. Notez que l'échange de solutions doit être prudent pour éviter d'endommager les peaux membre.
- Laver deux fois pendant 5 min dans PBT avec mélange en douceur sur la table de mixage Nutator à température ambiante.
- Bloquer les peaux de chèvre soit membre avec 10% de sérum / PBS 0,2% TX100 tampon de blocage des anticorps secondaire de chèvre ou de 10% de sérum d'âne / PBS 0,2% TX100 tampon de blocage pour les anticorps secondaires âne pendant 2 heures en mélangeant doucement sur la table de mixage au Nutator la température ambiante.
- Placez les peaux des membres sur un plat de 35 x 10 mm de Pétri et le transfert par une pince à anneau dans 2ml-microcentrifugeuse tube avec 800μl d'anticorps primaire (dilution appropriée comme indiqué dans les tableaux) dans le tampon de blocage (soit 10% de sérum de chèvre / PBS 0,2 TX100% ou 10% de sérum d'âne / PBS 0,2% TX100). Incuber les peaux membre avec mélange en douceur sur la table de mixage Nutator à 4 ° C pendant la nuit. Notez que plusieurs anticorps primaires provenant d'espèces différentes (par exemple, anticorps monoclonal de rat + anticorps polyclonal de lapin) peuvent être utilisés simultanément.
- Le lendemain, place les peaux des membres sur un plat de 35 x 10 mm et le transfert de Petri par une pince à anneau en polypropylène de 5 ml à fond rond tube avec 4 ml de tampon de lavage (soit 2% de sérum de chèvre / PBS 0,2% ou 2 TX100 % âne sérum / PBS 0,2% TX100).
- Lavez cinq fois pendant 15 min en mélangeant doucement sur la table de mixage Nutator à température ambiante.
- Placez les peaux des membres sur un plat de 35 x 10 mm de Pétri et le transfert par une pince à anneau dans 2ml-microcentrifugeuse tube avec 800μl d'anticorps secondaire dans le tampon de blocage (soit 10% de sérum de chèvre / PBS 0,2% ou 10% TX100 âne sérum / PBS 0,2% TX100). Typiquement, nous utilisons des anticorps secondaires de Jackson ImmunoResearch (Cy3, Cy5, 1:300 dilutions) ou Invitrogen (Alexa Fluor 488, Alexa Fluor 568, Alexa Fluor 633, 1:250 dilution). Filtrer la solution d'anticorps secondaire en utilisant les filtres 0.22μm PVDF seringue membrane pour éliminer les particules agrégées de l'anticorps secondaire. Incuber les peaux des membres dans l'obscurité ou enveloppés de papier d'aluminium pendant 1 heure avec mélange en douceur sur la table de mixage Nutator à température ambiante. Notez que différents anticorps secondaires conjugués fluorescents provenant d'espèces différentes peuvent être utilisées simultanément.
- Placez les peaux des membres sur un plat de 35 x 10 mm de Pétri et le transfert par une pince à anneau en polypropylène à fond rond tube de 5ml avec 4ml de tampon de lavage (soit 2% de sérum de chèvre / PBS 0,2% ou 2% TX100 âne sérum / PBS 0,2% TX100). Lavez cinq fois pendant 15 min dans le noir ou enveloppés de papier d'aluminium en mélangeant doucement sur la table de mixage Nutator à température ambiante.
- (Option pour une contre-coloration contre le noyau) Incuber les peaux membre avec 4ml de tampon de lavage (soit 2% de sérum de chèvre / PBS 0,2% ou 2% TX100 âne sérum / PBS 0,2% TX100) avec A-Pro-3 (Invitrogen T3605 , 1:3000 dilution) dans le noir ou enveloppés de papier d'aluminium pendant 10 min en mélangeant doucement sur la table de mixage à la salle Nutator temre. Ensuite, laver trois fois pendant 5 min avec 4ml de tampon de lavage (soit 2% de sérum de chèvre / PBS 0,2% ou 2% TX100 âne sérum / PBS 0,2% TX100) dans l'obscurité ou enveloppés par des feuilles d'aluminium en mélangeant doucement sur le le mélangeur Nutator à température ambiante. Notez que la coloration forte et spécifique pour les noyaux est observé pour TO-PRO-3 dans une émission spécifique (excitation HeNe nm 633).
3. Montage du Skins Limb à la diapositive
- Placez les peaux des membres sur un plat de 35 x 10 mm de Pétri. Retirez les poussières, cristaux, fibres de la couche interne de la peau en utilisant une pince à épiler amende en vertu du stéréomicroscope avec éclairage basse pour éviter la photo blanchissement.
- Transférer les peaux branche à lame de microscope par un adhésif pinces. Placez les peaux avec la couche interne couché à la hausse sur la diapositive (c'est à dire vers la lamelle). Aplatir les peaux attentivement l'aide de pinces fines et retirer le report du tampon de lavage par Kimwipe.
- Monter dans les médias anti-fade montage sans bulles d'air. Nous utilisons 25 "x25" lamelle. Cure sur une surface plane dans l'obscurité (par exemple, les échantillons montés à l'aide de réactifs Prolongez l'or sont placés la nuit dans l'obscurité à température ambiante avant de visualisation). Pour stockage à long terme, sceller la lamelle sur la lame et stocker à 4 ° C.
4. Microscopie confocale
- Mettre en place des lasers appropriés pour les fluorophores. Nous utilisons Leica TCS SP5 microscope confocal avec trois sources laser Argon dont 488nm (pour Alexa Fluor 488 et GFP), DPSS 561nm (pour Alexa Fluor 568 et Cy3) et HeNe 633nm (pour Alexa Fluor 633, Cy5 et A-Pro-3) .
- Utilisez l'outil de scan séquentiel pour éviter ou réduire la diaphonie dans lequel tous les colorants dans les échantillons de double ou triple-tachés seront excités au même moment. Dans le mode de scan séquentiel, les images seront enregistrées dans un ordre séquentiel.
- Des informations plus générales sur les colorants fluorescents et des lasers pour l'excitation peut être créée en «microscopie confocale pour les biologistes» par Hibbs (2004)
5. Les résultats représentatifs
Whole montage de microscopie confocale triple label immnofluorescence chez la souris forelimb peau à E15.5 avec des anticorps pour le marqueur de cellules endothéliales pan-PECAM-1 (figure 1A-C, D bleu), le marqueur de neurofilaments 2H3 (figure 1A vert), et le bon marqueur de cellules musculaires αSMA (figure 1A, B rouge) a révélé un aspect caractéristique de branchement des artères + αSMA, aligné avec 2H3 + nerfs périphériques dans la peau des membres. En plus de ramifications des vaisseaux sanguins, ce modèle vascularisation des membres peau est utilisée pour étudier la structuration des vaisseaux lymphatiques de branchement en utilisant des anticorps dirigés contre le marqueur de cellules endothéliales lymphatiques LYVE-1 (figure 1D, E rouge) et Neuropilin2 (NRP2) (figure 1D, F verte ).
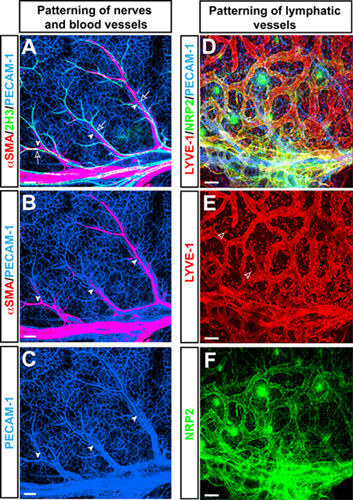
Figure 1. (Ca) Artères aligner avec les nerfs périphériques dans la peau membres de l'embryon. Whole montage triple label microscopie confocale immnofluorescence avec des anticorps pour le marqueur de cellules endothéliales pan-PECAM-1 (AC, bleu), le marqueur de neurofilaments 2H3 (A, vert), et la douceur des cellules musculaires marqueurs αSMA (A et B, rouge ) est montré. À E15.5, 2H3 + nerfs périphériques (flèches ouvertes) associer à des artères (flèches) qui sont couverts par αSMA + cellules musculaires lisses. Vascularisation lymphatique (DF) dans la peau membres de l'embryon. Triple-label microscopie confocale immnofluorescence avec des anticorps pour le marqueur de cellules endothéliales pan-PECAM-1 (D, bleu), le marqueur de cellules endothéliales lymphatiques LYVE-1 (D et E, rouge) et Neuropilin2 (NRP2) (D et F, vert ) est montré. Les vaisseaux lymphatiques sont visualisés par les deux LYVE-1 et NRP2, alors LYVE-1 est également exprimée par un sous-ensemble des macrophages (flèches ouvertes). Barre d'échelle: 100 microns.
Access restricted. Please log in or start a trial to view this content.
Discussion
Le système vasculaire est crucial pour le développement des organes pendant l'embryogenèse ainsi que pour l'entretien des organes et des fonctions de reproduction chez les adultes, car il fournit suffisamment d'oxygène et de nutriments aux organes. Une bonne réseau vasculaire est bien établie avec des processus complexes et multi-étapes par l'angiogenèse dans lequel pré-existante du réseau capillaire est réorganisée avec des structures très ramifiées et hiérarchique. Bien que de nombreux t...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Remerciements
Nous remercions K. Gill de l'aide pour l'élevage de souris et de soins et de gestion de laboratoire. Merci également à Mukoyama membres du laboratoire de l'aide technique. Le financement a été fourni par le Programme de recherche intra-muros des Instituts Naitonal de la Santé.
Access restricted. Please log in or start a trial to view this content.
matériels
Anticorps
Marqueur des cellules endothéliales pan-
| Name | Company | Catalog Number | Comments | |
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| PECAM-1 | Hamster arménien (M) | Chemicon | MAB1398Z | Dilution 1:100 # 1 |
| PECAM-1 | Rat (M) | BD | 553369 | 1:300 dilution |
| VEGFR2 | Rat (M) | eBioscience | 14-5821-82 | 1:200 dilution |
| CD34 | Rat (M) | eBioscience | 13-0341 | 1:300 dilution |
| Le collagène IV | Lapin (P) | AbD Serotec | 2150-1470 | 1:300 dilution # 2 |
Artérielle marqueur des cellules endothéliales
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| Neuropilin1 | Lapin (P) | Le Kolodkin Alex Lab # 3 | 1:3000 dilution | |
| Unc5H2 | Chèvre (P) | R & D | AF1006 | 1:200 dilution |
Marqueur de cellules endothéliales veineuses
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| EphB4 | Chèvre (P) | R & D | AF446 | Dilution 1:100 |
Marqueur des cellules endothéliales lymphatiques
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| LYVE-1 # 4 | Lapin (P) | Abcam | ab14917 | 1:200 dilution |
| LYVE-1 # 4 | Rat (M) | MBL | D225-3 | 1:200 dilution |
| Prox-1 | Lapin (P) | Chemicon | AB5475 | Dilution de 1:1000 |
| Prox-1 | Chèvre (P) | R & D | AF2727 | Dilution 1:50 |
| Neuropilin2 | Lapin (P) | Signalisation cellulaire | 3366 | 1, 100 de dilution |
| Podoplanin | Hamster syrien (M) | Hybridomes Bank | 8.1.1 | 1:200 dilution |
Lisse des cellules musculaires / péricytes marqueur
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| αSMA-Cy3 | Souris (M) # 5 | Sigma | c-6198 | 1:500 dilution # 6 |
| NG2 | Lapin (P) | Chemicon | AB5320 | 1:200 dilution |
| SM22α | Lapin (P) | Abcam | ab14106 | 1:200 dilution |
Anticorps pour rapporteur GFP
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| GFP | Lapin (P) | Invitrogen | A11122 | 1:300 dilution |
| GFP | Rat (M) | Nacalai Tesque | 04404-84 | Dilution de 1:1000 |
| GFP | Chick (P) | Chemicon | P42212 | 1:300 dilution |
Anticorps pour rapporteur LacZ
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| β-gal | Lapin (P) | MP Biomédical | 55976 | 1:5000 dilution |
| β-gal | Chèvre (P) | AbD Serotec | 4600-1409 | 1:500 dilution |
| β-gal | Chick (P) | Abcam | ab9361 | 1:200 dilution |
Anticorps pour axone périphériques
| Anticorps | Espèces | Société | Catalogue # | Conditions de travail |
| 2H3 | Souris (M) # 7 | Hybridomes Bank | 2H3 | 1:200 dilution |
| Tuj1 | Souris (M) # 8 | Covance | MMS-435P | 1:500 dilution |
| Périphérine | Lapin (P) | Chemicon | AB1530 | Dilution de 1:1000 |
Anticorps pour la migration des cellules de Schwann
| BFABP | Lapin (P) | Le laboratoire de Thomas Müller # 9 | 1:3000 dilution |
(P): anticorps polyclonal, (M): anticorps monoclonal
# 1: chèvre anti-arménienne de hamster-Cy3 (Jackson ImmunoResearch 127-165-160) anticorps doit être utilisé comme anticorps secondaire.
# 2: L'anticorps de collagène IV peut être utilisé pour détecter des vaisseaux sanguins après l'hybridation in situ.
# 3: L'anticorps Neuropilin1 est aimablement fourni par le laboratoire de l'Kolodkin Alex à l'Université Johns Hopkins. Sheep anticorps anti-humain Neuropilin1 est disponible en R & D (AF3870), bien que nous n'avons pas encore testé.
# 4: Les anticorps LYVE-1 également détecter un sous-ensemble des macrophages dans la peau embryonnaire.
# 5: L'anticorps anti-IgG2a de souris αSMA est un anticorps monoclonal.
# 6: L'anticorps conjugué Cy3 αSMA est incubé pendant 1 heure à température ambiante avec s.Anticorps secondaires pour d'autres anticorps primaires.
# 7: 2H3 anticorps est la souris anticorps monoclonal IgG1 contre les neurofilaments.
# 8: Tuj1 anticorps est IgG2a de souris d'anticorps monoclonaux contre le neurone-spécifique de classe III bêta-tubuline.
# 9: Le BFABP (cerveau-spécifiques d'acides gras binding protein) antibody est aimablement fourni par le laboratoire de l'Müller Thomas à Max-Delbrück-Center for Molecular Medicine.
Références
- Mukouyama, Y. S., Shin, D., Britsch, S., Taniguchi, M., Anderson, D. J. Sensory nerves determine the pattern of arterial differentiation and blood vessel branching in the skin. Cell. 109, 693-705 (2002).
- Mukouyama, Y. S., Gerber, H. P., Ferrara, N., Gu, C., Anderson, D. J. Peripheral nerve-derived VEGF promotes arterial differentiation via neuropilin 1-mediated positive feedback. Development. 132, 941-952 (2005).
- Wang, H. U., Chen, Z. F., Anderson, D. J. Molecular distinction and angiogenic interaction between embryonic arteries and veins revealed by ephrin-B2 and its receptor Eph-B4. Cell. 93, 741-753 (1998).
- Gerety, S. S., Wang, H. U., Chen, Z. F., Anderson, D. J. Symmetrical mutant phenotypes of the receptor EphB4 and its specific transmembrane ligand ephrin-B2 in cardiovascular development. Mol Cell. 4, 403-414 (1999).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon