Method Article
La cuantificación de la actividad de Cis Elementos reguladores en la retina del ratón por electroporación explante
En este artículo
Resumen
Este protocolo describe un método simple y económico para cuantificar la actividad de los elementos reguladores cis (es decir, potenciador / promotores) que viven en la retina del ratón a través de electroporación explante. Preparación del análisis de ADN, la disección de la retina, la electroporación, la cultura de explantes de retina, y después de la fijación y cuantificación se describen.
Resumen
Los factores de transcripción de genes dentro de las redes celulares controlar el patrón espacio-temporal y los niveles de expresión de sus genes diana mediante la unión a elementos reguladores cis-(CRE), corto (~ 300-600 pb) tramos de ADN genómico que se encuentran aguas arriba, aguas abajo, o dentro de los intrones de los genes que controlan. CRE (es decir, los potenciadores / promotores) suelen consistir en múltiples sitios de unión de clúster para los activadores transcripcionales y represores 1-3. Ellos sirven como integradores de lógica de entrada de la transcripción que dan una salida unitaria, en la forma de la actividad del promotor spatiotemporally precisa y exacta cuantitativamente. La mayoría de los estudios de mamíferos cis-regulación a la fecha se han basado en la transgénesis de ratón como un medio de ensayo de la función de potenciador de la CRES 4-5. Esta técnica es mucho tiempo, costoso y, a causa de los efectos de sitio de inserción, en gran parte no cuantitativa. Por otro lado, los análisis cuantitativos de los mamíferos la función CRE se han desarrollado en los sistemas de cultivo de tejidos (por ejemplo, los ensayos, la luciferasa dual), pero la relevancia in vivo de estos resultados es a menudo incierta.
La electroporación es una alternativa excelente a la transgénesis ratón tradicional ya que permite tanto la evaluación espacio-temporales y cuantitativos de cis-regulador de actividad en el tejido vivo de mamíferos. Esta técnica ha sido particularmente útil en el análisis de cis-regulación en el sistema nervioso central, especialmente en la corteza cerebral y la retina 6-8. Mientras que la retina del ratón electroporación, tanto in vivo como ex vivo, se ha desarrollado y ampliamente descrita por Matsuda y Cepko 6-7,9, recientemente se ha desarrollado un método sencillo para cuantificar la actividad de los fotorreceptores específicos de CRE en la retina del ratón electroporated 10. Teniendo en cuenta que la cantidad de ADN que se introduce en la retina de la electroporación puede variar de un experimento a experimento, es necesario incluir un co-electroporación "control de carga en todos los experimentos. En este sentido, la técnica es muy similar al ensayo de doble luciferasa utiliza para cuantificar la actividad del promotor en células cultivadas.
Al ensayar los fotorreceptores reguladores cis-actividad, electroporación se realiza generalmente en ratones recién nacidos (después del día 0, P0), que es el momento de máxima producción de varilla de 11 a 12. Una vez que los tipos de células retinianas se post-mitótico, la electroporación es mucho menos eficiente. Dada la alta tasa de nacimiento varilla en ratones recién nacidos y el hecho de que las barras constituyen más del 70% de las células en la retina de ratones adultos, la mayoría de las células que se someten a electroporación en P0 son varillas. Por esta razón, fotorreceptores de los bastones son el tipo más fácil de estudiar células de la retina a través de electroporación. La técnica que describimos aquí es principalmente útil para la cuantificación de la actividad de CRE fotorreceptor.
Protocolo
1. La construcción de la cámara de electroporación
- Para un portaobjetos, BTX Modelo 453 con una diferencia de 3,2 mm (Harvard Apparatus # 45-0105) (Fig. 2A). Los rieles de metal deberían estar herméticamente cerrados en la parte inferior de la diapositiva.
- Use una herramienta Dremel para cortar un mango de un estante de microcentrífuga tubo de plástico. Cortar el mango en cinco pequeñas piezas rectangulares, cada uno con las siguientes dimensiones: 0,8 cm de longitud, 0,6 cm de altura, 0,3 cm de ancho (Fig. 2B). Estas piezas de plástico son separadores reutilizables que serán utilizados para moldear los distintos pozos en la cámara de portaobjetos.
- Inserte los espaciadores de plástico entre los rieles de metal de los portaobjetos en intervalos regulares. Los espaciadores deben quedar bien ajustados (Fig. 2C).
- Cortar la punta de una pipeta de punta P200, el ajuste de la punta de una jeringa de 3 ml, y llenar la jeringa con sellador acuario de 100% de caucho de silicona. Llenar los vacíos entre los separadores de plástico con sellador. Asegúrese de llenar los huecos de abajo hacia arriba para que no se formen burbujas entre el tapón sellador y la base de los portaobjetos.
- Coloque una barra de metal sobre los separadores de plástico y sujete con clips de la carpeta, de modo que los separadores se mantienen en su lugar mientras se seca el sellador (Fig. 2D-E). Deje que el sellador seque durante la noche.
- Retire el clips de la carpeta, la vara de metal, y separadores de plástico (Fig. 2F). Use una hoja de bisturí para limpiar el sellador de la parte superior de los rieles de metal. Utilizar un microscopio de disección para examinar el portaobjetos y asegurarse de que no hay burbujas en la parte inferior de las presas de silicona. Retire cualquier película de sellador que puede haberse formado en los pozos de tal manera que el metal desnudo se expone dentro de los pozos. Llenar un pozo con agua y asegurarse de que el agua no se filtre en el pozo adyacente (s). Repita para todos los pozos.
- El portaobjetos terminado cabe en el plato de plástico con los postes de metal junto a la ventana en el lado de la antena (Fig. 2G), los electrodos con el tiempo se conectará a los postes de metal.
2. Preparación del ADN
- Añadir el plásmido de ADN en un tubo de microcentrífuga de 1,5 ml en hielo y llevar el volumen de 150μl con agua destilada. Varias especies de plásmido se pueden combinar para co-electroporación (por ejemplo, una construcción experimental DsRed y una construcción de control GFP). Al calcular la cantidad de ADN para añadir al tubo, tenga en cuenta que el volumen final de la alícuota de ADN se 60μl. Normalmente, cada construcción se utiliza a una concentración final de 0.5μg/μl.
- Precipitar el ADN mediante la adición de acetato de sodio 3M 15μl (pH 5,2) y el etanol 450μl del 100%. Invertir o toque el tubo varias veces para mezclar.
- Centrifugar el ADN a 4 º C, 13200 rpm, durante 30 minutos. Lavar el precipitado con etanol al 70%, y luego girar de nuevo a 4 º C, 13200 rpm, durante 15 minutos. Deje secar al aire hasta que la pastilla semi-transparente, a unos 7 minutos, y luego volver a suspender en agua estéril 54μl. Añadir 6μl estéril 10X PBS (pH 7,4) y mezclar.
3. Ojo colección
- Esterilizar la cámara de electroporación y todos los instrumentos con etanol al 70%. Mientras que la recaudación del ojo y la disección no es necesario realizar en una campana de cultivo de tejidos, desinfectar los guantes y la mesa de trabajo con el etanol y el intento de mantener condiciones estériles durante todo el procedimiento.
- Preparar placas de Petri con medio disección (1:1 de DMEM: F12, 100U/ml penicilina, estreptomicina 100μg/ml, 0.29mg/ml L-glutamina, y la insulina 5μg/ml): dos de 35 mm platos cada uno con 3 ml de medio y un plato de 60 mm con 6 ml de medio. Este paso se debe realizar en una campana de cultivo de tejidos.
- La desinfección de la cabeza y el cuello de un recién nacido (día postnatal 0) cría de ratón con etanol al 70%. Rápidamente decapitar con unas tijeras y la transferencia de la cabeza a un plato de 100 mm estériles.
- Cortar el cuero cabelludo con unas tijeras pequeñas para exponer los ojos. Use pinzas curvas para sacar suavemente el ojo de la órbita, y el lugar del ojo en una placa de 35 mm que contenían medio de disección. Puede ser útil para eliminar los ojos bajo un microscopio de disección a baja potencia.
- Repita los pasos 3.3 y 3.4 hasta que todos los ojos se han recogido. Mantenga los ojos en medio de la disección a temperatura ambiente, mientras que la disección. Usted tendrá los ojos 3.4 por alícuota del ADN.
4. Disección de la retina
- Uso etanol al 70% para desinfectar tanto una hoja de afeitar y el envoltorio de una pipeta de transferencia estéril de plástico. Cortar la punta de la pipeta con la hoja de modo que pueda aspirar un ojo entero. Tienda de la pipeta en el envoltorio de plástico cuando no se utiliza.
- La transferencia de un solo ojo en el plato de 35 mm a 60 mm del plato. Bajo el microscopio de disección a alta potencia, el uso de fórceps fino para quitar cualquier tejido, tales como los músculos extraoculares y la grasa, de la superficie del ojo. A continuación, retire el nervio óptico por pellizcos que bajar en la base.
- Con el fin de aislar a la retina, hacer un agujero pequeño in de la esclera en el limbo. Inserte una clavija de dos pares de pinzas en el agujero (tangencial a la superficie de la retina) y suavemente rasgar la esclerótica / EPR. En ratones albinos, la esclerótica y la RPE aparecen con relación a la brillante tejido de la retina, que es un color homogéneo color gris mate. En los ratones pigmentados, el EPR es de color negro. Salir de la lente en su lugar.
- Use la pipeta de transferencia para mover la retina diseccionado en el otro plato de 35 mm con el medio.
- Repita los pasos 4,2 a 4,4 hasta que todos los ojos han sido disecados.
- Tienda de la retina en un 37 ° C de cultivo de tejidos incubadora hasta que esté listo para electroporar.
5. Preparación para la electroporación
- Preparar platos de 35 mm de media. Para cada alícuota de ADN que se electroporated, tendrá un plato de medio de disección y un plato de medio de cultivo (medio de disección más el 10% de SFB). Etiqueta de los platos apropiadamente.
- Use una pipeta de P200 y estéril 1X PBS para vaciar las cámaras en el plato de la electroporación. Cada cámara tiene un volumen de 60-100μl. Lave cada cámara tres veces.
- Llene las cámaras con las alícuotas de ADN. Cualquier cámaras no utilizada debe ser llenado con 60μl de PBS 1X. Conectar los electrodos a la fuente de la electroporación.
- Use los siguientes ajustes en el electroporador: el modo, LV, de tensión, 30V, longitud de pulso, 50 ms, el número de pulsos, 5; intervalo de 950 ms, la polaridad, unipolar.
6. Electroporación
- El uso de fórceps fino para captar la retina por la lente y transferirlos a las cámaras de la electroporación. Cada cámara tiene capacidad para 3-4 retinas de ratón (Fig. 3).
- El uso de fórceps para alinear las retinas de tal manera que la lente se apoya contra la barra metálica conectada al electrodo positivo. Limpiar las pinzas con una Kimwipe después de cada traslado para evitar el arrastre de ADN de una cámara a otra.
- Una vez que todas las retinas están alineados, pulse el botón "Inicio" en la electroporador. Pequeñas burbujas que se forman en la barra de metal adheridos al electrodo negativo.
- Desconecte los electrodos y apagar el electroporador.
- El uso de fórceps para mover suavemente las retinas de las paredes de la cámara.
- Utilice una pipeta estéril de transferencia para transferir las retinas de las cámaras en las placas de 35 mm que contenían medio de disección.
- Lave cada cámara tres veces con PBS estéril 1X, luego enjuague con agua estéril. Rocíe plato con etanol al 70%.
7. La colocación de la retina en los filtros de la cultura
- Use una pipeta de transferencia para transferir las retinas en las placas de 35 mm que contienen medio de cultivo.
- Etiqueta de los pocillos de una placa de cultivo estériles de 6 pocillos y llenar cada pocillo con medio de cultivo de 3 ml.
- Usar pinzas estériles para colocar filtros Whatman ronda Nuclepore, lado brillante hacia arriba, encima de la media en cada pozo.
- Bajo un microscopio de disección, utilice una pipeta de transferencia estéril para la transferencia de la retina en el filtro, la lente del lado de abajo. Si las tierras retina lente-up lateral, recogerlo con la pipeta y el intento de colocarlo de nuevo. No coloque más de 4 retinas de un filtro, y asegúrese de que las gotas de medio que rodea a cada retina se mantienen separados de las gotas de otros. Tenga en cuenta que la cultura de la retina con el objetivo intacto, aunque otros protocolos exigen la retirada de la lente antes de este paso 9.
- Coloque la placa de cultivo en un 37 ° C incubadora de cultivo de tejidos (5% CO 2) y crecen por la cantidad de tiempo deseado, por lo general de ocho días. En nuestra experiencia, cambiando el medio no es necesaria durante el período de la cultura contemporánea ocho, aunque un cambio de medio puede ser necesaria por períodos ya la cultura.
8. Cosecha y flatmounting fluorescentes explantes de retina
- Vuelva a colocar el medio de cultivo en cada pocillo con paraformaldehído al 4% / PBS 1X. Si las retinas permanecen adheridos a los filtros, el uso de fórceps para voltear los filtros y más de pelar suavemente las retinas del filtro. Incubar en paraformaldehído durante 30 minutos. a temperatura ambiente. Proteger la retina de la luz para evitar el blanqueo de la fluorescencia.
- Enjuague las retinas dos veces durante 10 minutos en PBS 1X.
- Use una pipeta desechable para transferir las retinas en un portaobjetos de vidrio en una pequeña gota de PBS. Bajo un microscopio de fluorescencia de disección, el uso de fórceps para voltear la retina para que se someten a electroporación de arriba abajo (es decir, del lado de la lente hacia abajo).
- Vidrio lugar "pies" a partir de cubreobjetos triturada (trozos de vidrio de 1-2 mm de diámetro) en las esquinas de la diapositiva, estos pies prevenir el aplanamiento de la retina. Coloque un cubreobjetos de vidrio intacto a lo largo de la diapositiva para que cubra las retinas y se apoya en los pies. Si es necesario, utilice una pipeta para agregar más PBS entre el portaobjetos y un cubreobjetos el.
9. Imágenes y la cuantificación de la fluorescencia en flatmount
- Utilice unmicroscopio compuesto fluorescente equipado con una cámara de blanco y negro para la imagen de la retina flatmounted a baja potencia (objetivo 4X) en los canales rojo y verde. Todas las retinas debe ser fotografiada con el mismo tiempo de exposición para un determinado canal fluorescente para permitir la comparación de la intensidad de fluorescencia. Asegúrese de que los píxeles no están saturados en una imagen, o bien una cuantificación exacta será imposible. Exportar imágenes en escala de grises en formato TIFF.
- Abra la imagen de un conjunto de retina (es decir .., el canal rojo y canal verde) en el software ImageJ ( http://rsbweb.nih.gov/ij/ ). Por el bien de este tutorial, el canal verde fluorescente (GFP proteína) es el constructo de control que es constante en todas las retinas en el experimento. El canal rojo fluorescente (proteína DsRed) es la construcción experimental que varía para cada conjunto de retinas. Las imágenes deben ser en escala de grises.
- En ImageJ, seleccione el control de la imagen verde y especifica un círculo de interés con un diámetro de 100 unidades (Analizar / Herramientas / ROI director / Más / Especificar). Duplicar este círculo (ROI director / Add) para crear ocho círculos total. Mueve los círculos de 1-5 para seleccionar las cinco regiones que son uniformemente electroporación, evitando los bordes exteriores de la retina y la región que cubre la lente (Fig. 4A). Además, seleccione tres regiones (círculos 6-8) fuera de la retina / lente para medir la fluorescencia de fondo. Seleccione la imagen roja, desmarca la opción "Mostrar todos" caja de retorno de la inversión gerente, y volver a verificar la caja. Los ocho círculos que aparecen en la imagen roja. De la selección de todas las coordenadas círculo en el administrador de retorno de la inversión.
- Con la imagen seleccionada de color rojo, registrar el valor del píxel media de todos los círculos de interés (ROI director / Medida), las mediciones deben aparecer 1-8, 1-5, donde están las mediciones de la retina de color rojo y 6.8 son las medidas de fondo rojo. Seleccione la imagen verde y registrar el valor del píxel decir, las mediciones deben aparecer 9-16, 9-13, donde están las mediciones de la retina verde y 14-16 son las medidas de fondo verde. Copia de los datos de medición en Excel para su análisis (Fig. 5).
- Promedio de las tres medidas de fondo, tanto en el rojo y el verde de los canales. Restar la media de fondo rojo de cada una de las cinco mediciones de la retina en el canal rojo, repetir para el canal verde. Para cada región de la retina de interés, se divide el fondo-resta la medición de color rojo por la sustracción de fondo verde de medición con el fin de normalizar el nivel rojo experimental al nivel de control verde (Fig. 5).
- Determinar el promedio y desviación estándar de todas las mediciones normalizadas de una construcción dada DsRed (por ejemplo, 5 medidas por tres veces la retina la retina por separado). Con el fin de comparar cuantitativamente los resultados de electroporations llevó a cabo en días diferentes, siempre se incluye un "estándar" precipitación DsRed / GFP en cada conjunto de electroporación. Los valores relativos de expresión a través de experimentos puede ser comparado por la normalización de los niveles de expresión de este "estándar".
10. Los resultados representativos:
Un buen resultado de la electroporación en la expresión de la construcción de ADN (s) en 1 / 4 a 1 / 3 de la superficie de la retina (Fig. 4A). Desde fotorreceptores de los bastones, en particular, son transducidas eficientemente, esta técnica es ideal para la cuantificación de los fotorreceptores específicos de la actividad del promotor (Fig. 4B). Anteriormente hemos utilizado este método para cuantificar una serie de variantes de promotor de la barra de Rho-específica y Gnat1 loci 10. Hemos encontrado que es posible cuantificar la actividad del promotor en un casi 300 veces gama.
Figura 5 se muestra un conjunto de datos a partir de una sola retina electroporación. En este ejemplo particular, la construcción experimental pNrl (1.1kb)-DsRed se midió en el canal rojo y el control de la construcción de pNrl (3.2kb)-GFP se midió en el canal verde. Un conjunto de datos completa para el pNrl (1.1kb)-DsRed construir consistiría en 6-9 retinas medido de esta manera, y la desviación estándar se calcula en base a todos los "DsRed normalizado a las buenas prácticas agrarias" valores. Si tuviéramos que comparar el nivel de expresión de pNrl (1.1kb)-DsRed a, por ejemplo, pNrl (0.8kb)-DsRed, entonces ambas construcciones se deben a electroporación con el control de las buenas prácticas agrarias misma (por ejemplo, pNrl (3.2kb) - GFP) y la imagen en los tiempos de exposición. Es posible combinar los datos recogidos en diferentes días si una norma DsRed / electroporación GFP se lleva a cabo cada día (por ejemplo, pNrl (3.2kb)-dsRed + pNrl (3.2kb)-GFP). Para construir cada uno experimental, el nivel de DsRed normalizado posteriormente se normalizó el nivel normalizado DsRed de la "norma" (pNrl (3.2kb)-dsRed).
La técnica que describimos aquí es principalmente útil para la cuantificación de la actividad de 10,13 CRE fotorreceptor.Del tipo de células específicas cis-reguladoras actividad también se puede cuantificar en más raro tipos de células retinianas, como las células bipolares 14, pero esto generalmente requiere que las áreas de interés para cuantificar ser seleccionado en vertical, secciones transversales y no en los preparativos flatmount. Lo mismo puede decirse de la CRE que dirigir la expresión de múltiples tipos de células como los fotorreceptores y las células bipolares. Los procedimientos experimentales son de otra manera similar.
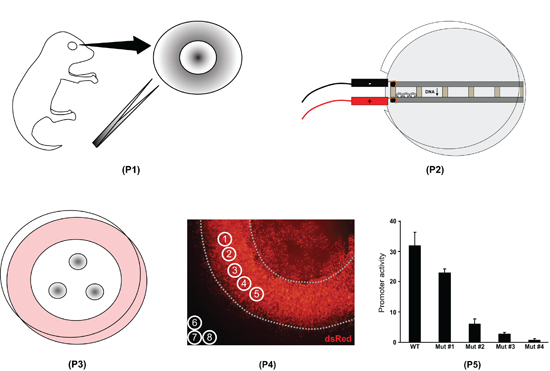
Figura 1. Descripción del procedimiento de explante electroporación retina. En primer lugar los ojos, todo se aíslan de las crías de ratón postnatal día 0 y las retinas son disecados (P1). En segundo lugar, las retinas se colocan en cámaras llenas de ADN y la electroporación (P2). En tercer lugar, las retinas se colocan en los filtros y se cultivan durante ocho días (P3). En cuarto lugar, los explantes de retina son fijos, montados en portaobjetos, y la imagen. La intensidad de fluorescencia se mide con el software ImageJ (P4). En quinto lugar, los datos ImageJ se procesan en un programa de hoja de cálculo para cuantificar la diferencia en la actividad de varios promotores (P5).

Figura 2. Construcción de la placa de la electroporación. A) sin modificar la cámara de portaobjetos de Harvard Apparatus, BTX modelo 453 (catálogo # 45 hasta 0105). B) Una herramienta Dremel se utiliza para cortar el mango de un estante de tubo de plástico. El mango se corta en separadores rectangulares con las siguientes dimensiones: 0,8 cm de longitud, 0,6 cm de altura, 0,3 cm de ancho. C) Los separadores de plástico se montan en la cámara de portaobjetos a intervalos iguales. Sellador acuario se inyecta en las diferencias entre los separadores (no mostrado). D) Una barra de metal se coloca sobre los espaciadores. E) El bar y los separadores se sujetan en la diapositiva con clips de la carpeta para mantener todo en su lugar mientras se seca el sellador durante la noche. F) Los espaciadores se retiran y los pozos se ponen a prueba para asegurarse de que son resistentes al agua. G) La caída terminó cabe en el plato de plástico con las barras de metal junto a la ventana en el lado del plato.

Figura 3. Diagrama de la placa de electroporación con retinas. Las cámaras están llenas de soluciones de ADN (hasta cinco soluciones diferentes a la vez). Retinas se colocan en las cámaras y orientado de manera que la lente está apoyado en la barra de metal conectado al electrodo positivo, tres o cuatro retinas caben en cada una de las cinco cámaras. La corriente eléctrica hará que las moléculas de ADN con carga negativa a entrar en las células retinianas.

Figura 4. A) ImageJ la medición de los niveles de fluorescencia en la retina flatmount. En escala de grises en el flatmount DsRed (experimental) y GFP (control) se abren los canales de software ImageJ, tenga en cuenta que estas imágenes han sido coloreados con fines ilustrativos. Cinco círculos de medición (1 a 5) se colocan sobre las regiones de manera uniforme por electroporación, evitando los bordes y el cristalino (líneas discontinuas). Tres círculos de medición (6 a 8) se colocan fuera de la retina para determinar los niveles de fluorescencia de fondo. B) imágenes de cortes transversales de un explante electroporated retina a alta potencia. El explante se fijó en el día postnatal 8, crioprotegieron en sucrose/1X 30% PBS la noche a 4 ° C, integrado en octubre, y la crio-seccionadas a 12μm. Los fluorescentes pNrl construcciones (1.1kb)-DsRed y pNrl (3.2kb)-GFP se expresa en las células fotorreceptoras de la capa nuclear externa (ONL). Capa de INL, nuclear interna, GCL, capa de células ganglionares.

Figura 5. Tratamiento de los datos de fluorescencia utilizando Excel. En el paso 1, el valor del píxel significa para cada círculo de medición se copia en la hoja de cálculo (las celdas B3, B12, F3-F5, H3, H5). Mediciones # 5.1 son los valores de la retina y DsRed # 6.8 son los valores de fondo DsRed; mediciones # 9.13 son los valores de las buenas prácticas agrarias y la retina # 14-16 son los valores de fondo las buenas prácticas agrarias. Tenga en cuenta que la medición # 1 y # 9 corresponden al círculo misma medida, al igual que las mediciones de # 2 y # 10, y así sucesivamente. En el paso 2, el valor de fondo promedio de los canales de DsRed y las buenas prácticas agrarias se calcula (células F6, H6). En el paso 3, la media de fondo se resta de cada medida de retina (células C3-C12). En el paso 4, cada uno de fondo-resta la medición DsRed se normaliza a su medida las buenas prácticas agrarias correspondientes (células D3-D7).
Discusión
Electroporación explante es una manera simple para cuantificar reguladores cis-actividad en la retina del ratón en desarrollo. En comparación con los reguladores cis-análisis a través de la transgénesis de ratón, la electroporación es mucho más barato, lo que requiere crías de ratón recién nacido solo, el ADN, los instrumentos de disección, y la electroporación / equipo de cultivo de tejidos. También es mucho menos tiempo de consumo: un experimento requiere sólo unas pocas horas de tiempo de preparación, un período de cultivo de unos ocho días, y un par de horas al final del experimento de imágenes y análisis de datos. Electroporación explante es también superior a la de cultivo celular basada en cis-regulador de análisis ya que el tejido retinal real se utiliza. La retina se desarrolla con toda normalidad en el explante de la cultura-que forma tres capas distintas celular (capa nuclear externa, capa nuclear interna, y la capa de células ganglionares), a pesar de fotorreceptores no elaborar los segmentos externos.
Una ventaja adicional es que la electroporación explante es altamente reproducible. Las mismas construcciones electroporated en retinas diferentes, incluso en días diferentes, por lo general los resultados en los niveles relativos de expresión misma. Además, dado que los plásmidos por electroporación se cree que se mantendrá episomal en el núcleo y no se incorporan en los cromosomas, que no parecen estar sujetos a los efectos de sitio mismo de integración que acosan a reguladores cis-análisis llevado a cabo en ratones transgénicos.
Electroporación explante tiene varias limitaciones. En primer lugar, sólo las células que aún están en el ciclo celular puede ser eficazmente transducidas por electroporación 15. En P0, varillas y otros que nacen después los tipos de células de la retina (células bipolares, amacrinas, las células de Müller M) son las poblaciones de células principales objetivo de este método. Electroporación de los conos de P0 electroporación se ha reportado 16, pero la eficacia parece ser bajo. Una segunda limitación es que la cultura explante más allá de dos semanas en los resultados malformación progresiva de la retina y por lo tanto no se recomienda. Si la cuantificación promotor se requiere en los puntos de tiempo tarde, sin embargo, una de electroporación in vivo 09 de mayo se realizará, seguida por disección de la retina en el punto de tiempo deseado, planos de montaje de la retina disecados, y la cuantificación como se describe en la sección 9. Una tercera limitación es que esta prueba es sólo moderadamente alto rendimiento. A diferencia de los ensayos de cultivo celular que se puede probar cientos de construcciones en un solo experimento, la técnica descrita en este protocolo requiere un mínimo de una retina del ratón por toda la construcción. Por lo tanto, sólo un par de docenas de construcciones puede ser razonablemente electroporated en un día.
Una advertencia adicional con respecto a la cuantificación de la actividad promotora con el enfoque actual es que hay un potencial de "sangrado a través de" la fluorescencia DsRed en el canal de las buenas prácticas agrarias, en particular cuando los promotores de ensayo muy fuerte. La razón de esto es que el espectro de emisión de DsRed se solapa parcialmente con la de las buenas prácticas agrarias. Para evitar este problema, los filtros de optimización de emisión, deben que minimicen el solapamiento espectral entre DsRed y las buenas prácticas agrarias. Cuando tales juegos de filtros optimizados no están disponibles, otra posible solución sería el uso de una proteína fluorescente de color azul en diferido (por ejemplo, BFP o PPC) en lugar de las buenas prácticas agrarias.
Divulgaciones
Agradecimientos
Los autores desean agradecer a Karen Lawrence por su ayuda en la sección que describe la construcción de la cámara de electroporación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Plato de la electroporación, portaobjetos 453 | BTX Harvard Apparatus | 45-0105 | Vea la sección 1 del protocolo de modificaciones |
| 100% de silicona de caucho acuario de cemento | Perfecto fabricación | ||
| Bastidor microtubos de plástico | Fisher Scientific | 05-541 | Sólo el identificador de rack será utilizado |
| Dremel herramienta | Para cortar el mango de la rejilla del tubo de plástico | ||
| DMEM | Gibco / Invitrogen | 11965 | |
| F12 | Gibco / Invitrogen | 11765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | Concentración 100 veces |
| Insulina | Sigma-Aldrich | I-6634 | De imágenes de stock 1000X, resuspender en 5mg/ml en 5 mM HCl y el filtro de esterilización- |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 de onda cuadrada electroporador | BTX Harvard Apparatus | ||
| Nuclepore filtros | Whatman | 110606 | 25mm, 0.2μm |
| Incubadora de cultivo de tejidos | 37 ° C, 5% de CO 2 | ||
| Cubreobjetos de vidrio # 1.5 | Fisher Scientific | 12-544E | De espesor 0.16mm |
| Microscopio compuesto fluorescente equipado con cámara | Cámara debe ser monocromática (por ejemplo, ORCA-ER cámara Hamamatsu) | ||
| EGFP / set DsRed filtro para microscopio compuesto | Chroma Technology Corp. | 86007 | Este filtro minimiza bleedthrough conjunto entre el chanenels rojo y verde |
| ImageJ Software | NIH | http://rsbweb.nih.gov/ij/ |
Referencias
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. From DNA to diversity : molecular genetics and the evolution of animal design. , 2nd edn, Blackwell Pub. (2005).
- Davidson, E. H. Genomic regulatory systems : development and evolution. , Academic Press. (2001).
- Ptashne, M., Gann, A. Genes & signals. , Cold Spring Harbor Laboratory Press. (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados