Method Article
Quantificar a atividade de Cis Elements-Regulação na retina do rato por Eletroporação Remoção
Neste Artigo
Resumo
Este protocolo descreve uma maneira simples e barata para quantificar a atividade de cis-regulatórias elementos (ie, enhancer / promotores) na vida retinas do mouse via eletroporação explante. Preparação de DNA, a dissecção da retina, eletroporação, a cultura de explantes de retina, e pós-fixação análise e quantificação são descritos.
Resumo
Fatores de transcrição de genes dentro das redes celulares controlar o padrão espaço-temporal e os níveis de expressão de seus genes-alvo pela ligação a elementos cis-reguladores (CREs), de curta duração (~ 300-600 pb) trechos de DNA genômico, que pode mentir montante, a jusante, ou dentro os íntrons dos genes que controlam. CREs (ie, enhancers / promotores) tipicamente consistem de múltiplos agrupados sítios de ligação para ambos os ativadores e repressores transcripcional 1-3. Eles servem como integradores de lógica de entrada de transcrição dando uma saída unitária na forma de atividade do promotor espaço-temporalmente preciso e quantitativamente exata. A maioria dos estudos de mamíferos cis-regulação, até à data têm contado com transgênese mouse como um meio de doseamento a função realçador de CREs 4-5. Esta técnica é demorado, caro e, por conta dos efeitos local de inserção, em grande parte não-quantitativo. Por outro lado, ensaios quantitativos para a função CRE mamíferos têm sido desenvolvidos em sistemas de cultura de tecidos (por exemplo, dual ensaios luciferase), mas o in vivo relevância destes resultados é muitas vezes incerto.
Eletroporação oferece uma excelente alternativa para transgenia mouse tradicional na medida em que permite tanto a avaliação espaço-temporal e quantitativa da cis-regulatórias atividade no tecido vivo em mamíferos. Esta técnica tem sido particularmente útil na análise de cis-regulação no sistema nervoso central, especialmente no córtex cerebral e da retina 6-8. Enquanto eletroporação do mouse na retina, tanto in vivo e ex vivo, foi desenvolvida e amplamente descrito por Matsuda e Cepko 6-7,9, desenvolvemos recentemente uma abordagem simples para quantificar a atividade dos fotorreceptores específicos CREs em electroporated rato retinas 10. Dado que a quantidade de DNA que é introduzido na retina por eletroporação pode variar de experimento para experimento, é necessário incluir um co-electroporated "controle de carga" em todos os experimentos. A este respeito, a técnica é muito semelhante ao ensaio de luciferase dupla utilizada para quantificar atividade do promotor em células em cultura.
Quando se examina as fotorreceptoras atividade cis-regulatórias, eletroporação é geralmente realizado em ratos recém-nascidos (dia pós-natal 0, P0) que é o tempo de produção da haste de pico 11-12. Uma vez que os tipos de células da retina tornam-se pós-mitótico, eletroporação é muito menos eficiente. Dada a elevada taxa de nascimento haste em ratos recém-nascidos eo fato de que hastes constituem mais de 70% das células da retina de camundongos adultos, a maioria das células que estão em electroporated P0 são hastes. Por esta razão, os bastonetes são o tipo mais fácil de células da retina para estudar via eletroporação. A técnica aqui descrita é útil principalmente para quantificar a atividade de CREs fotorreceptoras.
Protocolo
1. Construção da câmara de eletroporação
- Encomendar um MICROSLIDE, BTX Modelo 453, com uma lacuna 3,2 milímetros (Harvard Apparatus # 45-0105) (Fig. 2A). Os trilhos de metal devem ser completamente selados para o fundo do slide.
- Use uma ferramenta Dremel cortar uma alça fora um rack de plástico tubo de microcentrífuga. Cortar a alça em 5 pequenos pedaços retangulares, cada um com as seguintes dimensões: 0,8 centímetros de comprimento, 0,6 centímetros de altura, largura 0,3 centímetros (Fig. 2B). Estas peças de plástico são reutilizáveis espaçadores que será usado para moldar poços individuais na câmara MICROSLIDE.
- Insira os espaçadores de plástico entre os trilhos de metal do MICROSLIDE em intervalos regulares. Os espaçadores deve caber confortavelmente (Fig. 2C).
- Corte a ponta fora uma ponteira P200, cabem na ponta de uma seringa de 3 ml, e preencha a seringa com 100% de borracha de silicone selante aquário. Preencher as lacunas entre os espaçadores de plástico com vedante. Certifique-se de preencher as lacunas de baixo para cima de modo que nenhum bolhas se formam entre o plugue do selante e da base do MICROSLIDE.
- Coloque uma haste de metal no topo da espaçadores de plástico e prenda-a com grampos da pasta, de modo que os espaçadores são mantidos no lugar enquanto o selante seca (Fig. 2D-E). Deixe o selante secar durante a noite.
- Remova o clips binder, haste de metal, e espaçadores de plástico (Fig. 2F). Use uma lâmina de bisturi para limpar o selante em cima dos trilhos de metal. Use um microscópio de dissecação para examinar o MICROSLIDE e garantir que nenhum bolhas de ar na parte inferior das barragens silicone. Remova qualquer filme selante que podem ter se formado nos poços de tal forma que bare metal é exposto dentro dos poços. Preencher um poço com água e certifique-se que a água não vaza para dentro do poço adjacente (s). Repita o procedimento para todos os poços.
- O MICROSLIDE terminou se encaixa no prato de plástico com os pólos de metal ao lado da janela do lado do prato (Fig. 2G); os eletrodos acabará por ser anexado aos pólos metal.
2. Preparação de DNA
- Adicionar DNA plasmidial a um tubo de microcentrífuga de 1,5 ml em gelo e colocar o volume até 150μl com água destilada. Múltiplas espécies plasmídeo podem ser combinados para co-eletroporação (por exemplo, uma construção experimental DsRed e um controle construir GFP). Ao calcular a quantidade de DNA para adicionar ao tubo, tenha em mente que o volume final da alíquota de DNA será 60μl. Normalmente, cada construção é usado em uma concentração final de 0.5μg/μl.
- Precipitar o DNA pela adição de acetato de sódio 3M 15μl (pH 5,2) e etanol 100% 450μl. Inverter o tubo ou tocar várias vezes para misturar.
- Girar o DNA a 4 ° C, 13200 rpm, por 30 minutos. Lave o pellet com etanol 70%, em seguida, girá-lo para baixo novamente a 4 ° C, 13200 rpm, por 15 minutos. Secar o pellet até semi-translúcida, cerca de 7 minutos, depois ressuspender em água estéril 54μl. Adicionar 6μl estéril PBS 10X (pH 7,4) e misturar.
3. Coleta de olho
- Esterilizar a câmara de eletroporação e todos os instrumentos com álcool a 70%. Enquanto a coleta de olho e dissecção não precisam ser realizados em uma capa de cultura de tecidos, desinfectar as luvas e bancada com etanol e tentativa de manter condições estéreis durante o procedimento.
- Prepare placas de Petri com meio de dissecção (1:1 relação de DMEM: F12, 100U/ml penicilina, estreptomicina 100μg/ml, 0.29mg/ml L-glutamina, e insulina 5μg/ml): dois pratos de 35 milímetros cada um com média de 3 ml e um prato 60 milímetros, com média 6ml. Esta etapa deve ser realizada em uma capa de cultura de tecidos.
- Desinfectar a cabeça eo pescoço de um recém-nascido (dia pós-natal 0) rato filhote com etanol 70%. Rapidamente decapitar com uma tesoura e transferir a cabeça para um prato estéril 100mm.
- Cortar o couro cabeludo com uma tesoura pequena para expor aos olhos. Use uma pinça curva suavemente para colher o olho fora da órbita, e colocar o olho em um prato de 35 milímetros contendo meio de dissecção. Pode ser útil para remover os olhos sob um microscópio de dissecação em baixa potência.
- Repita os passos 3.3 e 3.4 até que todos os olhos foram coletados. Manter os olhos em meio a dissecação em temperatura ambiente, enquanto dissecar. Você vai precisar de olhos 3-4 por alíquota DNA.
4. Dissecção da retina
- Uso do etanol 70% para desinfectar ambas uma lâmina de barbear e o invólucro de uma pipeta estéril de plástico. Corte a ponta fora da pipeta com a lâmina para que ele possa sugar um olho todo. Loja da pipeta na embalagem de plástico quando não estiver em uso.
- Transferência de um dos olhos do prato 35mm para o prato 60mm. Sob o microscópio de dissecação em alta potência, utilize uma pinça fina para remover qualquer tecido, tais como os músculos extra-oculares e da gordura, a partir da superfície do olho. Em seguida, remova o nervo óptico por beliscar-lo na base.
- , A fim de isolar a retina, picar um furo pequeno in a esclera no limbo. Inserir um pino de ambos os pares de pinças para o buraco (tangente à superfície da retina) e gentilmente rasgar a esclera / RPE. Em ratos albinos, a esclera e RPE aparecem relativa brilhante ao tecido da retina, que é uma cor fosca homogêneo cinza. Em ratos pigmentados, a RPE é preto. Deixar a lente no lugar.
- Use a pipeta de transferência para mover a retina dissecados no outro prato de 35mm com média.
- Repita os passos 4,2-4,4 até que todos os olhos foram dissecados.
- Armazenar as retinas em um 37 ° C a cultura de tecidos incubadora até que você esteja pronto para electroporate.
5. Preparação para eletroporação
- Preparar pratos 35mm de médio porte. Para cada alíquota de DNA a ser electroporated, você vai precisar de um prato de meio de dissecação e um prato de meio de cultura (meio de dissecção mais 10% FBS). Rotular os pratos de forma adequada.
- Use uma pipeta P200 e estéril 1X PBS para lavar as câmaras no prato eletroporação. Cada câmara tem um volume de 60-100μl. Lavar a cada câmara três vezes.
- Preencher as câmaras com as alíquotas de DNA. Qualquer câmaras não utilizados devem ser preenchidos com 60μl PBS 1X. Ligar os eléctrodos ao prato eletroporação.
- Use as seguintes configurações na electroporator: modo, LV; tensão, 30V, comprimento de pulso, 50 ms, o número de pulsos, 5; intervalo, a 950 ms; polaridade, unipolar.
6. Eletroporação
- Use uma pinça fina para compreender o retinas pela lente e transferi-los para as câmaras de eletroporação. Cada câmara tem capacidade para até 04/03 do mouse retinas (Fig. 3).
- Use uma pinça para alinhar as retinas de tal forma que a lente se apóia na barra de metal ligado ao eletrodo positivo. Limpar a pinça com um Kimwipe após cada transferência, para evitar o reporte de DNA de uma câmara para outra.
- Uma vez que todas as retinas estão alinhados, pressione "Start" no electroporator. Pequenas bolhas devem formar na barra de metal presa ao eletrodo negativo.
- Desconectar os eletrodos e desligar o electroporator.
- Use uma pinça para gentilmente mover o retinas longe das paredes da câmara.
- Use uma pipeta estéril para transferir as retinas das câmaras de 35 milímetros para os pratos contendo meio de dissecção.
- Lavar a cada câmara três vezes com 1X PBS estéril e, em seguida enxaguar com água estéril. Spray de prato com etanol 70%.
7. Colocando retinas em filtros para a cultura
- Use uma pipeta para transferir o retinas para os pratos 35 milímetros contendo meio de cultura.
- Rotular os poços de uma placa de cultura estéril 6-bem e encher cada poço com meio de cultura 3ml.
- Use uma pinça estéril para colocar rodada filtros Whatman Nuclepore, lado brilhante para cima, no topo do meio em cada poço.
- Sob um microscópio de dissecação, use uma pipeta estéril para transferir o retinas no filtro, lente-side-down. Se as terras retina lente-side-up, buscá-lo com a pipeta e tentar colocá-lo novamente. Não coloque mais de 4 retinas em um filtro, e certifique-se que as gotas de meio circundante cada retina permanecem separados dos outros gotas. Note-se que a cultura que a retina com a lente intacta, embora outros protocolos chamada para a remoção da lente antes desta etapa 9.
- Coloque a placa de cultura em 37 ° C de cultura de tecidos incubadora (5% CO 2) e crescer para a quantidade desejada de tempo, normalmente de oito dias. Em nossa experiência, mudando o meio é desnecessária durante o período de oito dias de cultura, embora uma mudança médio pode ser necessária por períodos mais longos cultura.
8. Colheita e flatmounting fluorescentes explantes da retina
- Substituir o meio de cultura em cada poço com paraformaldeído a 4% / PBS 1X. Se o retinas permanecem presos aos filtros, utilize uma pinça para virar os filtros mais e descascar delicadamente as retinas fora do filtro. Incubar em paraformaldeído por 30 min. à temperatura ambiente. Proteger as retinas da luz para evitar o branqueamento de fluorescência.
- Lavar o retinas duas vezes durante 10 minutos em PBS 1X.
- Use uma pipeta descartável para transferir as retinas numa lâmina de vidro em uma pequena gota de PBS. Sob um microscópio de fluorescência de dissecação, utilize uma pinça para virar a retina para que eles sejam electroporated-side-up (ou seja, a lente-side-down).
- Lugar de vidro "pés" feita a partir de lamínulas esmagado (cacos de vidro de cerca de 1-2 mm de diâmetro) nos cantos do slide; estes pés evitar achatamento da retina. Coloque uma lamela de vidro intacto sobre o slide para que ele cobre o retinas e repousa sobre os pés. Se necessário, use uma pipeta para adicionar PBS mais entre a lâmina ea lamela.
9. Imagem e quantificação da fluorescência em flatmount
- Use umamicroscópio composto fluorescente equipado com uma câmera monocromática para a imagem da retina flatmounted em baixa potência (objetivo 4X) nos canais vermelho e verde. Todas as retinas deve ser trabalhada com o mesmo tempo de exposição para um determinado canal fluorescentes para permitir a comparação de intensidades de fluorescência. Certifique-se que os pixels não estão saturados em qualquer imagem, ou então a quantificação exata será impossível. Exportar imagens em escala de cinza formato TIFF.
- Abra a imagem definida para uma retina (ou seja .., vermelho e verde canal canal) no ImageJ software ( http://rsbweb.nih.gov/ij/ ). Por causa deste tutorial, o canal verde fluorescente (GFP proteína) é a construção de controle que é constante em todas as retinas no experimento. O canal vermelho fluorescente (proteína DsRed) é a construção experimental, que varia para cada conjunto de retinas. As imagens devem ser em tons de cinza.
- No ImageJ, selecione a imagem verde e controle de especificar um círculo de interesses com diâmetro de 100 unidades (Analyze / Ferramentas / ROI manager / Mais / Especifique). Duplicar o círculo (ROI manager / Adicionar) para criar oito círculos total. Mover círculos 1-5 para selecionar cinco regiões que são uniformemente electroporated, evitando as bordas externas da retina e região que cobre a lente (Fig. 4A). Além disso, selecione três regiões (círculos 6-8) fora da retina / lente para medir a fluorescência de fundo. Selecione a imagem vermelha, desmarque o "Show all" caixa em ROI manager, e verifique novamente a caixa. Todos os oito círculos deve aparecer na imagem vermelha. De-selecionar todas as coordenadas círculo no gerenciador de ROI.
- Com a imagem selecionada vermelho, registre o valor de pixel significa para todos os círculos de interesse (ROI manager / Medida); medições devem aparecer 1-8, 1-5, onde estão as medições vermelho da retina e 6-8 são as medidas de fundo vermelho. Selecione a imagem verde e gravar o valor de pixel média; medições 16/09 deve aparecer, onde 13/09 são as medidas verde da retina e 14-16 são as medidas de fundo verde. Copiar os dados de medição em Excel para análise (Fig. 5).
- Média das três medidas de fundo, tanto no vermelho e os canais verde. Subtrair a média fundo vermelho em cada uma das cinco medidas da retina no canal vermelho; repetir para o canal verde. Para cada região da retina de interesse, divida o-fundo subtraído medição vermelho pela medida de fundo verde-subtraído, a fim de normalizar o nível experimental vermelho para o nível de controle verde (Fig. 5).
- Determinar a média e desvio padrão de todas as medições normalizado para um determinado construto DsRed (por exemplo, 5 medições por vezes retina 3 retinas separado). Quantitativamente, a fim de comparar os resultados de electroporations realizadas em dias diferentes, sempre incluir um "padrão" precipitação DsRed / GFP em cada conjunto de eletroporação. Valores de expressão relativa em experimentos podem ser comparados com a normalização do nível de expressão desse "padrão".
10. Resultados representativos:
A eletroporação bons resultados na expressão da construção de DNA (s) em 1 / 4 a 1 / 3 da superfície da retina (Fig. 4A). Uma vez que os bastonetes em particular, são eficientemente transduzidas, esta técnica é ideal para quantificar fotorreceptor-específica atividade do promotor (Fig. 4B). Nós já usou esta abordagem para quantificar uma gama de variantes promotor da vara de Rho-específicos e Gnat1 loci 10. Descobrimos que é possível quantificar atividade do promotor em uma faixa de cerca de 300 vezes.
Figura 5 é um conjunto de dados a partir de uma amostra única electroporated retina. Neste exemplo em particular, a construção experimental pNrl (1.1kb)-DsRed foi medida no canal vermelho eo controle construir pNrl (3.2kb)-GFP foi medido no canal verde. Um conjunto de dados completo para o pNrl (1.1kb)-DsRed construir consistiria de 6-9 retinas medido desta maneira, e desvio padrão será calculado com base em todos "DsRed normalizado para GFP" valores. Se fôssemos comparar o nível de expressão de pNrl (1.1kb) DsRed-a, por exemplo, pNrl (0.8kb)-DsRed, então ambos os construtos precisaria ser electroporated com o controle GFP mesmo (por exemplo, pNrl (3.2kb) - GFP) e representado nos momentos mesma exposição. É possível reunir dados coletados em dias diferentes se um padrão DsRed / eletroporação GFP é executada em cada dia (por exemplo, pNrl (3.2kb)-dsRed + pNrl (3.2kb)-GFP). Para cada construção experimental, o nível normalizado DsRed seria posteriormente normalizada ao nível normalizado DsRed do "padrão" (pNrl (3.2kb)-dsRed).
A técnica aqui descrita é útil principalmente para quantificar a atividade de CREs fotorreceptoras 10,13.Células do tipo de atividade cis-regulatórias específicas também podem ser quantificados em mais raros tipos de células da retina, tais como células bipolares 14, mas isso geralmente requer que as áreas de interesse a ser quantificada ser selecionado em seções transversais verticais ao invés de preparações flatmount. O mesmo vale para qual unidade CREs expressão em vários tipos de células, tais como fotorreceptores e células bipolares. Os procedimentos experimentais são de outra maneira similar.
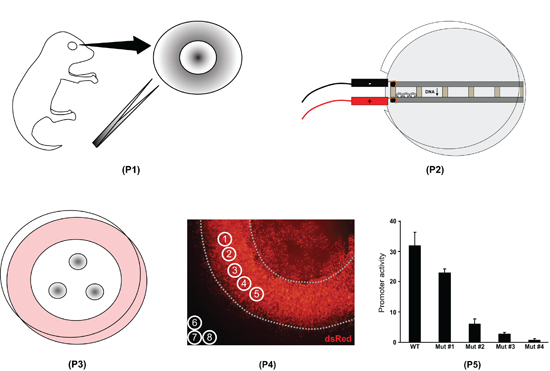
Figura 1. Visão geral do processo de retina explante eletroporação. Primeiro, os olhos todo são isolados do dia 0 pós-natal filhotes de rato e as retinas são dissecadas (P1). Segundo, as retinas são colocados em câmaras cheias de DNA e electroporated (P2). Terceiro, as retinas são colocados em filtros e cultivadas durante oito dias (P3). Quarta, os explantes da retina são fixos, montados em lâminas e imagens. Intensidade de fluorescência é medida com ImageJ software (P4). Em quinto lugar, os dados são processados em ImageJ um programa de planilha para quantificar a diferença na atividade de vários promotores (P5).

Figura 2. Construção do prato eletroporação. A) da câmara MICROSLIDE Unmodified de Harvard Apparatus, BTX modelo 453 (catalogo 45-0105). B) A ferramenta Dremel é usada para cortar a alça fora de um suporte de tubos de plástico. A alça é cortado em espaçadores retangular com as seguintes dimensões: 0,8 centímetros de comprimento, 0,6 centímetros de altura, 0,3 centímetros de largura. C) Os espaçadores de plástico são montados na câmara MICROSLIDE em intervalos iguais. Selante aquário é injetado no lacunas entre os espaçadores (não mostrado). D) A barra de metal é colocada sobre os espaçadores. E) O bar e espaçadores são fixados para o slide com grampos da pasta para manter tudo no lugar após a secagem do selante durante a noite. F) Os espaçadores são removidos e os poços são testadas para garantir que eles são à prova d'água. G) O slide terminou se encaixa no prato de plástico com as barras de metal ao lado da janela do lado do prato.

Figura 3. Diagrama do prato eletroporação com retinas. As câmaras são preenchidas com soluções de DNA (até cinco soluções diferentes ao mesmo tempo). Retinas são colocados nas câmaras e orientada de modo que a lente está encostado na barra de metal ligado ao eletrodo positivo, três ou quatro retinas vai caber em cada uma das cinco câmaras. A corrente elétrica irá causar as moléculas de DNA carregada negativamente para mover dentro das células da retina.

Figura 4. A) medição da retina ImageJ níveis de fluorescência em flatmount. Em tons de cinza flatmount na DsRed (experimental) e GFP (controle) os canais são abertos no software ImageJ, note que essas imagens foram coloridas apenas para fins ilustrativos. Cinco círculos de medição (1 a 5) são colocados sobre as regiões de maneira uniforme electroporated, evitando as bordas e lente (linhas pontilhadas). Três círculos de medição (6 a 8) são colocados fora da retina para determinar os níveis de fluorescência de fundo. B) transversal imagens de um explante electroporated retina na potência alta. O explante foi fixada em dias pós-parto 8, cryoprotected em 30% sucrose/1X PBS overnight a 4 ° C, embutido em outubro, e crio-seccionada em 12μm. O fluorescentes constrói pNrl (1.1kb)-DsRed e pNrl (3.2kb)-GFP são expressos em células fotorreceptoras na camada externa nuclear (ONL). INL, camada nuclear interna; GCL, camada de células ganglionares.

Figura 5. Processamento de dados de fluorescência usando Excel. Na etapa 1, o valor de pixel significa para cada círculo de medição é copiado para a planilha (células de B3-B12, F3-F5, H3-H5). # 1-5 medições são os valores DsRed retina e # 6-8 são os valores de fundo DsRed; medições # 13/09 são os valores GFP da retina e # 14-16 são os valores de fundo GFP. Note-se que a medição # 1 e # 9 correspondem ao círculo de medição mesmo, como fazem as medições # 2 e # 10, e assim por diante. Na etapa 2, o valor médio de fundo para os canais DsRed e GFP é calculado (células F6, H6). No passo 3, o fundo médio é subtraído cada medição da retina (células C3-C12). No passo 4, cada um fundo-de medição subtraído DsRed é normalizado para a sua medição correspondente GFP (células D3-D7).
Discussão
Eletroporação explante é um meio simples de quantificar cis-regulatórias atividade na retina do rato em desenvolvimento. Comparado com cis-regulatórias análise via transgenia mouse, eletroporação é muito mais barato, exigindo filhotes de rato recém-nascidos só, DNA, instrumentos de dissecação, e eletroporação / equipamentos de cultura de tecidos. É também muito menos tempo consumindo: um experimento requer apenas algumas horas de tempo de preparação, um período de cultura de cerca de oito dias e algumas horas no final do experimento para geração de imagens e análise de dados. Eletroporação explante também é superior à análise de cultura de células baseado em cis-regulatórias desde tecido da retina real é utilizado. A retina desenvolve bastante normalmente em explante cultura faz três distintas camadas celulares (camada nuclear externa, camada nuclear interna e camada de células ganglionares), apesar de fotorreceptores não formulam segmentos externos.
Uma outra vantagem é que eletroporação explante é altamente reprodutível. As construções mesmo em retinas electroporated diferentes, mesmo em dias diferentes, geralmente resulta no mesmo nível de expressão relativa. Além disso, como os plasmídeos electroporated são pensados para ser mantida episomally no núcleo e não são incorporados nos cromossomos, que parecem não estar sujeitos aos efeitos da integração mesmo site que atormentam cis-regulatórias análise realizada em camundongos transgênicos.
Eletroporação explante tem várias limitações. Primeiro, apenas as células que ainda estão no ciclo celular pode ser eficientemente transduzidas por eletroporação 15. Em P0, varetas e outros mais tarde, nascido tipos de células da retina (células bipolares, células amácrinas, M ller glia) são as populações de células principais visados por este método. Eletroporação de cones fotorreceptores por P0 eletroporação tem sido relatada 16, mas a eficiência parece ser baixa. Uma segunda limitação é que a cultura de explantes além de dois resultados semanas em malformação progressiva da retina e não é recomendada. Se quantificação promotor é necessário em intervalo de tempo final, no entanto, uma eletroporação in vivo 09 de maio será realizada, seguida de dissecção da retina no ponto no tempo desejado, flat-fixação da retina dissecados e quantificação conforme descrito na seção 9. Uma terceira limitação é que este ensaio é apenas moderadamente alto rendimento. Ao contrário dos ensaios de cultura de células-based que pode testar centenas de construções em um único experimento, a técnica descrita neste protocolo requer um mínimo de uma retina do rato por toda construir. Assim, apenas uma dúzia de construções podem ser razoavelmente electroporated em um dia.
Uma ressalva adicionais com respeito à quantificação da atividade do promotor com a presente abordagem é que há um potencial para "sangrar-through 'de fluorescência DsRed no canal GFP, particularmente quando se examina promotores muito forte. A razão para isto é que o espectro de emissão de DsRed parcialmente idêntica à do GFP. Para contornar esse problema, filtros de emissão otimizada deve ser usado que minimizam a sobreposição espectral entre DsRed e GFP. Quando tal otimizado conjuntos de filtros não estão disponíveis, outra possível solução seria a utilização de uma proteína fluorescente azul-deslocada (por exemplo, BFP ou PCP) em vez de GFP.
Divulgações
Agradecimentos
Os autores gostariam de agradecer a Karen Lawrence por sua ajuda com a construção seção que descreve da câmara de eletroporação.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
|---|---|---|---|
| Prato eletroporação, MICROSLIDE 453 | BTX Harvard Apparatus | 45-0105 | Ver protocolo seção 1 para modificações |
| 100% de borracha de silicone de cimento aquário | Perfecto Manufacturing | ||
| Rack de microtubo de plástico | Fisher Scientific | 05-541 | Apenas a alça de rack será usado |
| Ferramenta Dremel | Para cortar a alça fora do rack tubo de plástico | ||
| DMEM | Gibco / Invitrogen | 11965 | |
| F12 | Gibco / Invitrogen | 11765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | Concentração 100X |
| Insulina | Sigma-Aldrich | I-6634 | Para o estoque 1000X, ressuspender a 5mg/ml em HCl 5mM e filtro-esterilize |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 electroporator de onda quadrada | BTX Harvard Apparatus | ||
| Filtros Nuclepore | Whatman | 110606 | 25mm, 0,2 Hm |
| Cultura de tecidos incubadora | 37 ° C, 5% CO 2 | ||
| Lamínulas de vidro # 1.5 | Fisher Scientific | 12-544E | 0,16 milímetros de espessura |
| Microscópio composto fluorescente equipado com câmera | Câmera deve ser monocromática (por exemplo, ORCA-ER câmera Hamamatsu) | ||
| EGFP / conjunto de filtros para DsRed microscópio composto | Chroma Technology Corp | 86007 | Este conjunto de filtros bleedthrough minimiza entre o chanenels vermelho e verde |
| Software ImageJ | NIH | http://rsbweb.nih.gov/ij/ |
Referências
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. . From DNA to diversity : molecular genetics and the evolution of animal design. , (2005).
- Davidson, E. H. . Genomic regulatory systems : development and evolution. , (2001).
- Ptashne, M., Gann, A. . Genes & signals. , (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados