Method Article
의 활동을 Quantifying CIS - 규제 요소
요약
이 프로토콜은 explant의 electroporation을 통해 마우스 망막 생활 CIS - 규제 요소의 활동 (즉, 확장기 / 발기인)를 수치 간단하고 저렴한 방법을 설명합니다. DNA의 준비, 망막 절개, electroporation, 망막 explant의 문화, 포스트 고정 분석과 부량이 설명되어 있습니다.
초록
세포 유전자 네트워크 내에서 전사 요소 짧은 CIS - 규제 요소 (CRES)에 바인딩하여 spatiotemporal 패턴과 목표 유전자의 표현 수준을 제어 (~ 300-600 BP) 상류 거짓말을 할 수 게놈의 DNA 뻗어, 하류, 또는 시간 그들이 제어 유전자의 introns. 크르 (즉, 강화 / 발기인)은 일반적으로 1-3 transcriptional activators 및 repressors 모두에 대해 여러 개의 클러스터 바인딩 사이트로 이루어져 있습니다. 그들은 transcriptional 입력 논리적으로 통합이 spatiotemporally 정확하고 양적 정확한 발기인 활동의 형태로 하나의 출력을 제공 역할을합니다. 최신 CIS 규제 포유류의 대부분의 연구 4-5 CRES의 확장기 기능을 시금의 수단으로 마우스 transgenesis에 의존합니다. 이 기술은 주로 비 양적, 삽입 사이트 효과를 계정에 시간이 걸리는 비용과입니다. 한편, 포유 동물 CRE 기능에 대한 정량 assays는 조직 문화 시스템 (예를 들어, 듀얼 루시페라제 assays)에서 개발하지만, 이러한 결과의 생체내 관련성에서 종종 확실치되었습니다.
Electroporation은 포유류의 조직 생활에서 CIS - 규제 활동 spatiotemporal와 양적 평가 모두를 허용한다는 점에서 전통적인 마우스 transgenesis에 훌륭한 대안을 제공합니다. 이 기술은 특히 대뇌 피질과 망막 6-8에서, 중추 신경 시스템에서 CIS 규제의 분석에 특히 유용했습니다. 생체내 및 전직 생체내 마우스 모두에서 망막 electroporation은, 개발 광범위하게 쓰다 및 Cepko 6-7,9에 의해 설명하고있는 동안, 우리는 최근 electroporated 마우스 망막 10 photoreceptor 특정 CRES의 활동을 계량하는 간단한 방법을 개발했습니다. electroporation에 의해 망막에 도입 DNA의 양이 실험에서 실험에 따라 다를 수 있습니다 감안할 때, 그것은 모든 실험에서 공동 electroporated '로딩 제어'를 포함하는 것이 필요합니다. 이러한 측면에서 기술 교양 세포에서 발기인 활동을 계량하는 데 사용되는 듀얼 루시페라제 분석과 매우 비슷합니다.
photoreceptor CIS - 규제 활동을 시금 때, electroporation은 일반적으로 최고 막대 생산 11-12의 시간 신생아 생쥐 (출생 후의 일 0, P0)에서 수행됩니다. 일단 망막 세포 유형 사후 mitotic되고, electroporation들은 훨씬 더 효율적입니다. 신생아 마우스 및 막대는 성인 마우스 망막에있는 세포의 이상이 70 %를 구성한다는 사실에 막대의 출생의 높은 비율을 감안할 때, P0에서 electroporated 아르 세포의 대부분은 막대합니다. 이러한 이유로, 막대의 photoreceptors은 electroporation을 통해 공부하는 가장 쉬운 망막 세포 유형입니다. 우리가 여기서 설명하는 기술은 photoreceptor 크르의 활동을 quantifying 주로 유용합니다.
프로토콜
1. electroporation 챔버의 건설
- 3.2mm 간격 (하버드 장치 # 45-0105) (그림 2A)와 microslide, BTX 모델 453을 주문. 금속 레일이 완전히 슬라이드의 하단에 날인하여야한다.
- 플라스틱 microcentrifuge 튜브 대뿐이야 핸들을 잘라 Dremel 도구를 사용하십시오. 길이 0.8cm, 높이 0.6cm, 폭 0.3cm (그림 2B) : 각 다음과 같은 크기 5 작은 직사각형 조각으로 손잡이를 잘라요. 이 플라스틱 조각 microslide 챔버에서 개별 우물을 금형하는 데 사용됩니다 재사용 스페이서입니다.
- 도 간격으로 microslide의 금속 레일 사이의 플라스틱 스페이서를 삽입합니다. 스페이서는 (그림 2C) snugly 적합해야합니다.
- P200 피펫 팁 해제 팁을 잘라 3ml 주사기로 팁을 적합하고, 100 % 실리콘 고무 수족관 밀봉제와 주사기를 입력합니다. 밀봉 재와 플라스틱 스페이서 사이의 간격을 입력합니다. 최대 그래서 더 거품이 밀봉 플러그와 microslide의 기지 사이에 양식을하지 않는 바닥에서 격차를 작성해야합니다.
- 스페이서는 장소에서 개최하므로, 플라스틱 스페이서 위에 금속 막대를 삽입하고 바인더 클립으로 고정하는 동안 밀봉 재의 증발 (그림 2D - E). 밀봉이 밤새 건조하자.
- 바인더 클립, 금속 막대, 플라스틱 스페이서를 (그림 2 층)를 제거합니다. 금속 레일의 상단에서 밀봉을 청소하는 메스 칼날을 사용합니다. microslide을 검토하고 더 거품이 실리콘 댐을의 하단에 존재하지 않도록 해부 현미경을 사용합니다. 베어 메탈이 우물 안으로 노출되는 등 우물에 형성 수있는 밀봉 필름을 제거합니다. 물로 잘 하나를 기입하고 물이 잘 인접 (S)에 누설하지 않은지 확인하십시오. 모든 웰스에 대해 반복합니다.
- 완료 microslide은 접시의 측면에있는 창 (그림 2G)에 인접한 금속 기둥과 함께 플라스틱 접시에 맞는, 전극은 결국 금속 기둥에 연결된 것입니다.
2. DNA 준비
- 얼음 1.5mL microcentrifuge 관에 플라스미드 DNA을 추가하고 증류수와 150μl로 볼륨을 가져와. 여러 플라스미드 종 공동 electroporation (예를 들어, 실험 DsRed 구축과 제어 구조 GFP)을 결합 수 있습니다. , 튜브에 추가 유전자 나누어지는의 최종 볼륨이 60μl 것임을 염두에두고 있어야 DNA의 양을 계산할 때. 일반적으로, 각 구조는 0.5μg/μl의 최종 농도에 사용됩니다.
- 15μl 3M의 아세트산 나트륨 (산도 5.2)와 450μl 100 % 에탄올을 추가하여 DNA를 침전. 섞어 여러 번 반전이나 튜브를 누릅니다.
- 4 DNA를 스핀 다운 ° C, 30 분 동안 13,200 RPM. 70 % 에탄올로 펠렛을 씻어 후 4 다시 스핀 다운 ° C, 15 분 동안 13,200 RPM. 에어 건조 펠렛은 반 반투명까지, 7 분 후, 54μl 멸균 물 속에 resuspend. 6μl 무균 10X PBS (산도 7.4)과 혼합을 추가합니다.
3. 아이 컬렉션
- electroporation 챔버 및 70 % 에탄올로 모든 악기를 소독. 눈 수집 및 해부는 조직 문화 후드에서 수행 필요가 없다지만, 장갑 및 에탄올과 절차를 통해 멸균 상태를 유지하기 위해 시도와 benchtop을 소독.
- 이 35mm 요리 3ml 매체를 한 각 : 해부 매체 (F12, 100U/ml 페니실린, 100μg/ml 스트렙토 마이신, L - 글루타민 0.29mg/ml 및 5μg/ml 인슐린 1시 1분 DMEM의 비율)의 페트리 접시를 준비 6ml 매체와 60mm 요리. 이 단계는 조직 문화 후드에서 수행되어야합니다.
- 신생아의 머리와 목은 (출생 후의 일 0) 70 % 에탄올로 새끼 마우스를 소독. 신속하게 가위로 목을 베다와 살균 100mm 접시에 머리를 전송합니다.
- 눈을 노출 작은 가위로 두피를 버려야. 부드럽게 궤도 밖으로 눈을 치우도록 곡선 집게를 사용하여 절개 매체를 포함 35mm 접시에 눈을 장소. 그것은 저전력에 해부 현미경으로 눈을 제거하는 도움이 될 수 있습니다.
- 모든 눈이 수집 때까지 단계 3.3 및 3.4를 반복합니다. 해부 동안 상온에서 해부 매체에 눈을 보관하십시오. 당신은 DNA를 나누어지는 당 3-4 눈을 필요합니다.
4. 망막 해부
- 면도날과 멸균 플라스틱 전송 피펫의 래퍼를 모두 소독 70 %의 에탄올을 사용합니다. 그것이 전체 안구를 빨아 수 있도록 칼날과 피펫에서 팁을 잘라요. 사용하지 않을 때는 플라스틱 래퍼에 피펫을 저장합니다.
- 35mm 접시에서 60mm 접시 한 눈을 전송합니다. 높은 전력에서 해부 현미경, 눈 표면에서 같은 extraocular 근육과 지방 같은, 어떤 조직을 제거하는 미세 집게를 사용합니다. 그런 다음, 기본에서 벗어 곤란하여 시신경을 제거합니다.
- 망막을 분리하기 위해 작은 구멍을 찌를 Ilimbus에서 공막엔를 N. 구멍 (망막 표면에 접선)에 포셉의 두 쌍 한 단자를 넣고 부드럽게 공막엔 / RPE를 열고 눈물. 흰둥이 생쥐에서 공막엔 및 RPE는 균일한 무광택 회색되는 망막 조직에 반짝 상대를 나타납니다. 색소 생쥐에서 RPE는 검은색이다. 장소에 렌즈를 남겨주세요.
- 매체와 다른 35mm 접시에 해부 망막를 이동하는 전송 피펫을 사용합니다.
- 모든 눈 해부 때까지 4.4 단계 4.2 반복합니다.
- 당신이 electroporate 준비가 될 때까지 37 ° C 조직 문화 인큐베이터에서 망막을 저장합니다.
5. electroporation 준비
- 매체의 35mm 요리를 준비합니다. electroporated하는 각 DNA의 나누어지는 경우, 당신은 절개 매체 중 하나 요리와 문화 매체 중 하나를 접시 (해부 매체 플러스 10% FBS)이 필요합니다. 적절하게 요리를 라벨.
- electroporation 요리에 실을 씻어 P200 피펫 및 살균 1X PBS를 사용합니다. 각 챔버는 60 - 100μl의 볼륨을 보유하고 있습니다. 각 챔버 세 번을 씻으십시오.
- DNA의 aliquots로 방을 채우십시오. 사용하지 않은 여왕님 60μl 1X PBS로 가득해야합니다. electroporation 요리에 전극을 연결합니다.
- electroporator에 다음과 같은 설정을 사용하여 모드, LV, 전압, 30V, 펄스의 길이, 50 밀리초, 펄스, 5 숫자, 간격, 950 밀리초, 극성, unipolar.
6. Electroporation
- 렌즈로 망막을 파악하고 electroporation의 실에 그들을 전송하는 미세 집게를 사용하십시오. 각 챔버 3-4 마우스 망막 (그림 3) 최대 보유하고 있습니다.
- 렌즈가 긍정적인 전극에 연결된 금속 막대에 대한 포수 이러한 망막을 라인 집게를 사용하십시오. 다음 한 챔버에서 DNA의 - 이월되지 않도록 각 전송 후에 Kimwipe와 포셉를 청소합니다.
- 모든 망막이 정렬되면 electroporator에서 "시작"을 누르십시오. 작은 거품은 음극에 연결된 금속 막대에 양식한다.
- 전극을 분리하고 electroporator을 해제합니다.
- 부드럽게 멀리 챔버 벽의 망막으로 이동 집게를 사용하십시오.
- 해부 매체를 포함하는 35mm 요리에 실에서 망막을 전송하기 위해 멸균 전송 피펫을 사용합니다.
- 각 챔버에게 무균 1X PBS로 세 번 씻어 후 물로 씻어 살균. 70 % 에탄올로 스프레이 요리.
7. 문화 필터 망막 배치
- 문화 매체를 포함하는 35mm 요리에 망막를 전송하는 전송 피펫을 사용합니다.
- 멸균 6 웰 문화 판의 우물을 라벨 및 3ml 문화 매체 각 우물을 입력합니다.
- 각 우물에 매체 위에 모아 왓먼 Nuclepore 필터, 반짝 측면을, 장소에 살균 집게를 사용하십시오.
- 해부 현미경, 필터, 렌즈 쪽 다운에 망막을 전송하는 살균 전송 피펫을 사용합니다. 망막 랜드 렌즈 쪽 접속은 피펫 다시 배치하려고 그것을 가지러 경우. 하나의 필터에 4 개 이상의 망막을 배치하고, 각각의 망막을 둘러싼 매체의 방울이 다른 방울와는 별도로 남아 있는지 확인하지 마십시오. 다른 프로토콜은 이전 단계 9 렌즈의 제거를위한 전화 있지만, 그대로 렌즈를 가진 우리 문화 망막을 확인합니다.
- 37 문화 접시를 놓습니다 ° C 조직 문화 인큐베이터 (5 % CO 2)와 시간을 원하는 금액 일반적으로 8 일간 성장. 매체의 변화가 더 이상 문화의 기간에 필요한 수 있지만 우리의 경험에서 매체를 변경하면, 8 일 문화 기간 동안 필요가 없습니다.
8. 형광 망막 explants 수확하고 flatmounting
- 4 % paraformaldehyde / PBS 1X 각 우물에 문화 매체를 교체합니다. 망막이 필터에 붙어 남아있는 경우, 필터를 해제 망막 껍질 부드럽게 이상의 필터를 돌려 집게를 사용합니다. 30 분 paraformaldehyde에 품어. 상온에서. 형광을 표백하지 않도록 빛으로부터 망막을 보호할 수 있습니다.
- 1X PBS에서 10 분 동안 두 번 망막을 씻어.
- PBS의 작은 방울의 유리 슬라이드에 망막을 전송하기 위해 일회용 피펫을 사용합니다. 그들이 electroporated 측 접속되도록 형광등 해부 현미경으로, (즉, 렌즈 쪽 다운) 망막를 돌려 집게를 사용합니다.
- 슬라이드의 모서리에 짓눌린 coverslips (직경 1-2밀리미터에 대한 유리 파편)에서 만든 플레이스 유리 "피트";이 피트는 망막의 평평화 방지합니다. 그것은 피트의 망막과 달려을 커버 있도록 슬라이드를 통해 손상 유리 coverslip를 놓습니다. 필요한 경우, 슬라이드 및 coverslip 사이에 더 많은 PBS를 추가하는 피펫을 사용합니다.
9. 이미징 및 flatmount에 형광의 양을 정함
- 를 사용하여형광 화합물 현미경 이미지 빨간색과 녹색 채널에 저전력 (4X 목적)에서 flatmounted 망막를 흑백 카메라가 장착되어. 모든 망막은 형광 농도의 비교를 활성화하기 위해 특정 형광 채널에 대해 동일한 노출 시간과 몇 군데해야합니다. 픽셀 어떤 이미지에 포화되지 않은, 또는 다른 정확한 부량 불가능한 것임을 확인하십시오. 수출 이미지 TIFF 형식을 그레이 스케일.
- ImageJ 소프트웨어 (한 망막 (즉 .., 빨강 채널과 녹색 채널)에 대해 설정한 이미지 열기 http://rsbweb.nih.gov/ij/을 ). 이 튜토리얼을 위해서, 더 그린 형광 채널 (GFP 단백질)은 실험의 모든 망막에 걸쳐 지속되는 제어 구조입니다. 붉은 형광 채널 (DsRed 단백질)은 망막의 각 집합에 대한 차이가 실험 구조입니다. 이미지가 회색 조로한다.
- ImageJ에서 컨트롤 녹색 이미지를 선택하고 직경 100 단위 (분석 / 도구 / 투자 수익 (ROI) 관리자 / 더 / 지정)와 관심의 원을 지정합니다. 총 여덟 동그라미를 만드는이 서클 (ROI 관리자 추가 /) 중복. 망막과 렌즈 (그림 4A)를 overlying 영역의 바깥 가장자리를 피하고, 균일 electroporated 다섯 지역을 선택 원을 1-5로 이동합니다. 또한, 망막 / 배경 형광을 측정하는 렌즈 이외의 세 영역 (원 6-8)를 선택합니다. 붉은 이미지를 선택하고, 투자 수익 (ROI) 관리자 상자에서 '모두보기'다시 확인 확인란의 선택을 취소하십시오. 몽땅 동그라미가 붉은 이미지에 나타납니다. 데 - 모두 선택 원은 투자 수익 (ROI) 관리자에서 좌표.
- 1-5은 붉은 망막 측정하고 6-8는 붉은 배경 측정 위치를 측정 1-8이 나타납니다; 붉은 이미지가 선택된 상태에서 (ROI 관리자 / 측정)는 관심의 원에 대한 의미 픽셀 값을 기록합니다. 녹색 이미지를 선택하고 의미 픽셀 값을 기록, 9-13은 녹색 망막 측정하고 14-16은 녹색 배경 측정 위치를 측정 9-16이 나타납니다. 분석을 위해 Excel로 측정 데이터 (그림 5) 복사합니다.
- 평균 붉은 모두에서 세 가지 배경 측정 및 녹색 채널. 붉은 채널에서 5 망막 측정 각에서 빨간색 배경 평균을 제거, 녹색 채널에 대해 반복합니다. 각 망막 지역의 - 관심을 가져 주셔서, 제어 그린 레벨 (그림 5)에 대한 실험 빨간 수준을 정상화하기 위해 배경 - 빼서 녹색 측정하여 배경 - 빼서 빨간색 측정을 나눕니다.
- 주어진 DsRed 구성 (예, 망막 시간 3 별도의 망막 당 5 측정)에 대한 모든 표준 측정의 평균 및 표준 편차를 결정합니다. 양적 다른 요일에 실시 electroporations의 결과를 비교하기 위해, 항상 각 electroporation 세트의 "표준"DsRed / GFP의 석출을 포함합니다. 실험을 통해 상대 표현식 값이의 표현 수준으로 정규화하여 비교할 수 있습니다 "표준."
10. 대표 결과 :
망막 표면의 1 / 3 4분의 1 전체 DNA 구조 (S) (그림 4A)의 표현에 좋은 electroporation 결과입니다. 특히 막대의 photoreceptors가 효율적으로 transduced 때문에,이 기법은 photoreceptor 특정 발기인 활동 (그림 4B)을 quantifying에 이상적입니다. 우리는 이전에 막대 특정 Rho 및 Gnat1 loci 10 발기인 변종의 범위를 정할이 방법을 사용합니다. 우리는 거의 300 배 범위에서 발기인 활동을 계량하는 것이 가능되고있는 것으로 나타났습니다.
그림 5는 단일 electroporated 망막에서 샘플 데이터 세트입니다. 이 특정 예제에서, 실험 구성 pNrl (1.1kb) DsRed은 적색 채널에서 측정되었으며 제어 구성 pNrl (3.2kb) GFP는 녹색 채널에 측정되었다. pNrl을위한 완벽한 세트 (1.1kb) DsRed 구축이 방법으로 측정된 6-9 망막으로 이루어져 것이며, 표준 편차는 모두 값 "GFP로 정규화 DsRed"에 따라 계산됩니다. 우리가 pNrl의 표현 수준 (1.1kb) DsRed로 비교면, 예를 들어, pNrl은 (0.8kb) DsRed 다음 두 구조는 동일한 GFP 컨트롤 (예 : pNrl (3.2kb)를 electroporated해야거야 - 동일한 노출 시간에 GFP)와 몇 군데. 그것은 표준 DsRed / GFP의 electroporation은 (예를 들어, pNrl (3.2kb) dsRed + pNrl (3.2kb) GFP) 매일 수행되는 경우에는 다른 요일에 수집된 데이터를 풀 수 있습니다. 각각의 실험 구성은 표준 DsRed 수준은 이후 "표준"(pNrl (3.2kb) dsRed)의 표준 DsRed 수준으로 정상화 것입니다.
우리가 여기서 설명하는 기술은 photoreceptor 크르 10,13의 활동을 quantifying 주로 유용합니다.셀 타입의 특정 CIS - 규제 활동 또한 양극성 세포 14로 rarer 망막 세포 유형 논리적으로 양이지만, 이것은 일반적으로 계량하는 관심의 영역이 아니라 flatmount 준비보다 수직 교차 섹션에 선택할 수 있어야합니다. 동일은 photoreceptors 및 바이폴라 세포와 같은 여러 세포 유형의 표현을 드라이브 CRES의 사실이다. 실험 절차는 별도로 비슷합니다.
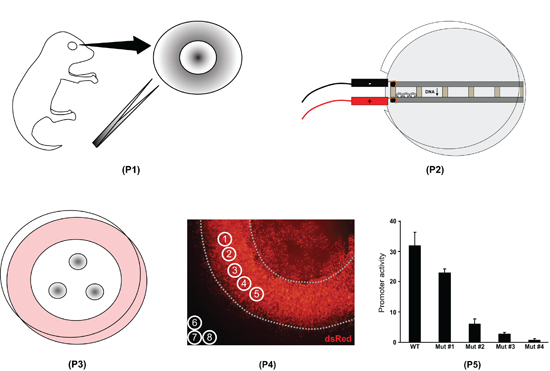
그림 1. 망막 explant의 electroporation 절차의 개요. 첫째, 전체 눈이 출생 후의 일 영 마우스 새끼으로부터 격리되며 망막은 (P1)를 해부하고 있습니다. 둘째, 망막은 DNA와 electroporated (P2)로 가득한 챔버에 배치됩니다. 셋째, 망막은 필터에 위치 8 일 (P3)에 대한 양식입니다. 넷째, 망막 explants는 고정 슬라이드에 장착하고, 몇 군데 있습니다. 형광 강도는 ImageJ 소프트웨어 (P4)로 측정됩니다. 다섯째, ImageJ 데이터는 다양한 발기인 (P5)의 활동에 차이를 수치 스프레드 시트 프로그램에서 처리됩니다.

그림 2. electroporation 요리의 건설. 하버드 장치, BTX 모델 453 (카탈로그 # 45-0105)에서 A) 수정되지 않은 microslide 챔버. B) Dremel 도구는 플라스틱 튜브 대뿐이야 핸들을 절단하는 데 사용됩니다. 길이 0.8cm, 높이 0.6cm, 폭 0.3cm : 처리는 다음과 같은 크기로 직사각형 스페이서로 절단됩니다. C) 플라스틱 스페이서는 동일한 간격으로 microslide 챔버에 장착되어 있습니다. 수족관 밀봉제은 스페이서 (표시되지 않음) 사이의 간격으로 주입됩니다. D) 금속 막대는 스페이서를 통해 배치됩니다. E) 바 및 스페이서는 밤새 밀봉 재의 증발과 같은 장소에 모든 잡아 바인더 클립으로 슬라이드에 고정되어 있습니다. F) 스페이서를 제거하고 우물들은 방수되는 것을 보장하기 위해 테스트합니다. G) 완료 슬라이드 접시의 측면에있는 윈도우에 인접한 금속 막대와 플라스틱 그릇에 맞는.

그림 3. 망막과 electroporation 요리의 다이어그램. 여왕님 DNA 솔루션 (한 번에 최대 다섯 가지 솔루션)으로 채워지게된다. 서너 망막은 다섯 실 각 맞습니다, 망막은 렌즈가 긍정적인 전극에 연결된 금속 막대 기대어되도록 실과 지향에 배치됩니다. 전류는 부정 - 충전 DNA 분자는 망막 세포로 이동하게됩니다.

flatmount에서 망막 형광 수준의 그림 4.) ImageJ 측정. 이러한 이미지는 설명의 목적으로만 색깔 것으로주의, DsRed (실험)과 GFP (제어) 채널 ImageJ 소프트웨어에서 열립니다에서 flatmount 이미지를 그레이 스케일. 다섯 측정 동아리 (1부터 5) 가장자리와 렌즈 (점선)을 피하고, 균일 electroporated 지역 이상 배치됩니다. 쓰리 측정 동아리는 (8 6) 배경 형광 수준을 결정하기 위해 망막 바깥쪽에 삽입됩니다. 높은 전력 electroporated 망막 explant의 B) 크로스 - 단면 이미지. explant 4에서 하룻밤 30% sucrose/1X PBS에 cryoprotected 출생 후의 일 8 ° C, 10 월에 포함된에서 고정하고, 12μm에서 cryo - sectioned되었습니다. 형광 구조 pNrl (1.1kb) DsRed와 pNrl (3.2kb) GFP는 바깥 핵 층 (ONL)에 photoreceptor 세포에 표현됩니다. INL, 내부 핵 계층, GCL, 신경절 세포 층.

그림 5. Excel을 사용하여 형광 데이터의 처리. 1 단계에서 각 측정 원형에 대한 의미 픽셀 값을 스프레드 시트 (셀 B3 - B12, F3 - F5, H3 - H5)에 복사됩니다. 측정 # 1-5 DsRed 망막 가치이며, # 6-8는 DsRed 배경 값이되며 측정 # 9-13는 GFP 망막 가치이며, # 14-16은 GFP 배경 값입니다. 측정 # 1과 # 9 등등 측정 # 2와 # 10처럼 같은 측정 원형에 해당하고 있습니다. 2 단계에서 DsRed와 GFP 채널에 대한 평균 배경 값 (셀 F6, H6) 계산됩니다. 3 단계에서 평균 배경 망막 모든 측정에서 빼서됩니다 (셀 C3 - C12). 4 단계에서 각 DsRed 측정이 해당 GFP 측정 (셀 D3 - D7)로 정규화됩니다 배경 - 빼서.
토론
Explant의 electroporation은 개발 마우스 망막에서 CIS - 규제 활동을 quantifying의 간단한 수단입니다. 마우스 transgenesis 통해 CIS - 규제 분석에 비해, electroporation은 신생아 마우스 새끼, DNA, 해부 악기, 그리고 electroporation / 조직 문화 장비를 필요로하는 많은 저렴합니다. 그것은 훨씬 적은 시간 또한 많이 소요 : 한 실험 영상 및 데이터 분석을위한 실험의 끝에 유일한 준비 시간이 몇 시간에 대한 팔일의 문화 시대, 그리고 몇 시간이 필요합니다. 실제 망막 조직이 활용되기 때문에 Explant의 electroporation은 또한 세포 문화 기반 CIS - 규제 분석 우수합니다. 망막은 explant에서 매우 일반적으로 개발 문화는 photoreceptors은 외부 세그먼트를 정교하지 있지만, 세 개의 서로 다른 세포 레이어를 (외부 핵 계층 내부 핵 층과 신경절 세포 층) 양식.
추가 장점은 explant의 electroporation 높은 재현성입니다. 심지어 다른 일에 다른 망막에 electroporated 동일한 구조, 동일한 상대 표현 수준에서 일반적으로 발생합니다. 또한, electroporated plasmids이 핵에 episomally 유지 생각하고 염색체에 포함되지 않습니다 때문에, 그들은 유전자 변형 생쥐에서 수행 CIS - 규제 분석을 현혹하는 동일한 통합 사이트 효과를 적용하지 않습니다.
Explant의 electroporation 몇 가지 제한이 없습니다. 첫째, 세포주기에 여전히에만 세포가 효율적으로 electroporation 15 일까지 transduced 수 있습니다. P0에서 막대 및 기타 나중에 태어난 망막 세포 유형 (바이폴라 세포, amacrine 세포, M ller의 glia)이 방법에 의해 대상의 주요 세포 집단입니다. P0 electroporation에 의해 원뿔 photoreceptors의 Electroporation은 16을보고하지만 효율이 낮은 것으로 나타납니다되었습니다. 두 번째 제한은 망막의 진보보기 흉한 것 2 주 결과 너머 그 explant 문화이므로 권장하지 않습니다. 제 9에서 설명한대로 발기인의 부량 늦게 timepoints에 필요한 경우 단, 생체내의 electroporation 9가 원하는 timepoint에서 망막 절개로 뒤를 수행할 수 있습니다 해부하는 망막의 평면 장착하고, 부량. 세 번째 제한은이 분석은 적당히 높은 처리량있다는 것입니다. 한 실험에 구조의 수백을 테스트할 수 세포 배양 기반 assays과는 달리,이 프로토콜에 설명된 기술은 구성 당 하나의 전체를 마우스 망막의 최소 필요합니다. 따라서, 전용 핀셋으로 구성이 합리적 하루에 electroporated 수 있습니다.
현재 접근법을 사용 발기인 활동의 부량과 관련하여 한 추가 주의해야 할 점은 매우 강력한 발기인을 시금 때 특히, GFP의 채널로 DsRed 형광의 '출혈을 통한'에 대한 가능성이있다는 것입니다. 그 이유는의 방출 스펙트럼 그 GFP의 일부 중복을 DsRed 것입니다. 이 문제를 회피하기 위해 최적화된 방출 필터는 DsRed와 GFP 사이의 스펙트럼 중복을 최소화 것을 사용해야합니다. 이러한 최적화된 필터 설정을 사용할 수없는 경우, 다른 잠재적인 솔루션은 GFP 대신 푸른 이동 형광 단백질 (예, BFP 또는 CFP)를 사용하는 것입니다.
공개
감사의 말
저자 electroporation 챔버의 섹션에 대해 설명 건설과 그녀의 도움 카렌 로렌스 감사하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | 댓글 (옵션) |
|---|---|---|---|
| Electroporation 요리, Microslide 453 | BTX 하버드 장치 | 45-0105 | 수정에 대한 프로토콜 섹션 1을 참조 |
| 100 % 실리콘 고무 수족관 시멘트 | 퍼펙토 제조 | ||
| 플라스틱 microtube 걸이 | 피셔 사이 언티픽 | 05-541 | 전용 랙 손잡이가 사용됩니다 |
| Dremel 도구 | 플라스틱 튜브 대뿐이야 핸들을 절단 | ||
| DMEM | Gibco / Invitrogen | 11,965 | |
| F12 | Gibco / Invitrogen | 11,765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | 100X 농도 |
| 인슐린 | 시그마 - 알드리치 | I - 6634 | 1000X 주식, 5mM HCL 및 필터 - 소독의 5mg/ml에 resuspend |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 스퀘어 - 웨이브 electroporator | BTX 하버드 장치 | ||
| Nuclepore 필터 | 워트 먼지 | 110606 | 25mm, 0.2μm |
| 조직 문화의 인큐베이터 | 37 ° C 5 % CO 2 | ||
| 유리 coverslips # 1.5 | 피셔 사이 언티픽 | 12 - 544E | 두께 0.16mm |
| 카메라가 장착된 형광등 복합 현미경 | 카메라 단색 (하마 마츠에 의해 예, 오르카 - ER 카메라)되어야합니다 | ||
| EGFP / 복합 현미경에 대한 DsRed 필터 세트 | 채도 기술 주식 회사 | 86,007 | 빨간색과 초록색 chanenels 사이에이 필터 세트 최소화 bleedthrough |
| ImageJ 소프트웨어 | NIH | http://rsbweb.nih.gov/ij/ |
참고문헌
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. . From DNA to diversity : molecular genetics and the evolution of animal design. , (2005).
- Davidson, E. H. . Genomic regulatory systems : development and evolution. , (2001).
- Ptashne, M., Gann, A. . Genes & signals. , (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유