Method Article
Количественная активность СНГ-Регуляторных элементов в мышь Retina от эксплантов Электропорация
В этой статье
Резюме
Этот протокол описывает простой и недорогой способ для количественной оценки активности цис-регуляторных элементов (например, усилитель / промоутеров) в живой мыши сетчатки через эксплантов электропорации. Препарата ДНК, сетчатке глаза рассечение, электропорация, сетчатки культуры эксплантов, и после фиксации анализ и количественное описаны.
Аннотация
Transcription factors within cellular gene networks control the spatiotemporal pattern and levels of expression of their target genes by binding to cis-regulatory elements (CREs), short (˜300-600 bp) stretches of genomic DNA which can lie upstream, downstream, or within the introns of the genes they control. CREs (i.e., enhancers/promoters) typically consist of multiple clustered binding sites for both transcriptional activators and repressors1-3. They serve as logical integrators of transcriptional input giving a unitary output in the form of spatiotemporally precise and quantitatively exact promoter activity. Most studies of mammalian cis-regulation to date have relied on mouse transgenesis as a means of assaying the enhancer function of CREs4-5. This technique is time-consuming, costly and, on account of insertion site effects, largely non-quantitative. On the other hand, quantitative assays for mammalian CRE function have been developed in tissue culture systems (e.g., dual luciferase assays), but the in vivo relevance of these results is often uncertain.
Electroporation offers an excellent alternative to traditional mouse transgenesis in that it permits both spatiotemporal and quantitative assessment of cis-regulatory activity in living mammalian tissue. This technique has been particularly useful in the analysis of cis-regulation in the central nervous system, especially in the cerebral cortex and the retina6-8. While mouse retinal electroporation, both in vivo and ex vivo, has been developed and extensively described by Matsuda and Cepko6-7,9, we have recently developed a simple approach to quantify the activity of photoreceptor-specific CREs in electroporated mouse retinas10. Given that the amount of DNA that is introduced into the retina by electroporation can vary from experiment to experiment, it is necessary to include a co-electroporated 'loading control' in all experiments. In this respect, the technique is very similar to the dual luciferase assay used to quantify promoter activity in cultured cells.
When assaying photoreceptor cis-regulatory activity, electroporation is usually performed in newborn mice (postnatal day 0, P0) which is the time of peak rod production11-12. Once retinal cell types become post-mitotic, electroporation is much less efficient. Given the high rate of rod birth in newborn mice and the fact that rods constitute more than 70% of the cells in the adult mouse retina, the majority of cells that are electroporated at P0 are rods. For this reason, rod photoreceptors are the easiest retinal cell type to study via electroporation. The technique we describe here is primarily useful for quantifying the activity of photoreceptor CREs.
протокол
1. Строительство электропорации камеры
- Заказать предметное стекло, BTX модель 453 с 3,2 мм зазором (Гарвардский Аппарат # 45-0105) (рис. 2А). Металла рельсов должна быть полностью запечатаны в нижней части слайда.
- Используйте инструмент Dremel, чтобы сократить ручки с пластиковой трубкой микроцентрифужных стойку. Вырезать ручку в 5 небольших прямоугольных кусков, каждый со следующими размерами: длина 0.8cm, 0.6cm высота, ширина 0.3cm (рис. 2В). Эти пластмассовые части являются многоразовыми прокладками, который будет использоваться для формования отдельных скважин в предметное стекло камеры.
- Вставьте пластиковые прокладки между металлическими рельсами предметное стекло через равные интервалы. Прокладки должны плотно прилегать (рис. 2).
- Отрежьте кончик кончика пипетки P200, установите наконечник на 3 мл шприц и заполните шприц со 100% силиконовый герметик аквариум резины. Заполните зазоры между пластиковыми прокладками с герметиком. Будьте уверены, чтобы заполнить пробелы снизу вверх так, чтобы не было пузырей форме между плагин герметика и базы предметное стекло.
- Место металлический стержень, на вершине пластиковые прокладки и закрепите его зажимы, так что прокладки удерживаются на месте в то время как герметик высохнет (рис. 2D-E). Пусть герметик высыхания на ночь.
- Удалите зажимы, металлический стержень и пластиковые прокладки (рис. 2F). Используйте лезвие скальпеля для очистки герметик с верхней части металла рельсов. Используйте рассекает микроскоп, чтобы исследовать предметное стекло и убедиться в отсутствии пузырьков присутствуют в нижней части силиконовым плотин. Удалите герметик фильм, который, возможно, сформировались в скважинах, что голый металл подвергается внутри скважины. Заполните одну скважину с водой и убедиться, что вода не просачивается в соседние скважины (с). Повторите эти действия для всех лунок.
- Закончил предметное стекло помещается в пластиковую посуду с металлом полюсов, прилегающей к окну в сторону блюдо (рис. 2G), электродов, в конечном счете быть прикреплен к металлическому полюсов.
2. Препарата ДНК
- Добавить плазмидной ДНК в 1,5 мл трубки микроцентрифужных на льду и довести объем до 150 мкл дистиллированной воды. Несколько плазмиды виды могут быть объединены для совместного электропорации (например, экспериментальные DsRed строительства и управления GFP построить). При расчете количества ДНК, чтобы добавить к трубке, имейте в виду, что окончательный объем ДНК аликвоты будет 60μl. Как правило, каждая конструкция используется в конечной концентрации 0.5μg/μl.
- Осадок ДНК, добавив 15μl натрия 3М ацетата (рН 5,2) и 450μl 100% этанола. Обратить или нажмите трубку несколько раз перемешать.
- Спином вниз ДНК при температуре 4 ° С, 13 200 оборотов в минуту, в течение 30 минут. Вымойте гранул с 70% этанолом, то спина его снова при 4 ° С, 13 200 оборотов в минуту, в течение 15 минут. Воздух сухой шарик до полупрозрачного, около 7 минут, затем ресуспендируют в 54μl стерильной водой. Добавить 6μl стерильной 10X PBS (рН 7,4) и перемешать.
3. Глаз коллекции
- Стерилизовать камеры электропорации и все документы с 70% этанола. Хотя коллекция глаз и вскрытие не обязательно должны быть выполнены в капот культуры ткани, продезинфицировать ваши перчатки и настольный этанолом и пытаться поддерживать стерильные условия на протяжении всей процедуры.
- Подготовка чашки Петри с рассечением среду (1:1 отношение DMEM: F12, 100U/ml пенициллин, стрептомицин 100μg/ml, 0.29mg/ml L-глутамин, и 5μg/ml инсулина): две 35-мм блюда каждый 3 мл среды и один 60мм блюдо с 6 мл среды. Этот шаг должен быть выполнен в капот культуры ткани.
- Лечить голову и шею новорожденного (послеродовой день 0) мыши щенка с 70% этанола. Быстро обезглавить с ножницами и передачи головы до стерильной 100мм блюдо.
- Срежьте кожу головы с маленькими ножницами, чтобы подвергать глаза. Используйте изогнутый пинцет, чтобы аккуратно совок глаза из орбит, и поместить глаз в 35-мм блюдо с рассечение среды. Это может быть полезно для удаления глаза под микроскопом при вскрытии малой мощности.
- Повторите шаги 3.3 и 3.4, пока все взоры были собраны. Держите глаза рассечение среде при комнатной температуре, в то время как рассекает. Вам понадобится 3-4 глаза на ДНК аликвоты.
4. Сетчатки рассечение
- Используйте 70% этанола для дезинфекции как лезвие бритвы и оболочку стерильные пластиковые пипетки передачи. Отрежьте кончик пипетки с лезвием, так что он может поглотить весь глаз. Магазин пипетки в пластиковой обертки, когда он не используется.
- Передача одного глаза от 35мм блюдо 60мм блюдо. Под микроскопом рассекает при высокой мощности, используйте тонкий пинцет, чтобы удалить любой ткани, такие как наружных мышц и жира, с поверхности глаза. Затем удалите зрительного нерва, зажимая ее усилием базы.
- Для того, чтобы изолировать сетчатки, тыкают небольшое отверстие ян склеры в лимба. Вставьте один контакт с обеих пар щипцов в отверстие (по касательной к поверхности сетчатки) и аккуратно разорвать склеры / НПП. В белых мышах, склер и НПП выглядеть блестящей по отношению к ткани сетчатки, которая является однородной матовой серого цвета. В пигментированные мышей, НПП черный. Оставьте линзы на месте.
- Использование передачи пипетки перенести расчлененный сетчатки в других 35мм блюдо со средой.
- Повторите шаги с 4,2 до 4,4, пока все глаза были расчленены.
- Магазин сетчатки в 37 ° C культуре ткани инкубаторе пока не будете готовы к electroporate.
5. Подготовка к электропорации
- Подготовка 35 блюд среды. Для каждого ДНК аликвоты быть электропорации, вам нужно одно блюдо вскрытия средних и одно блюдо питательной среды (среда вскрытия плюс 10% ЭТС). Этикетка блюда соответствующим образом.
- Использование P200 пипетки и стерильные 1X PBS, чтобы смыть камер в электропорации блюдо. Каждая камера имеет объем 60-100 мкл. Промыть каждую камеру в три раза.
- Заполните камеры с ДНК аликвоты. Любой неиспользованный камерах должны быть заполнены 60μl 1X PBS. Подключите электроды к электропорации блюдо.
- Используйте следующие параметры на electroporator: режим, Л. В.; напряжение, 30В; длительность импульса, 50 мс, количество импульсов, 5; интервал, 950 мс; полярности, однополярным.
6. Электропорация
- Используйте тонкий пинцет, чтобы понять сетчатки объективом и перенести их в электропорации камер. Каждая камера вмещает до 3-4 мыши сетчатки (рис. 3).
- Используйте пинцет выстроить сетчатки, что объектив опирается на металлический стержень прикреплен к положительному электроду. Чистая щипцы с Kimwipe после каждой передачи, чтобы избежать переноса ДНК из одной камеры в другую.
- После того как все сетчатки выравниваются, нажмите кнопку "Пуск" на electroporator. Маленькие пузырьки должны стать на металлический стержень прикреплен к отрицательному электроду.
- Отсоедините электроды и выключите electroporator.
- Используйте пинцет, чтобы аккуратно двигаться сетчатки от стенок камеры.
- Используйте стерильные пипетки передачи для передачи сетчатки из камер в 35 блюд, содержащих рассечение среды.
- Промыть каждую камеру в три раза стерильной 1X PBS, затем промыть стерильной водой. Спрей блюдо с 70% этанола.
7. Размещение сетчатки на фильтры для культуры
- Использование передачи пипетки для передачи сетчатки в 35 блюд, содержащих культуральной среде.
- Этикетка скважин стерильный 6-и культуру пластину и заполнить каждую лунку с 3 мл питательной среды.
- Использование стерильного пинцета поместить круглый Ватман Nuclepore фильтры, блестящей стороной вверх, поверх среды в каждую лунку.
- Под микроскопом рассекает, используйте стерильные пипетки передачи для передачи сетчатки на фильтр, объектив стороны-вниз. Если сетчатка земли объектив стороной вверх, поднимите ее с помощью пипетки и попытаться поставить его снова. Не помещайте более 4 сетчатки на одном фильтре, и убедитесь, что капельки среда, окружающая каждого сетчатки остаются отдельными от других капель. Обратите внимание, что культура сетчатки с линзой нетронутыми, хотя другие протоколы требуют удаления линзы до этого шага 9.
- Место культуры пластины в 37 ° C культуре ткани инкубатора (5% СО 2) и растут в течение необходимого количества времени, обычно за восемь дней. По нашему опыту, меняется среда является необходимым в течение восьми период культура день, хотя средний изменения могут быть необходимы для более длительных периодов культуры.
8. Заготовка и flatmounting флуоресцентные сетчатки эксплантов
- Замените культуральной среде в каждую лунку с 4% параформальдегид / 1X PBS. Если сетчатки остаются придерживался фильтров, использование щипцов, чтобы щелкнуть по фильтров и аккуратно чистить сетчатки с фильтром. Инкубируйте в параформальдегида в течение 30 мин. при комнатной температуре. Защита сетчатки от света, чтобы избежать отбеливания флуоресценции.
- Промыть сетчатки два раза по 10 минут в 1X PBS.
- Используйте одноразовые пипетки для передачи сетчатки на предметное стекло в каплю PBS. Под флуоресцентным микроскопом рассекает, использование щипцов, чтобы перевернуть сетчатки так, чтобы они электропорации стороной вверх (то есть объектив стороны-вниз).
- Место стекла "ноги" из измельченных покровные (стеклянные осколки около 1-2 мм в диаметре) в углах слайд, эти ноги предотвратить уплощение сетчатки. Место нетронутыми покровного стекла над слайд так, чтобы она покрывала сетчатки и опирается на ноги. Если необходимо, используйте пипетку, чтобы добавить больше PBS между горкой и покровное.
9. Работа с изображениями и количественная оценка флюоресценции в flatmount
- Используйтефлуоресцентный микроскоп соединения оснащен монохромным камеры изображение flatmounted сетчатки при малой мощности (4X цель) в красном и зеленом каналах. Все сетчатки должно быть, полученную с использованием то же время облучения данным флуоресцентного канала обеспечить возможность сравнения интенсивности флуоресценции. Убедитесь, что пиксели не насыщен в любое изображение, либо точную количественную будет невозможно. Экспорт изображения в оттенках серого TIFF формате.
- Откройте изображение, установленное для одного сетчатки (то есть .., красный канал и зеленый канал) в ImageJ программное обеспечение ( http://rsbweb.nih.gov/ij/ ). Ради этого урока, зеленого флуоресцентного канала (GFP белок) контроль конструкция, которая является постоянной для всех сетчатки в эксперименте. Красного флуоресцентного канала (DsRed белок) экспериментальной конструкции, которая варьируется для каждого набора сетчатки. Изображения должны быть в оттенках серого.
- В ImageJ выберите элемент управления, зеленый изображение и указать круг интересов с диаметром 100 единиц (Анализ / Инструменты / ROI менеджер / Дополнительно / Укажите). Дублируйте этот круг (ROI менеджер / Добавить), чтобы создать восемь кругов общей сложности. Перемещение кругов 1-5, чтобы выбрать пять регионов, которые равномерно электропорации, избегая внешних краях сетчатки и области вышележащих линзы (рис. 4а). Кроме того, выбор трех регионов (кружки 6-8) за пределами сетчатки / объектив для измерения фоновой флуоресценции. Выберите красный изображения, снимите флажок "Показать все" окна в ROI менеджер, и заново установите флажок. Все восемь кругов должен появиться на красной изображения. Де-выбрать все кругом координаты в менеджер ROI.
- С красным выбрано изображение, записать среднее значение пикселя для всех кругах интереса (ROI менеджер / Мера); измерения должны появиться 1-8, где 1-5 являются красный сетчатки измерений и 6-8 являются красный измерения фона. Выберите зеленый изображения и записи среднее значение пикселей; измерения 9-16 должно появиться, где 9-13 являются зеленые сетчатки измерений и 14-16 являются зеленый измерения фона. Копирование данных измерений в Excel для анализа (рис. 5).
- Средняя трех справочных измерений в обоих красный и зеленый каналы. Вычтите красный средний фон от каждого из пяти сетчатки измерений в красном канале; повторить для зеленого канала. Для каждой области сетчатки интересов, разделите фона вычитается красный измерение фона вычитается зеленый измерения для того, чтобы нормализовать экспериментальных красный уровень контроля зеленый уровень (рис. 5).
- Определить среднее значение и стандартное отклонение всех нормированных измерений для данного DsRed построить (например, 5 измерений в сетчатке раза 3 отдельных сетчатки). Для того, чтобы количественно сравнивать результаты electroporations проводятся в разные дни, всегда включают в себя "стандартный" DsRed / GFP осадков в каждом электропорации множество. Относительные значения выражения во эксперименты можно сравнить по нормализации на уровень экспрессии этого "стандарта".
10. Представитель Результаты:
Хорошие результаты электропорации в экспрессии ДНК-конструкции (ы) по 1 / 4 до 1 / 3 от поверхности сетчатки (рис. 4). Так как стержень фоторецепторов, в частности, эффективно трансдуцированных, этот метод идеально подходит для количественного фоторецепторов конкретных активности промотора (рис. 4б). Ранее мы использовали этот подход для количественного диапазона промоутер варианты из стержня конкретных Ро и Gnat1 локусов 10. Мы обнаружили, что можно количественно промоутер активности на протяжении почти 300 раз диапазоне.
На рисунке 5 приведен пример набора данных из одного электропорации сетчатки. В данном конкретном примере, экспериментальные построить pNrl (1.1kb)-DsRed измерялось в красный канал и контроль построить pNrl (3.2kb)-GFP был измерен в зеленом канале. Полный набор данных для pNrl (1.1kb)-DsRed построить будет состоять из 6-9 сетчатки измеряли в этой манере, и стандартное отклонение будет рассчитываться на основе всех "DsRed нормированная на GFP" ценностей. Если бы мы сравнивали уровень экспрессии pNrl (1.1kb)-DsRed, например, pNrl (0.8kb)-DsRed, то обе конструкции должны быть электропорации с тем же контролем GFP (например, pNrl (3.2kb) - GFP) и отображаемого в то же время экспозиции. Можно объединить данные, собранные в разные дни, если стандартные DsRed / GFP электропорации осуществляется на каждый день (например, pNrl (3.2kb)-DsRed + pNrl (3.2kb)-GFP). Для каждой экспериментальной конструкции, нормированный уровень DsRed впоследствии будет нормирована на нормированные DsRed уровня "стандарт" (pNrl (3.2kb)-DsRed).
Техника мы описываем здесь в основном используется для количественной активности фоторецепторов Црес 10,13.Камерного типа конкретных цис-регуляторных активность может также быть определена количественно в редких типов клеток сетчатки, таких как биполярные клетки 14, но это обычно требует, чтобы областях, представляющих интерес для количественных быть выбран в вертикальное сечение, а не в flatmount препаратов. То же самое верно Црес какой диск выражение в различных типах клеток, таких как фоторецепторов и биполярных клеток. Экспериментальных процедур в остальном похожи.
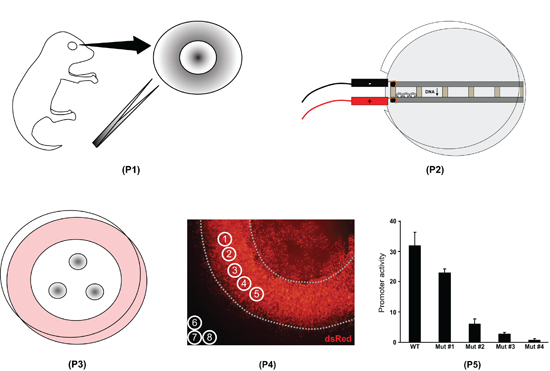
Рисунок 1. Обзор сетчатки процедура электропорации эксплантов. Во-первых, все глаза изолированы от послеродовой день 0 щенков мыши и сетчатки расчленены (Р1). Во-вторых, сетчатка помещаются в камеры, заполненные с ДНК и электропорации (P2). В-третьих, сетчатки расположены на фильтры и культивировали в течение восьми дней (Р3). В-четвертых, сетчатки эксплантов фиксированы, смонтированный на салазках, а образ. Интенсивности флуоресценции измеряется с ImageJ программное обеспечение (P4). В-пятых, ImageJ данные обрабатываются в программе электронных таблиц для количественной оценки различий в активности различных промоутеров (С-5).

Рисунок 2. Строительство электропорации блюдо. ) Немодифицированные камеры предметное стекло из Гарвардского аппарата, BTX модель 453 (каталог # 45-0105). Б) инструмент Dremel используется для резки ручки от пластиковой стойки трубы. Ручка разрезать на прямоугольные прокладки со следующими размерами: длина 0.8cm, 0.6cm высота, ширина 0.3cm. С) пластиковых прокладки вставляются в предметное стекло камеры с равными интервалами. Аквариум Герметик вводится в промежутки между прокладками (не показаны). D) металлический стержень находится над прокладками. E), бар и прокладки накладываются на слайд с зажимы провести все на месте, как герметик высыхает за одну ночь. F) распорки удаляются и скважин протестированы, чтобы гарантировать, что они являются водонепроницаемыми. G) закончил слайд вписывается в пластиковой посуды с металлическими прутьями, прилегающей к окну в сторону тарелки.

Рисунок 3. Схема электропорации блюдо с сетчатки. Камеры заполнены ДНК решений (до пяти различных решений на время). Сетчатки находятся в камерах и ориентированы так, что объектив прислонившись металлический стержень соединен с положительным электродом, три или четыре сетчатка будет вписываться в каждой из пяти камер. Электрический ток вызовет отрицательно заряженные молекулы ДНК, чтобы переехать в клетки сетчатки.

Рисунок 4.) ImageJ измерения сетчатки флуоресценция уровней в flatmount. Оттенки серого flatmount изображений в DsRed (экспериментальная) и GFP (контроль) каналов открываются в программном обеспечении ImageJ; отметить, что эти изображения были цветными только для иллюстрации. Пять измерений кругов (с 1 по 5) расположены над равномерно электропорации регионах, избегая края и объектива (пунктирные линии). Три измерения кругов (с 6 по 8) расположены за пределами сетчатки для определения фоновых уровней флуоресценции. Б) поперечного сечения изображения электропорации сетчатки эксплантов при высокой мощности. Эксплантов был установлен на уровне 8-й день послеродового, cryoprotected в 30% sucrose/1X PBS в течение ночи при 4 ° С, встроенный в октябре, и крио-секционного на 12 мкм. Флуоресцентные конструкций pNrl (1.1kb)-DsRed и pNrl (3.2kb)-GFP выражаются в клетки фоторецепторов в наружном ядерном слое (ONL). INL, внутренний ядерный слой; GCL, слой ганглиозных клеток.

Рисунок 5. Обработка данных с использованием флуоресценции Excel. В шаге 1, среднее значение пикселей для каждого измерения круг копируется в таблицу (ячейки B3, B12, F3-F5, H3-H5). Измерения # 1-5 DsRed сетчатки ценностей и # 6-8 DsRed фоновых значений; измерения # 9-13 являются GFP сетчатки ценностей и # 14-16 те ценности, GFP фоне. Обратите внимание, что измерения № 1 и № 9 соответствуют же круг измерений, как это делают измерения № 2 и № 10, и так далее. В шаге 2, среднее значение фона для DsRed и GFP каналов рассчитывается (ячеек F6, Н6). На шаге 3, средний фон вычитается из каждого измерения сетчатки (клеток С3-С12). В шаге 4, каждый фона вычитается DsRed измерений нормирована на соответствующее измерение GFP (ячеек D3-D7).
Обсуждение
Эксплантов электропорации это простое средство количественной цис-регуляторных активности в развивающихся мыши сетчатки. По сравнению с цис-регуляторных анализа с помощью мыши трансгенез, электропорации намного дешевле, требуя только новорожденные мыши щенков, ДНК, рассекающих инструментов и электропорации / оборудование тканевой культуры. Это также намного меньше времени: один эксперимент требует всего несколько часов на подготовку, культуру течение примерно восьми дней, и через несколько часов в конце эксперимента по визуализации и анализа данных. Эксплантов электропорации также превосходит культуре клеток основе цис-регуляторных анализа, так как фактические ткани сетчатки используется. Сетчатка развивается вполне нормально в эксплантов культуры она образует три различных клеточных слоев (наружный ядерный слой, внутренний ядерный слой, и слой ганглиозных клеток), хотя фоторецепторы не в состоянии разработки наружных сегментах.
Еще одним преимуществом является то, что эксплантов электропорации очень воспроизводимые. Же конструкции электропорации в различные сетчатки, даже в разные дни, как правило, приводит к тому же относительные уровни выражения. Кроме того, поскольку электропорации плазмид, как считается, поддерживаются episomally в ядре и не включены в хромосомы, они, кажется, не подлежат же интеграция сайта эффектов, захлестнувшие цис-регуляторных анализ, проведенный в трансгенных мышей.
Эксплантов электропорации имеет несколько ограничений. Во-первых, только клетки, которые все еще находятся в клеточном цикле может быть эффективно трансдуцированных электропорацией 15. При Р0, прутки и другие, более поздние происхождения типов клеток сетчатки (биполярные клетки, клетки amacrine, М Мюллер глии) являются основными клеточных популяций целевых этим методом. Электропорация конуса фоторецепторов через P0 электропорации сообщалось 16, но эффективность оказывается низким. Вторым ограничением является то, что эксплантов культуры за две недели приводит к прогрессивной порок развития сетчатки, и поэтому не рекомендуется. Если промоутер количественного требуется в конце timepoints, однако, в естественных условиях электропорации 9 может быть выполнена, после вскрытия сетчатки в нужное timepoint, телевизор с плоским монтаж расчлененный сетчатки, и количественное, как описано в разделе 9. Третье ограничение, что этот анализ является лишь умеренно высокой пропускной способностью. В отличие от культуры клеток основе анализов, которые могут проверить сотни конструкций в одном эксперименте, техника, описанная в данном протоколе требует как минимум одного целого сетчатке мышей в конструкцию. Таким образом, только пару десятков конструкций может быть разумно электропорации в день.
Еще один нюанс в отношении количественного промоутер деятельности с использованием данного подхода является то, что есть потенциал для 'проступание' из DsRed флуоресценцию в канал GFP, в частности, когда опробование очень сильные промоутеры. Причиной этого является то, что спектр излучения DsRed частично перекрывается у GFP. Чтобы обойти эту проблему, оптимизированные фильтры выбросов должны быть использованы, которые минимизируют спектрального перекрытия между DsRed и GFP. Когда такие оптимизированные наборы фильтров нет, еще одним потенциальным решением было бы использовать сине-смещается флуоресцентный белок (например, БПС или CFP) вместо GFP.
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить Карен Лоуренс за помощь в раздел, описывающий строительство электропорации камеры.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Комментарии (необязательно) |
|---|---|---|---|
| Электропорация блюдо, предметное стекло 453 | BTX Гарвардского аппарата | 45-0105 | См. раздел 1 протокола о внесении изменений |
| 100% силиконовый каучук аквариуме цемента | Производство Perfecto | ||
| Пластиковые стойки микропробирок | Fisher Scientific | 05-541 | Только стойку дескриптор будет использоваться |
| Dremel инструмент | Для резки ручка с пластиковой стойке трубки | ||
| DMEM | Gibco / Invitrogen | 11965 | |
| F12 | Gibco / Invitrogen | 11765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | 100X концентрации |
| Инсулин | Sigma-Aldrich | I-6634 | Для 1000X акций, ресуспендируют в 5mg/ml в 5 мМ HCl и фильтр-стерилизовать |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 Прямоугольные electroporator | BTX Гарвардского аппарата | ||
| Nuclepore фильтры | Ватман | 110606 | 25 мм, 0,2 мкм |
| Культуры ткани инкубатор | 37 ° C, 5% СО 2 | ||
| Стекла покровные № 1.5 | Fisher Scientific | 12-544E | 0,16 мм толстых |
| Флуоресцентный микроскоп соединения оснащен камерой | Камера должна быть монохроматическим (например, ORCA-ER камеру, Хамамацу) | ||
| EGFP / DsRed набор фильтров для соединения микроскоп | Chroma технологий корпорации | 86007 | Это набор фильтров минимизирует bleedthrough между красным и зеленым chanenels |
| ImageJ Software | NIH | http://rsbweb.nih.gov/ij/ |
Ссылки
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. . From DNA to diversity : molecular genetics and the evolution of animal design. , (2005).
- Davidson, E. H. . Genomic regulatory systems : development and evolution. , (2001).
- Ptashne, M., Gann, A. . Genes & signals. , (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены