Method Article
の活動の定量化シス調節エレメント
要約
このプロトコルは、外植片のエレクトロポレーションを使用してマウスの網膜を生体内でのシス調節エレメント(例えば、エンハンサー/プロモーター)の活性を定量化するための簡単で安価な方法を説明します。 DNA調製、網膜切開、エレクトロポレーション、網膜移植片培養、およびポスト固定分析と定量化が説明されています。
要約
短い細胞遺伝子ネットワーク内の転写因子のシス調節エレメント(CRES)に結合することにより、その標的遺伝子の発現の時空間パターンとレベルを制御する、(〜300〜600 bp)は下流、または内で、上流に位置することができるゲノムDNAの伸び彼らが制御する遺伝子のイントロン。クレス( すなわち 、エンハンサー/プロモーターは)一般的に1から3の転写活性化因子およびリプレッサーの両方のクラスタ化された複数の結合部位で構成されています。彼らは、時空間に、正確で定量的に正確なプロモーター活性の形で単一出力を与える転写入力の論理的な積分器として機能する。これまでのシス調節哺乳類のほとんどの研究は4-5 CRESのエンハンサー機能をアッセイするための手段として、マウスの遺伝子導入に頼ってきた。この手法は、時間のかかるコストと、挿入部位の効果のアカウントで、大半は非定量的である。一方、哺乳類のCREの機能の定量的アッセイは、組織培養系( 例えば 、デュアルルシフェラーゼアッセイ)で開発されているが、これらの結果の生体適合性でしばしば不明である。
エレクトロポレーションは、哺乳類の生体組織におけるシス調節活性の時空間と定量的に評価の両方を可能にするという点で従来のマウスの遺伝子導入に優れた代替手段を提供しています。この手法は、特に大脳皮質や網膜6-8に、中枢神経系におけるシス調節の解析に特に役立っています。 in vivoおよびex vivoの両方でマウス網膜エレクトロは、開発し、広範囲に松田とCepko 6-7,9で説明してきたが、我々は最近、エレクトロポレーション、マウスの網膜10に光受容体特異的なCRESの活性を定量化するシンプルなアプローチを開発しました。エレクトロポレーションによって網膜に導入されるDNA量は実験から実験に変えることができることを考えると、それは全ての実験において共同エレクトロポレーション"ローディングコントロール"を含める必要があります。この点で、手法は、培養細胞でのプロモーター活性を定量化するために使用するデュアルルシフェラーゼアッセイに非常によく似ています。
光受容体のシス調節活性を測定するときに、エレクトロポレーションは、通常、ピークロッドの製作11月12日の時間である新生マウス(生後0日、P0)で実行されます。一度網膜細胞の種類は、有糸分裂後になって、エレクトロポレーションは、あまり効率的です。新生児マウスのロッドの出生率の高さとロッドは成体マウスの網膜では細胞の70%以上を占めているという事実を考えると、P0でエレクトロポレーションされている細胞の大部分はロッドです。このような理由から、桿体は、エレクトロポレーションを経由して勉強する最も簡単な網膜細胞のタイプです。我々はここで説明するテクニックは、感光体のCRESの活性を定量化するために主に有用です。
プロトコル
1。エレクトロポレーションチャンバーの建設
- 3.2ミリメートルのギャップ(ハーバード大学の装置#45〜0105)( 図2A)とmicroslide、BTXモデル453を注文。金属製のレールが完全にスライドの一番下に密封する必要があります。
- プラスチック製のマイクロチューブのラックからハンドルをカットするドレメルツールを使用してください。長さの0.8センチメートル、高さ0.6センチメートル、幅0.3センチメートル( 図2B):それぞれ以下の寸法で5小さな長方形の部分にハンドルを切る。これらのプラスチック部分はmicroslideチャンバ内で個々のウェルを成形するために使用される再利用可能なスペーサーです。
- 等間隔にmicroslideの金属のレールの間にプラスチック製のスペーサーを挿入します。スペーサーは、( 図2C)ぴったりと収まる必要があります。
- P200のピペットチップオフ先端をカット、3ミリリットル注射器に先端を合わせ、そして100%のシリコーンゴムの水族館シーラントなどで注射器を埋める。シーリング材とプラスチック製のスペーサーとの間のギャップを埋める。上ので気泡がシーラントプラグとmicroslideのベースとの間に形成しないことを底からのギャップを埋めるようにしてください。
- スペーサを所定の位置に保持されるように、プラスチック製のスペーサーの上に金属の棒を置き、バインダークリップで固定ながらシーラントが乾燥する( 図2D - E)。シーラントは、一晩乾かします。
- バインダークリップ、金属製の棒、およびプラスチック製スペーサを( 図2F)を取り外します。金属製のレールの上からシール剤をきれいにする外科用メスの刃を使用してください。 microslideを調べ、気泡がシリコンダムの下部に存在しないことを保証するために解剖顕微鏡を使用してください。地金が井戸の内部に露出するように井戸内に形成された可能性のあるすべてのシーラントフィルムを取り外します。水でよくものを記入し、水が隣接するウェル(S)に漏洩しないことを確認してください。すべての井戸について繰り返します。
- 終了microslideは皿の側面の窓( 図2G)に隣接する金属の棒とプラスチックの皿に収まり、電極は、最終的に金属の棒に添付されます。
2。 DNA調製
- 氷上で1.5ml微量遠心チューブにプラスミドDNAを追加し、蒸留水で150μLにボリュームを起動します。複数のプラスミドを種が共存エレクトロ( 例えば 、実験的DsRedを構成し、制御GFPコンストラクト)のために組み合わせることができる。チューブに加えるDNAの量を計算するとき、DNAのアリコートの最終容量が60μlになることを覚えておいてください。一般的に、各コンストラクトは0.5μg/μlの最終濃度で使用されています。
- 15μlの3M酢酸ナトリウム(pH 5.2)と450μlの100%エタノールを加えることによりDNAを沈殿させる。ミックスに数回転倒やチューブをタップします。
- 4でDNAをスピンダウン° C、30分間13200 rpmで、。 70%エタノールでペレットを洗浄し、4で再度スピンダウン° C、15分間13200 rpmで、。空気乾燥ペレットを半透明になるまで、約7分、その後、54μlの滅菌水に懸濁します。 6μl滅菌10 × PBS(pH7.4)およびミックスを追加。
3。アイコレクション
- エレクトロポレーションチャンバーと70%エタノールを持つすべての機器を滅菌する。目のコレクションと解剖は組織培養フードで実行する必要がない一方で、あなたの手袋とエタノールと、プロシージャ全体で無菌状態を維持しようとベンチを消毒する。
- 3ミリリットル培地一二つ35ミリメートル皿ごと:解剖の培地(:F12、100U/mlペニシリン、100μg/mlストレプトマイシン、0.29mg/ml L -グルタミン、および5μg/mlインスリンDMEMの1:1比)でペトリ皿を準備する6ミリリットル培地で60ミリメートル皿。このステップは、組織培養フードで実行する必要があります。
- 新生児の頭頸部(生後0日目)70%エタノールで子犬マウスを消毒する。すぐにはさみで首を切ると滅菌100mmディッシュに頭を転送する。
- 目を公開する小さなハサミで頭皮を切り取る。そっと軌道の外目をすくうために湾曲鉗子を使用し、そして解剖の培地を含む35mmディッシュに目を配置。それは、低電力で解剖顕微鏡下で目を削除すると便利かもしれません。
- すべての目が収集されるまで、ステップ3.3および3.4を繰り返します。解剖しながら室温で解剖媒体で目にしてください。あなたは、DNAのアリコート3〜4の目が必要になります。
4。網膜切開
- かみそりの刃と滅菌したプラスチック製トランスファーピペットのラッパーの両方を駆除するために70%エタノールを使用してください。それは全体の目を吸うことができるようにブレードを持つピペットオフ先端をカット。使用しないときは、プラスチックのラッパーでピペットを保管してください。
- 35mmディッシュから60mmディッシュに片目を転送する。ハイパワーで、解剖顕微鏡下で、眼の表面から、そのような外眼筋や脂肪として、あらゆる組織を除去するために微細な鉗子を使用してください。その後、基地でそれをつまんで視神経を削除します。
- 網膜を単離するために、小さな穴を開けないで私角膜輪部で強膜をn個。穴(網膜面に接線方向)に鉗子の両方のペアから一突起を挿入し、強膜/ RPEを開く引き裂く。アルビノマウスでは、強膜およびRPEは、均質なマットグレー色である網膜組織、に光沢のある相対的に表示されます。色素性マウスでは、RPEは黒です。場所でのレンズにしておきます。
- 培地と他の35mmディッシュに切除した網膜を移動するには、転送ピペットを使用してください。
- すべての目が解剖されるまで4.4手順4.2を繰り返します。
- あなたがエレクトロの準備が整うまで、37℃の組織培養インキュベーターで網膜を保管してください。
5。エレクトロポレーションのための準備
- 培地の35ミリメートル料理を準備します。エレクトロする各DNAのアリコートでは、解剖の培地と培養液の一皿(解剖の培地を加えた10%FBS)の一皿が必要になります。適切な皿にラベルを付けます。
- エレクトロポレーションの皿にチャンバーを洗浄するためにP200ピペットと滅菌1X PBSを使用してください。各チャンバーは60 -100μlの量を保持しています。各チャンバーの計3回洗浄する。
- DNAのアリコートでチャンバーを埋める。任意の未使用のチャンバーは、60μl1X PBSで埋めなくてはなりません。エレクトロ皿に電極を接続してください。
- 、電圧、30V、パルスの長さ、50ミリ秒、パルス、5の数、間隔、950ミリ秒、極性、ユニポーラモード、LV:エレクトロで以下の設定を使用してください。
6。エレクトロポレーション
- レンズによって網膜を把握し、エレクトロポレーションチャンバーにそれらを転送するために微細な鉗子を使用してください。各チャンバーは3-4マウスの網膜( 図3)を収容できます。
- レンズは、正極に接続されている金属の棒に対して傾いているように、網膜を整列するために鉗子を使用してください。次の1つのチャンバーからのDNAのキャリーオーバーを避けるために、各転送後にキムワイプで鉗子を清掃してください。
- すべての網膜が整列されると、エレクトロ上で"スタート"を押してください。小さな気泡は負極に接続されている金属の棒で形成すべきである。
- 電極を外し、エレクトロの電源を切ります。
- 静かにチャンバ壁から網膜を移動するにはピンセットを使用してください。
- 解剖の培地を含む35ミリメートル皿にチャンバーから網膜を転送するために無菌トランスファーピペットを使用してください。
- 各チャンバーの滅菌1 × PBSで3回洗浄し、滅菌水ですすいでください。 70%エタノールでスプレー皿。
7。文化のためのフィルタの網膜の配置
- 培地を含む35ミリメートル皿に網膜を転送する転送ピペットを使用してください。
- 滅菌6ウェル培養プレートのウェルにラベルを付け、3ミリリットルの培地で各ウェルを埋める。
- 各ウェル中の培地の上に、ラウンドワットマンNucleporeフィルター、光沢のある面を上に配置するために滅菌ピンセットを使用してください。
- 解剖顕微鏡下で、フィルタ、レンズ側のドロップダウンに網膜を転送するために無菌トランスファーピペットを使用してください。網膜の土地レンズ側を上にしている場合は、ピペットとそれを再度配置する試みとそれを拾う。一つのフィルタで4つ以上の網膜を配置し、それぞれの網膜の周囲の媒体の液滴は、他の液滴から別の状態であることを確認しないでください。他のプロトコルは、この手順9の前にレンズの除去を求めるが、我々は文化をそのままレンズと網膜のことに注意してください。
- 37℃の組織培養インキュベーター(5%CO 2)の培養プレートを置き、8日、通常は、時間の所望の量のために成長する。培地交換は、より長い培養期間で必要になるかもしれないが、我々の経験では、培地を変更すると、8日間の培養期間中は不要です。
8。蛍光網膜外植片を採取し、flatmounting
- 4%パラホルムアルデヒド/ 1X PBSで各ウェルの培地を交換してください。網膜は、フィルターに付着したままの場合、上と優しくフィルタオフ網膜剥離のフィルタを反転するにはピンセットを使う。 30分間パラホルムアルデヒド中でインキュベートする。室温で。蛍光を漂白避けるために、光から網膜を保護する。
- 1X PBSで10分間二回網膜をすすぐ。
- PBSの小さなドロップでスライドガラス上に網膜を転送するために使い捨てピペットを使用してください。彼らは、エレクトロポレーションサイドアップになるように、蛍光解剖顕微鏡下で、( すなわち 、レンズ側のダウン)網膜を反転するにはピンセットを使う。
- スライドの四隅に砕いたカバーグラス(直径1〜2 mm程度のガラス片)から作られた場所のガラス"足"、これらの足は、網膜のフラット化を防ぐ。それは足の網膜や休符を覆うようにスライド上にそのままガラスのカバースリップを配置。必要に応じて、スライドとカバースリップの間でより多くのPBSを追加するには、ピペットを使用してください。
9。 flatmountにおける蛍光のイメージングと定量化
- 使用してください赤と緑のチャンネルの低消費電力(4X目的)での画像flatmounted網膜をするモノクロカメラを装備した蛍光化合物の顕微鏡。すべての網膜は、蛍光強度の比較を可能にするため、特定の蛍光チャネルに同じ露光時間で撮像されている必要があります。ピクセルが任意の画像では飽和していない、または他の正確な定量は不可能であることを確認してください。 TIFF形式のグレースケールで画像をエクスポートする。
- ImageJのソフトウェア(1つの網膜( すなわち ..、赤のチャンネルと緑チャンネル)に設定されている画像を開きますhttp://rsbweb.nih.gov/ij/ )。このチュートリアルのために、緑色蛍光チャンネル(GFP蛋白質)は、実験内のすべての網膜全体で一定である制御構造です。赤色蛍光チャンネル(DsRedタンパク質タンパク質)は、網膜のセットごとに変化する実験的な構築物である。画像はグレースケールにする必要があります。
- ImageJのでは、コントロールの緑のイメージを選択して、直径が100ユニット(分析/ツール/ ROIマネージャー/詳細/指定)に興味の円を指定します。合計8円を作成するには、この円を(ROIマネージャー/追加)重複。網膜とレンズ( 図4A)を覆う領域の外側エッジを避けて、一様にエレクトロポレーションされている5つの領域を選択するために丸1〜5を移動します。また、網膜/バックグラウンドの蛍光を測定するためにレンズの外側3つの領域を(丸6-8)を選択します。赤のイメージを選択し、ROIマネージャーでボックス"すべてを表示"、および再チェックボックスをオフにチェックしてください。すべての8つの円が赤い画像に表示されます。すべての円はROIマネージャーの座標選択解除します。
- 選択した赤いイメージで、関心のすべての円(ROIマネージャー/測定)の平均ピクセル値を記録し、測定結果1-8 1-5赤い網膜測定であると6-8赤のバックグラウンド測定される場合、表示されるはずです。緑のイメージを選択し、平均ピクセル値を記録してください。9-13緑の網膜の測定値であり、14〜16は緑の背景の測定値がどこの測定9-16は、表示されます。分析のためのExcelに測定データ( 図5)にコピーします。
- 赤と緑のチャンネルの両方で3つのバックグラウンドの測定値の平均。赤のチャネルの5つの網膜の測定値の各々から赤い背景の平均を引く、緑のチャネルの繰り返し。それぞれの網膜関心領域の場合は、コントロール緑色レベル( 図5)に実験的な赤のレベルを正常化するために、バックグラウンドサブトラクション、緑を測定することによりバックグラウンドを差し引いた赤い測定を割ります。
- 与えられたDsRedの構造( 例えば 、網膜の時間当たり5回測定の3つの個別の網膜)のためのすべての正規化の測定値の平均値と標準偏差を決定する。定量的に異なる日に実施したエレクトロポレーションの結果を比較するためには、常にそれぞれのエレクトロポレーションセットの"標準"DsRedの/ GFPの降水量が含まれています。実験間の相対発現値は、このの発現レベルに正規化することによって比較することができる"標準的な。"
10。代表的な結果:
網膜表面の1 / 4に1 / 3( 図4A)全体のDNA構築物(s)の式の中で良好なエレクトロポレーションの結果。特に桿体が効率的に形質導入されているので、この手法は、光受容体特異的なプロモーター活性( 図4B)を定量化するための理想的です。我々は以前ロッド特有のRhoおよびGnat1座10からプロモーター変異体の範囲を定量化するこのアプローチを使用していました。私たちは、ほぼ300倍の範囲でプロモーター活性を定量化することが可能であることがわかった。
図5は、単一のエレクトロポレーション網膜からのサンプルデータセットです。この特定の例では、実験的な構造pNrl(1.1キロバイト)- DsRedを赤チャンネルで測定し、制御構造pNrl(3.2キロバイト)- GFPは緑色のチャネルで測定した。 pNrlのための完全なデータセット(1.1キロバイト)- DsRedの構造は、この方法で測定された6月9日の網膜から構成され、標準偏差はすべての値"GFPに正規化されたDsRedの"に基づいて計算される。我々はpNrlの発現レベル(1.1キロバイト)- DsRedのために比較された場合、例えば、pNrlは(0.8キロバイト)- DsRedのは、両方の構文は、同じGFPの制御( 例えば 、pNrl(3.2キロバイト)とエレクトロされる必要がある- GFP)と同じ露光時間で撮像。標準DsRedタンパク質/ GFPエレクトロポレーション( 例えば 、pNrl(3.2キロバイト)- DsRedの+ pNrl(3.2キロバイト)- GFP)それぞれの日に実行された場合。それは別の日に収集されたプールのデータに可能です。それぞれの実験的構造のため、正規化されたDsRedタンパク質レベルは、その後、"標準"(pNrl(3.2キロバイト)- DsRedの)の正規化されたDsRedタンパク質レベルに正規化される。
我々はここで説明するテクニックは、感光体CRES 10,13の活性を定量化するために主に有用です。細胞型特異的シス調節活性はまた、双極細胞14と稀網膜細胞型で定量化されるが、これは、通常は定量化することに関心のある分野はむしろflatmount調剤ではなく、垂直断面で選択されている必要がありますできます。同じような光受容体と双極細胞のような複数の細胞型で発現を駆動するCRESの真です。実験手順はそうでない場合は類似しています。
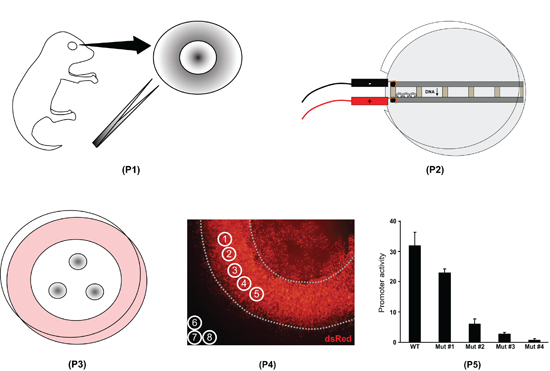
図1網膜の外植片のエレクトロポレーション手順の概要。最初に、全体の目は、生後0日目仔マウスから単離され、網膜を(P1)解剖されています。第二に、網膜は、DNAとエレクトロポレーション(P2)を充填したチャンバー内に配置されています。第三に、網膜をフィルター上に置き、8日(P3)培養する。第四に、網膜の外植片は、固定スライドにマウントし、画像化される。蛍光強度をImageJのソフトウェア(P4)で測定されます。第五に、ImageJのデータは、種々のプロモーター(P5)の活性の違いを定量化するためのスプレッドシートプログラムで処理されます。

図2エレクトロ皿の建設。ハーバード装置、BTXモデル453(カタログ#45〜0105)からA)無改造microslide室。 B)ドレメルツールは、プラスチックチューブのラックからハンドルを切断するために使用されます。長さの0.8センチメートル、高さ0.6センチメートル、幅0.3センチメートル:ハンドルは、以下の寸法で長方形のスペーサーに切断される。 C)プラスチック製スペーサは、等しい間隔でmicroslideチャンバーに取り付けられています。水族館シール剤は、スペーサ(図示せず)との間の隙間に注入される。 D)金属製のバーは、スペーサを介して配置されます。 E)バーとスペーサーは一晩シーラントが乾燥するような場所にすべてを保持するためにバインダークリップをスライド上にクランプされています。 F)スペーサーが削除され、井戸は、それらが防水であることを保証するためにテストされています。 G)終了のスライドは、皿の側面の窓に隣接する金属棒をプラスチックシャーレに収まります。

図3網膜とエレクトロ皿の図。チャンバは、DNA溶液(一度に最大5つの別の解決策)が充填されます。 3つまたは4つの網膜は、5室のそれぞれに収まるように、網膜は、レンズが正極に接続された金属の棒にもたれされるように、チャンバーと指向に配置されます。電流は、負に帯電したDNA分子は網膜細胞に移行する原因となります。

図4。flatmountの網膜蛍光レベルの)ImageJの測定。グレースケールflatmount DsRedタンパク質の画像(実験的)とGFP(制御)チャネルは、ImageJのソフトで開かれます。これらのイメージは、説明のみを目的として色付けされていることに注意してください。五測定界は(1〜5)の端とレンズ(点線)を避けて、一様にエレクトロ地域の上に配置されています。 3つの測定円(6〜8)は、バックグラウンド蛍光レベルを決定するために網膜の外側に配置されています。 B)ハイパワーでのエレクトロポレーション網膜片の断面の画像が。外植片は4℃で一晩30パーセントsucrose/1X PBS中で凍結保護生後8日目、° C、OCTに埋め込まれて固定し、12μmで凍結切片した。蛍光灯の構造pNrl(1.1キロバイト)- DsRedをしpNrl(3.2キロバイト)- GFPは、外顆粒層(ONL)における光受容細胞で発現されています。 INL、内顆粒層、GCL、神経節細胞層。

図5 Excelを使用して蛍光データの処理。ステップ1では、各測定のサークルの平均ピクセル値は、スプレッドシート(セルB3 - B12、F3 - F5、H3 - H5)にコピーされます。測定は#1-5は、DsRedの網膜の値で、#6-8は、DsRedのバックグラウンド値であり、測定は#9-13 GFP網膜値で、#14-16に、GFPのバックグラウンドの値です。測定#2、#10、などがそうであるように、測定#1と#9は、同一の測定円に対応することに注意してください。ステップ2では、DsRedをとGFPのチャネルの平均バックグラウンドの値は、(セルF6、H6)計算されます。ステップ3では、平均的な背景は、すべての網膜の測定(セルC3 - C12)から減算されます。ステップ4では、各バックグラウンドサブトラクションDsRedの測定は、対応するGFPの測定(セルD3 - D7)に正規化されています。
ディスカッション
外植片のエレクトロポレーションは、開発途上のマウス網膜でのシス調節活性を定量化する簡単な手段です。マウスの遺伝子導入を介してシス調節の解析と比較して、エレクトロポレーションは、新生仔マウス、DNA、解剖器具、およびエレクトロポレーション/組織培養装置を必要とする、はるかに安いです。また、消費するはるかに短い時間です:一つの実験では、唯一の準備時間の数時間、約8日間の培養期間、およびイメージングとデータ解析のための実験の終わりに数時間を必要とします。外植片のエレクトロポレーションは、また細胞培養ベースの実際の網膜組織が 利用されているので、 シス調節の解析に優れています。網膜は、外植片ではかなり正常に発達文化 - それは、光受容体は、外側のセグメントを詳しく説明するために失敗するものの、3つの異なる細胞の層を(外顆粒層、内顆粒層、および神経節細胞層)を形成する。
さらなる利点は、外植片のエレクトロポレーションは非常に再現性があります。一般的にであっても別の日に、別の網膜中にエレクトロ同じ構造、同じ相対的な発現レベルの結果。さらに、エレクトロポレーションプラスミドを核内でエピソームに保持されると考えられていると染色体に組み込まれていないので、彼らは、トランスジェニックマウスで行われたシス調節の解析をイライラさせる、同じ組込み部位の影響を受けるように表示されません。
外植片のエレクトロポレーションは、いくつかの制限があります。最初に、細胞周期に残っている細胞のみが効率的にエレクトロ15で形質導入することができます。 P0で、ロッドと他の後の生まれの網膜細胞の種類は(双極細胞、アマクリン細胞、M llerのグリア細胞)この方法の対象となる主要な細胞集団です。 P0エレクトロポレーションにより、錐体光受容体のエレクトロポレーションは、16を報告したが、効率は低いように見えるされています。 2つ目の制限は、網膜の進行性の奇形で2週間の結果を超えてその移植片培養であるため、推奨されません。プロモーターの定量化が遅いタイムポイントで必要な場合はセクション9で説明したように、しかし、in vivoでのエレクトロポレーション9、目的のタイムポイントで網膜切開続いて、実行解剖網膜のフラットマウント、および定量化されることがあります。 3番目の制限は、このアッセイが適度にハイスループットであることです。細胞培養ベースの単一の実験での構造の何百ものテストができるアッセイとは異なり、このプロトコールに記載された技術は、構造ごとに全体のマウス網膜の最小値を必要とします。従って、唯一の数十個の構造は合理的に一日に電気穿孔することができます。
現在のアプローチを使用して、プロモーター活性の定量化に関するつの追加の注意点は非常に強力なプロモーターを測定する際、特に、GFPのチャンネルにDsRedの蛍光の"ブリードスルー"の可能性があるということです。その理由は、GFPのDsRedの一部が重なるのその発光スペクトルである。この問題を回避するために、最適化された発光フィルターは、DsRedのとGFPとの間のスペクトルの重なりを最小限にすることを使用する必要があります。このような最適化されたフィルタセットが利用できないときは、別の潜在的な解決策は、GFPの代わりにブルーシフトした蛍光タンパク質( 例えば 、BFPやCFP)を使用することです。
開示事項
謝辞
著者らは、エレクトロポレーションチャンバーのセクションを記述建設で彼女の助けのためにカレンローレンスに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | コメント(省略可能) |
|---|---|---|---|
| エレクトロポレーション料理、Microslide 453 | BTXハーバード装置 | 45から0105 | 修正のためにプロトコルのセクション1を参照してください |
| 100%のシリコーンゴム水族館のセメント | パーフェクトマニュファクチャリング | ||
| プラスチック製のマイクロチューブのラック | フィッシャーサイエンティフィック | 05から541 | のみラックハンドルが使用されます。 |
| ドレメルツール | プラスチックチューブのラックからハンドルを切断するための | ||
| DMEM | GIBCO / Invitrogen社 | 11965 | |
| F12 | GIBCO / Invitrogen社 | 11765 | |
| L-Glu/pen/strep | GIBCO / Invitrogen社 | 10378-016 | 100X濃度 |
| インスリン | シグマアルドリッチ | I - 6634 | 1000X株式の場合は、5mMの塩酸で5mg/mlに再懸濁し、ろ過滅菌 |
| FBS | GIBCO / Invitrogen社 | 26140-079 | |
| ECM 830方形波エレクトロ | BTXハーバード装置 | ||
| Nucleporeフィルター | ワットマン紙 | 110606 | 25ミリメートル、0.2μmの |
| 組織培養インキュベーター | 37℃、5%CO 2 | ||
| ガラス製カバースリップ#1.5 | フィッシャーサイエンティフィック | 12 - 544E | 厚さ0.16ミリメートル |
| カメラを装備した蛍光化合物の顕微鏡 | カメラは単色(浜松などし、ORCA - ERカメラ)でなければなりません | ||
| EGFP /複合顕微鏡のためのDsRedのフィルタセット | クロマテクノロジー株式会社 | 86007 | 赤と緑のchanenelsの間でこのフィルタセットを最小限に抑えるbleedthrough |
| ImageJのソフトウェア | NIH | http://rsbweb.nih.gov/ij/ |
参考文献
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. . From DNA to diversity : molecular genetics and the evolution of animal design. , (2005).
- Davidson, E. H. . Genomic regulatory systems : development and evolution. , (2001).
- Ptashne, M., Gann, A. . Genes & signals. , (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved