Method Article
Die Quantifizierung der Aktivität von Cis-Regulatorische Elemente in der Maus Retina durch Explantation Elektroporation
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine einfache und kostengünstige Möglichkeit, um die Aktivität von cis-regulatorischen Elemente (dh Enhancer / Promotoren) in lebenden Maus Netzhaut via Explantation Elektroporation zu quantifizieren. DNA-Präparation, Netzhaut-Dissektion, die Elektroporation, Netzhaut-Explantat-Kultur, und nach der Fixierung Analyse und Quantifizierung beschrieben.
Zusammenfassung
Transkriptionsfaktoren innerhalb der zellulären Gen-Netzwerke Kontrolle der raum-zeitlichen Muster und Ebenen des Ausdrucks ihrer Zielgene durch Bindung an cis-regulatorischen Elemente (Cres), kurz (~ 300-600 bp) erstreckt sich von genomischer DNA, die sich stromaufwärts liegen kann, stromabwärts oder innerhalb die Introns der Gene, die sie kontrollieren. Cres (dh, Enhancer / Promotoren) bestehen typischerweise aus mehreren gruppierten Bindungsstellen für beide Transkriptionsaktivatoren und Repressoren 1-3. Sie dienen als logische Integratoren von Transkriptions-Eingang gibt eine einheitliche Ausgabe in Form von raumzeitlich präzise und quantitativ exakt Promotoraktivität. Die meisten Studien von Säugetier-cis-Regelung bis dato auf Maus Transgenese als Mittel zur Untersuchung der Enhancer-Funktion von Cres 4-5 verlassen. Diese Technik ist zeitaufwendig, kostenintensiv und wegen der Insertionsstelle Effekte weitgehend nicht quantitativ. Auf der anderen Seite, haben quantitative Tests für Säugetier-CRE-Funktion in Gewebekultur-Systemen (zB Dual-Luciferase-Assays) entwickelt worden, aber die in-vivo-Relevanz dieser Ergebnisse ist oft ungewiss.
Die Elektroporation bietet eine hervorragende Alternative zu herkömmlichen Maus Transgenese in dem Sinn, dass sowohl raum-zeitliche und quantitative Bewertung der cis-regulatorische Aktivität in lebenden Säugetiergewebe. Diese Technik ist besonders nützlich bei der Analyse von cis-Regelung in das zentrale Nervensystem, vor allem in der Hirnrinde und der Netzhaut 6-8. Während Maus Netzhaut Elektroporation, sowohl in vivo und ex vivo, entwickelt worden ist und ausgiebig von Matsuda und Cepko 6-7,9 beschrieben, haben wir kürzlich einen einfachen Ansatz, um die Aktivität der Photorezeptor-spezifischen CREs in elektroporiert Maus Netzhaut 10 quantifizieren entwickelt. Da die Menge an DNA, die in der Netzhaut durch Elektroporation eingebracht wird, kann von Experiment zu Experiment variieren, ist es notwendig, eine Zusammenarbeit elektroporiert "loading control 'in allen Experimenten sind. In dieser Hinsicht ist die Technik sehr ähnlich wie die Dual-Luciferase-Assay verwendet, um die Promotoraktivität in kultivierten Zellen zu quantifizieren.
Wenn Testen Photorezeptor cis-regulatorische Aktivität, ist die Elektroporation in der Regel in neugeborenen Mäusen (postnatalen Tag 0, P0), die zum Zeitpunkt der Spitze Stab Produktion 11-12 wird durchgeführt. Sobald retinalen Zelltypen werden post-mitotischen, ist die Elektroporation viel weniger effizient. Angesichts der hohen Rate der Stange Geburt in neugeborene Mäuse und die Tatsache, dass Stäbe mehr als 70% der Zellen in der adulten Maus Netzhaut bilden, sind die Mehrzahl der Zellen, die bei P0 elektroporiert sind Stäbe. Aus diesem Grund sind Stäbchen-Photorezeptoren der einfachste Netzhaut Zelltyp über Elektroporation zu studieren. Die Technik, die wir hier beschreiben, ist in erster Linie sinnvoll für die Quantifizierung der Aktivität von Photorezeptoren Cres.
Protokoll
1. Der Bau der Elektroporation Kammer
- Bestellen Sie ein MicroSlide, BTX-Modell 453 mit einem 3,2 mm Abstand (Harvard Apparatus # 45-0105) (Abb. 2A). Die Metallschienen sollte vollständig auf den unteren Rand der Folie abgedichtet werden.
- Verwenden Sie ein Dremel-Werkzeug mit einem Griff aus Kunststoff Mikrozentrifugenröhrchen Rack geschnitten. Schneiden Sie den Griff in 5 kleine rechteckige Stücke jeweils mit den folgenden Abmessungen: Länge 0,8 cm, Höhe 0,6 cm, Breite 0,3 cm (Abb. 2B). Diese Kunststoffteile sind wiederverwendbar Abstandshalter, die verwendet werden, um die einzelnen Vertiefungen in der MicroSlide Kammer Schimmel werden.
- Legen Sie die Kunststoff-Abstandshalter zwischen den Metallschienen des MicroSlide in gleichmäßigen Abständen. Die Abstandshalter sollte eng anliegen (Abb. 2C).
- Schneiden Sie die Spitze aus einem P200 Pipettenspitze, passen die Spitze auf eine 3ml Spritze, und füllen Sie die Spritze mit 100% Silikon Aquarium Versiegelung. Füllen Sie die Lücken zwischen den Abstandhalter aus Kunststoff mit Dichtmittel. Achten Sie darauf, um die Lücken von unten nach oben, so dass keine Luftblasen zwischen dem Dichtstoff-Stecker und die Basis des MicroSlide Formular ausfüllen.
- Legen Sie eine Metallstange oben auf dem Abstandhalter aus Kunststoff und befestigen Sie ihn mit Binder Clips, so dass die Abstandshalter vorhanden sind gehalten, während der Dichtstoff trocknet (Abb. 2D-E). Lassen Sie die Versiegelung über Nacht trocknen.
- Entfernen Sie den Binder Clips, Metallstab und Abstandhalter aus Kunststoff (Abb. 2F). Verwenden Sie ein Skalpell, um die Versiegelung von der Spitze der Metallschienen reinigen. Verwenden Sie ein Binokular auf die MicroSlide zu untersuchen und sicherzustellen, dass keine Blasen an der Unterseite des Silikon-Dämme sind. Entfernen Sie alle Dichtstoff Film, der in den Brunnen, so dass blankes Metall in den Brunnen ausgesetzt ist, gebildet haben. Füllen Sie ein gut mit Wasser und stellen Sie sicher, dass das Wasser nicht weiter in den angrenzenden gut (s). Wiederholen Sie dies für alle Vertiefungen.
- Die fertigen MicroSlide passt in die Plastikschale mit dem Metall Pole neben dem Fenster in der Seite der Schale (Abb. 2G), die Elektroden wird schließlich auf das Metall Stangen befestigt werden.
2. DNA-Präparation
- Add Plasmid-DNA zu einem 1,5 ml Mikrozentrifugenröhrchen auf Eis und bringen die Lautstärke bis zu 150 &mgr; l mit destilliertem Wasser. Multiple-Plasmid Arten können für die Zusammenarbeit Elektroporation (z. B. eine experimentelle DsRed konstruieren und eine Kontrolle GFP-Konstrukt) kombiniert werden. Bei der Berechnung der Menge an DNA, um das Rohr hinzuzufügen, bedenken Sie, dass das endgültige Volumen der DNA-Aliquot werden 60μl. Normalerweise ist jedes Konstrukt in einer Endkonzentration von 0.5μg/μl verwendet.
- Fällung der DNA durch Zugabe von 15μl 3M Natriumacetat (pH 5,2) und 450μl 100% Ethanol. Umkehren oder tippen Sie auf das Röhrchen mehrmals zu mischen.
- Spin auf der DNA bei 4 ° C, 13.200 rpm, 30 min. Waschen des Pellets mit 70% Ethanol, dann drehen sie sich wieder bei 4 ° C, 13.200 rpm für 15 Minuten. Der Luft trocknen das Pellet bis semi-transparent, ca. 7 Minuten, dann in 54μl sterilem Wasser resuspendiert. Add 6μl sterile 10X PBS (pH 7,4) und mischen.
3. Eye-Sammlung
- Sterilisieren der Elektroporation Kammer und alle Instrumente mit 70% Ethanol. Während brauchen Auge Sammlung und Dissektion nicht in einer Gewebekultur Abzug durchgeführt werden, desinfizieren Sie Ihre Handschuhe und Tischgerät mit Ethanol und versuchen, sterile Bedingungen während des gesamten Verfahrens aufrecht zu erhalten.
- Bereiten Sie Petrischalen mit Dissektion Medium (1:1-Verhältnis von DMEM: F12, 100U/ml Penicillin, 100μg/ml Streptomycin, 0.29mg/ml L-Glutamin und 5μg/ml Insulin): zwei 35-mm-Gerichte mit jeweils 3ml Medium und eine 60mm Teller mit 6ml Medium. Dieser Schritt sollte in einer Gewebekultur Abzug durchgeführt werden.
- Desinfizieren Sie die Kopf-und Hals eines Neugeborenen (postnatalen Tag 0) Maus Welpe mit 70% Ethanol. Schnell mit einer Schere zu enthaupten und den Transfer der Kopf in eine sterile 100mm Schüssel.
- Schneiden Sie die Kopfhaut mit einer kleinen Schere die Augen setzen. Verwenden einer gebogenen Pinzette vorsichtig Schaufel das Auge aus der Augenhöhle, und platzieren Sie das Auge in einer 35mm Schale mit Dissektion Medium. Es kann hilfreich sein, die Augen unter einem Binokular bei geringer Leistung zu entfernen.
- Wiederholen Sie die Schritte 3.3 und 3.4, bis alle Augen gesammelt wurden. Halten Sie die Augen in Dissektion Medium bei Raumtemperatur während sezieren. Sie benötigen 3-4 Augen pro DNA Aliquot.
4. Retinal Dissektion
- Verwenden Sie 70% Ethanol, beide mit einer Rasierklinge und der Wrapper einer sterilen Plastik Transferpipette desinfizieren. Schneiden Sie die Spitze aus der Pipette mit der Klinge, so dass es saugen kann eine ganze Auge. Bewahren Sie die Pipette in die Plastikfolie, wenn nicht in Gebrauch ist.
- Transfer mit einem Auge aus dem 35mm Teller auf die 60mm Gericht. Unter dem Binokular bei hoher Leistung, verwenden feinen Pinzette zu entfernen irgendein Gewebe, wie Augenmuskeln und Fett von der Oberfläche des Auges. Dann entfernen Sie den Sehnerv durch Kneifen es aus an der Basis.
- Um die Netzhaut zu isolieren, poke ein kleines Loch in der Sklera am Limbus. Legen Sie einen Stift aus beiden Pinzetten in das Loch (tangential an der Netzhaut) und vorsichtig aufreißen die Lederhaut / RPE. In Albino-Mäuse, erscheinen die Lederhaut und RPE glänzenden bezogen auf die Retina, die eine homogene matte graue Farbe ist. In pigmentierten Mäusen ist die RPE schwarz. Lassen Sie das Objektiv an Stelle.
- Verwenden Sie die Transferpipette der sezierten Netzhaut in den anderen 35-mm-Schale mit Medium zu bewegen.
- Wiederholen Sie die Schritte 4,2 bis 4,4, bis alle Augen seziert worden.
- Shop der Netzhaut in einem 37 ° C Gewebekultur-Inkubator, bis Sie bereit elektroporieren sind.
5. Vorbereitung für die Elektroporation
- Bereiten 35mm Gerichte des Mediums. Für jede DNA Aliquot elektroporiert werden, müssen Sie eine Schüssel Dissektion mittel-und eine Schüssel von Kulturmedium (Dissektion Medium plus 10% FBS). Beschriften Sie die Gerichte entsprechend.
- Verwenden Sie ein P200 Pipette und sterile 1X PBS zu waschen die Kammern in die Elektroporation Gericht. Jede Kammer hat ein Volumen von 60-100 &mgr;. Waschen Sie jede Kammer dreimal.
- Füllen Sie die Kammern mit den DNA-Aliquots. Nicht verwendete Kammern sollte mit 60μl 1X PBS gefüllt werden. Verbinden Sie die Elektroden auf die Elektroporation Gericht.
- Verwenden Sie die folgenden Einstellungen auf dem Elektroporator: mode, LV, Spannung, 30V; Pulslänge 50 ms; Anzahl der Impulse, 5; Intervall, 950 ms, Polarität, unipolar.
6. Elektroporation
- Verwenden feinen Pinzette auf die Netzhaut durch die Linse zu erfassen und übertragen sie in die Elektroporation Kammern. Jede Kammer kann bis zu 3-4 Maus Netzhaut (Abb. 3).
- Verwenden einer Pinzette, um Line-Up der Netzhaut, so dass die Linse gegen die Metallstange an der positiven Elektrode neigt. Reinigen Sie die Zange mit einem Kimwipe nach jedem Transfer zu vermeiden Verschleppung von DNA aus einer Kammer in die nächste.
- Sobald alle Netzhaut ausgerichtet sind, drücken Sie "Start" auf dem Elektroporator. Tiny Blasen sollten auf der Metallstange an der negativen Elektrode zu bilden.
- Trennen Sie die Elektroden und schalten Sie den Elektroporator.
- Verwenden einer Pinzette vorsichtig bewegen die Netzhaut weg von der Kammerwände.
- Verwenden Sie eine sterile Transferpipette auf der Netzhaut aus den Kammern Transfer in die 35-mm-Schalen mit Dissektion Medium.
- Waschen Sie jede Kammer dreimal mit sterilem 1X PBS, dann mit sterilem Wasser spülen. Spray Schüssel mit 70% Ethanol.
7. Platzieren Netzhaut an Filtern für die Kultur
- Verwenden Sie einen Transfer Pipette auf die Netzhaut in den 35-mm-Schalen mit Nährboden übertragen.
- Beschriften Sie die Vertiefungen einer sterilen 6-well-Kulturplatte und füllen jedes Well mit 3ml Kulturmedium.
- Verwenden einer sterilen Pinzette zu runden Whatman Nuclepore Filter, glänzenden Seite nach oben, oben auf dem Medium in jede Vertiefung statt.
- Unter einem Binokular, eine sterile Transferpipette auf der Netzhaut auf den Filter, Objektiv-side-down zu übertragen. Wenn die Netzhaut landet Objektiv-side-up, es aufnehmen mit der Pipette und versuchen, es wieder Platz. Legen Sie nicht mehr als 4 Netzhaut auf einem Filter, und stellen Sie sicher, dass die Tröpfchen der umgebenden Mediums jeder Retina getrennt von den anderen Tröpfchen bleiben. Beachten Sie, dass wir die Kultur der Netzhaut mit dem Objektiv intakt, obwohl auch andere Protokolle für die Entfernung der Linse rufen vor diesem Schritt 9 fort.
- Legen Sie die Kultur Platte in einem 37 ° C Gewebekultur-Inkubator (5% CO 2) und wachsen für die gewünschte Menge an Zeit, in der Regel acht Tage. In unserer Erfahrung, wobei das Medium ist nicht notwendig während der 8 Tage Kulturdauer, obwohl ein Mediumwechsel für längere Zeiträume Kultur erforderlich sein kann.
8. Ernte und flatmounting fluoreszierenden Netzhaut Explantate
- Ersetzen Sie das Kulturmedium in jede Vertiefung mit 4% Paraformaldehyd / 1X PBS. Wenn die Netzhaut, die Filter stecken bleiben, verwenden Sie Zangen, um die Filter umdrehen und vorsichtig schälen die Netzhaut aus dem Filter. Inkubieren in Paraformaldehyd für 30 min. bei Raumtemperatur. Schützen Sie die Netzhaut vor Licht zu vermeiden, Bleichen der Fluoreszenz.
- Spülen Sie die Netzhaut zweimal für 10 Minuten in 1X PBS.
- Verwenden Sie ein Einweg-Pipette auf die Netzhaut auf einen Objektträger in einen kleinen Tropfen PBS übertragen. Unter einem fluoreszierenden Präpariermikroskop, verwenden Pinzette auf die Netzhaut Flip, so dass sie elektroporiert-side-up (dh, Objektiv-side-down).
- Legen Glas "Füße" aus zerstoßenen Deckgläser (Glasscherben ca. 1-2 mm im Durchmesser) an den Ecken der Folie gemacht, diese Füße verhindern Abflachung der Netzhaut. Ein intaktes Deckglas über der Folie, so dass es deckt die Netzhaut und ruht auf den Füßen. Falls erforderlich, eine Pipette, um mehr PBS zwischen dem Schieber und dem Deckglas hinzuzufügen.
9. Imaging und Quantifizierung der Fluoreszenz in Flatmount
- Verwenden Sie einfluoreszierende Verbindung Mikroskop mit einem Monochrom-Kamera zur Abbildung der flatmounted Netzhaut bei geringer Leistung (4X Objektiv) in die rote und grüne Kanälen ausgestattet. Alle Netzhaut müssen mit der gleichen Belichtungszeit für eine bestimmte fluoreszierende Kanal abgebildet werden zum Vergleich der Fluoreszenzintensitäten zu ermöglichen. Stellen Sie sicher, dass die Pixel nicht in jedem Bild gesättigt, oder genaue Quantifizierung unmöglich sein wird. Export von Bildern in Graustufen TIFF-Format.
- Öffnen Sie das Bild für eine Netzhaut (dh .., Rot-Kanal und grünen Kanal) in ImageJ-Software (Set http://rsbweb.nih.gov/ij/ ). Aus Gründen der diesem Tutorial wird das grün fluoreszierende Kanal (GFP-Protein) die Kontrolle zu konstruieren, die konstant in allen Netzhaut in das Experiment. Die rote Fluoreszenz-Kanal (DsRed Protein) ist die experimentelle Konstrukt, das für jeden Satz von Netzhaut unterschiedlich. Die Bilder sollten in Graustufen.
- In ImageJ, wählen Sie die Kontrolle grünes Image und geben Sie einen Kreis von Interesse mit einem Durchmesser von 100 Einheiten (Analyze / Tools / ROI-Manager / Mehr / angeben). Duplizieren Sie diesen Kreis (ROI Manager / Add) zu acht Kreise insgesamt zu schaffen. Bewegen Kreise 1-5, fünf Regionen, die gleichmäßig elektroporiert auszuwählen, die Vermeidung der äußeren Ränder der Netzhaut und dem Gebiet über der Linse (Abb. 4A). Wählen Sie außerdem drei Regionen (Kreise 6-8) außerhalb der Netzhaut / Objektiv Hintergrundfluoreszenz zu messen. Wählen Sie das rote Bild, deaktivieren Sie das "Show all"-Box in ROI-Manager, und re-aktivieren Sie das Kontrollkästchen. Alle acht Kreise sollten sich auf das rote Bild erscheinen. De-select all Kreis Koordinaten in ROI-Manager.
- Mit dem roten Bild ausgewählt, werden die Mittelwerte Pixelwert für alle Kreise von Interesse (ROI Manager / Measure); Messungen 1-8 erscheinen soll, wo 1-5 Die rote Netzhaut Messungen und 6-8 sind die roten Hintergrund-Messungen. Wählen Sie das grüne Bild und notieren die mittlere Pixelwert; Messungen 9-16 erscheinen, wo 9-13 grünen Netzhaut Messungen und 14-16 sind die grünen Hintergrund Messungen. Kopieren Sie die Messdaten in Excel zur Analyse (Abb. 5).
- Durchschnittliche die drei Hintergrund-Messungen in die rote und die grüne Kanäle. Subtrahieren Sie die roten Hintergrund Durchschnitt von jedem der fünf Netzhaut Messungen in den roten Kanal, wiederholen Sie für den grünen Kanal. Für jede Netzhaut Region-of-interest, teilen Sie die Hintergrund-subtrahiert rot Messung durch die Hintergrund-subtrahiert grün Messung, um die experimentellen Rot-Pegel an die Steuerung grüne Ebene (Abb. 5) zu normalisieren.
- Bestimmen Sie den Mittelwert und Standardabweichung aller normierten Messungen für eine gegebene DsRed Konstrukt (zB 5 Messungen pro Netzhaut mal 3 separate Netzhaut). Um quantitativen Vergleich der Ergebnisse der electroporations an verschiedenen Tagen durchgeführt, immer mit einem "Standard"-DsRed / GFP Niederschläge in jeder Elektroporation gesetzt. Relative Expression Werte über Experimente können durch die Normalisierung der Expression dieser verglichen werden "Standard".
10. Repräsentative Ergebnisse:
Eine gute Elektroporation zur Expression des DNA-Konstrukts (s) über 1 / 4 bis 1 / 3 der retinalen Oberfläche (Abb. 4A). Da Stäbchen-Photorezeptoren in allem effizient transduziert, ist diese Technik ideal für die Quantifizierung von Photorezeptor-spezifischen Promotoraktivität (Abb. 4B). Bislang hatten wir diesen Ansatz auf eine Reihe von Promotor-Varianten von der Stange-spezifische Rho und Gnat1 loci 10 quantifizieren. Wir fanden, dass es möglich ist, Promotoraktivität über einen fast 300-fache Bandbreite zu quantifizieren.
Abbildung 5 ist ein Beispiel für Datensatz aus einer Hand elektroporiert Netzhaut. In diesem Beispiel wurde der experimentelle Aufbau pNrl (1.1kb)-DsRed in den roten Kanal gemessen und die Kontrolle zu konstruieren pNrl (3.2kb)-GFP wurde in den grünen Kanal gemessen. Ein kompletter Datensatz für die pNrl (1.1kb)-DsRed konstruieren würde von 6-9 Netzhaut auf diese Weise gemessen bestehen, und die Standardabweichung würde auf der Grundlage aller "DsRed normiert auf GFP"-Werte berechnet werden. Wenn wir den Vergleich wurden die Expression von pNrl (1.1kb)-DsRed, um zum Beispiel pNrl (0.8kb)-DsRed, dann werden beide Konstrukte müsste mit der gleichen GFP-Steuerung (zB pNrl (3.2kb) elektroporiert werden - GFP) und zur gleichen Belichtungszeiten abgebildet. Es ist möglich, Pool-Daten an unterschiedlichen Tagen erhoben, wenn ein Standard-DsRed / GFP Elektroporation ist an jedem Tag durchgeführt (zB pNrl (3.2kb)-dsRed + pNrl (3.2kb)-GFP). Für jeden experimentellen konstruieren, würden die normierten DsRed Ebene im Anschluss an die normalisierten DsRed Ebene des "Standard" (pNrl (3.2kb)-dsRed) normiert werden.
Die Technik, die wir hier beschreiben, ist in erster Linie sinnvoll für die Quantifizierung der Aktivität von Photorezeptoren CREs 10,13.Zelltyp-spezifische cis-regulatorische Aktivität kann auch in selteneren retinalen Zelltypen wie bipolare Zellen 14 quantifiziert werden, sondern dies in der Regel voraus, dass die Bereiche von Interesse quantifiziert werden in vertikalen Querschnitten, anstatt in Flatmount Präparate ausgewählt werden. Das gleiche gilt von Cres, welche die Expression Laufwerk in mehreren Zelltypen wie Photorezeptoren und bipolaren Zellen. Die experimentellen Verfahren sind ansonsten ähnlich.
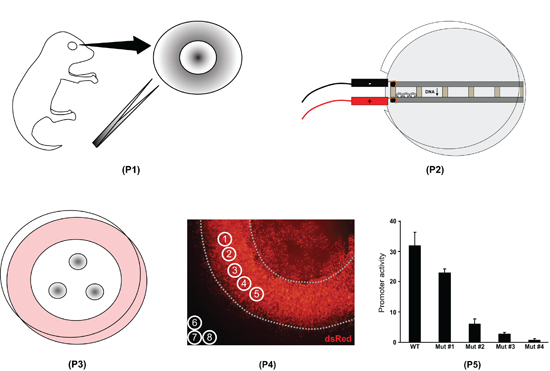
Abbildung 1. Übersicht über die Netzhaut Explantation Elektroporation Verfahren. Zunächst ganze Augen sind aus postnatalen Tag 0 Maus Welpen isoliert, und die Netzhaut sind seziert (P1). Zweitens sind die Netzhaut in Kammern mit DNA und Elektroporation (P2) gefüllt ist. Drittens sind die Netzhaut auf Filter gebracht und kultiviert 8 Tage (P3). Viertens sind die retinalen Explantate fest montiert auf Dias und abgebildet. Fluoreszenzintensität mit ImageJ-Software (P4) gemessen. Fünftens sind die ImageJ Daten in eine Tabellenkalkulation verarbeitet werden, um den Unterschied in der Aktivität verschiedener Promotoren (P5) zu quantifizieren.

Abbildung 2. Bau der Elektroporation Gericht. A) Unveränderte MicroSlide Kammer von Harvard Apparatus, BTX-Modell 453 (Katalog # 45-0105). B) Ein Dremel Werkzeug wird verwendet, um den Griff aus einem Kunststoffrohr Rack geschnitten. Länge 0,8 cm, Höhe 0,6 cm, Breite 0,3 cm: Der Griff ist in rechteckige Abstandshalter mit den folgenden Dimensionen geschnitten. C) Die Abstandhalter aus Kunststoff sind in den MicroSlide Kammer in gleichen Abständen angebracht. Aquarium Dichtstoff in die Lücken zwischen den Abstandshaltern (nicht dargestellt) injiziert. D) Ein Metallstab wird über die Abstandhalter gelegt. E) Die Bar und die Abstandshalter sind auf den Objektträger mit Bindemittel Clips eingespannt, um alles an seinem Platz zu halten, wie das Dichtmittel trocknet über Nacht. F) Die Abstandhalter werden entfernt und die Vertiefungen werden getestet, um sicherzustellen, dass sie wasserdicht sind. G) Das fertige Bild passt in die Plastikschale mit den Metallstangen neben dem Fenster in der Seite der Schale.

Abbildung 3. Schematische Darstellung der Elektroporation Gericht mit Netzhaut. Die Kammern sind mit DNA-Lösungen (bis zu fünf verschiedene Lösungen zu einem Zeitpunkt) gefüllt. Netzhaut sind in den Kammern und orientiert platziert, so dass die Linse gegen die Metallstange an der positiven Elektrode gelehnt; drei oder vier Netzhaut wird in jedem der fünf Kammern zu passen. Der elektrische Strom bewirkt, dass die negativ geladenen DNA-Moleküle in die Zellen der Netzhaut zu bewegen.

Abbildung 4. A) ImageJ Messung der retinalen Fluoreszenz Ebenen in Flatmount. Graustufen Flatmount Bilder in der DsRed (experimentell) und GFP (Kontrolle) Kanäle sind in ImageJ Software geöffnet; beachten Sie, dass diese Bilder lediglich zu illustrativen Zwecken wurden gefärbt. Fünf Messung Kreisen (1 bis 5) werden über gleichmäßig elektroporiert Regionen gelegt, die Vermeidung der Kanten und Objektiv (gestrichelte Linien). Drei Messung Kreisen (6 bis 8) werden außerhalb der Netzhaut zu Hintergrundfluoreszenz Ebenen bestimmen platziert. B) Schnittbilder eines elektroporiert Netzhaut Explantation bei hoher Leistung. Das Explantat wurde am postnatalen Tag 8, in 30% sucrose/1X PBS über Nacht bei 4 cryoprotected ° C, in OCT eingebettet fixiert und Kryo-Schnitt bei 12 &mgr;. Die fluoreszierenden Konstrukte pNrl (1.1kb)-DsRed und pNrl (3.2kb)-GFP sind in Sehzellen in der äußeren Körnerschicht (ONL) ausgedrückt. INL, innere Körnerschicht; GCL, Ganglienzellschicht.

Abbildung 5. Verarbeitung von Fluoreszenz-Daten mit Excel. In Schritt 1 wird der mittlere Pixelwert für jede Messung Kreis in der Tabelle (Zellen B3-B12, F3-F5, H3-H5) kopiert. Messungen # 1-5 sind die DsRed Netzhaut Werte und # 6-8 sind die DsRed Hintergrund Werte; Messungen # 9-13 der GFP Netzhaut Werte und # 14-16 sind die GFP Hintergrund Werte. Beachten Sie, dass die Messung Nr. 1 und Nr. 9 auf die gleiche Messung Kreis entsprechen, ebenso wie Messungen # 2 und # 10, und so weiter. In Schritt 2 wird der durchschnittliche Wert für den Hintergrund DsRed und GFP-Kanäle berechnet (Zellen F6, H6). In Schritt 3 die durchschnittliche Hintergrund ist von jeder Retina subtrahiert (Zellen C3-C12). In Schritt 4, die jeweils background-subtrahiert DsRed Messung zum entsprechenden GFP-Messung (Zellen D3-D7) normiert ist.
Diskussion
Explantation Elektroporation ist eine einfache Möglichkeit zur Quantifizierung der cis-regulatorische Aktivität in den Entwicklungsländern Maus Netzhaut. Im Vergleich zu cis-regulatorische Analyse per Maus Transgenese, ist die Elektroporation viel billiger und erfordert nur neugeborenen Maus Welpen, DNA, Sezierbesteck und Elektroporation / Gewebekultur Ausrüstung. Es ist auch weit weniger zeitaufwendig: Ein Experiment erfordert nur ein paar Stunden Vorbereitungszeit, eine Kultur Zeitraum von etwa acht Tage, und ein paar Stunden am Ende des Experiments für die Bildgebung und Datenanalyse. Explantation Elektroporation ist auch überlegen Zellkultur-basierten cis-regulatorische Analyse, da tatsächliche Netzhautgewebe genutzt wird. Die Netzhaut entwickelt ganz normal in Explantation Kultur-und bildet drei verschiedene Zellschichten (äußere Körnerschicht, innere Körnerschicht und Ganglienzellschicht), obwohl Photorezeptoren äußeren Segmente aufwendigen scheitern.
Ein weiterer Vorteil ist, dass Explantation Elektroporation ist in hohem Maße reproduzierbar. Das gleiche Konstrukte in verschiedenen Netzhaut elektroporiert, auch an verschiedenen Tagen, führt in der Regel den gleichen relativen Expression. Darüber hinaus, da die Elektroporation Plasmide gedacht werden, um episomal in den Zellkern gehalten werden und sind nicht in Chromosomen integriert, scheinen sie nicht zu unterliegen den gleichen Integrationsstelle Effekte, die cis-regulatorische Analyse in transgenen Mäusen durchgeführt verteufeln.
Explantation Elektroporation hat mehrere Einschränkungen. Erstens können nur Zellen, die sich noch in den Zellzyklus effizient transduziert werden durch Elektroporation 15. Bei P0, Stäbe und andere später geboren retinalen Zelltypen (bipolar, Amakrinzellen, M ller Glia) die wichtigsten Zellpopulationen durch diese Methode gezielt. Elektroporation von Zapfen-Photorezeptoren durch P0 Elektroporation wurde vor 16 berichtet, aber die Effizienz scheint gering zu sein. Eine zweite Einschränkung ist, dass Explantation Kultur über zwei Wochen zu einer fortschreitenden Fehlbildung der Netzhaut und wird daher nicht empfohlen. Wenn Promoter Quantifizierung am späten Zeitpunkten erforderlich ist, jedoch eine in vivo Elektroporation 9 durchgeführt, kann durch Netzhaut-Dissektion gefolgt werden an der gewünschten Zeitpunkt, Flachbild-Montage des seziert Netzhaut und Quantifizierung, wie in Abschnitt 9 beschrieben. Eine dritte Einschränkung ist, dass dieser Test nur mäßig hohem Durchsatz ist. Im Gegensatz zu Zellkultur-basierte Assays, dass Hunderte von Konstrukten in einem einzigen Experiment testen können, benötigt die Technik in diesem Protokoll beschriebenen mindestens eine ganze Maus Netzhaut pro Konstrukt. So kann nur ein paar Dutzend Konstrukte vernünftigerweise an einem Tag elektroporiert werden.
Eine weitere Einschränkung in Bezug auf die Quantifizierung der Promotoraktivität mit dem vorliegenden Ansatz ist, dass es ein Potential für "Durchschlagen" der DsRed-Fluoreszenz in den GFP-Kanal, vor allem wenn Assay sehr starke Promotoren. Der Grund dafür ist, dass das Emissionsspektrum teilweise mit der von GFP DsRed. Zur Umgehung dieses Problems sollten optimiert Emissionsfilter verwendet werden, minimieren die spektrale Überlappung zwischen DsRed und GFP werden. Wenn eine solche optimierte Filter-Sets nicht verfügbar sind, wäre eine weitere mögliche Lösung sein, um einen blau-verschoben fluoreszierenden Proteins (zB BFP oder CFP) statt der GFP zu verwenden.
Offenlegungen
Danksagungen
Die Autoren bedanken sich bei Karen Lawrence für ihre Hilfe danken, mit dem Abschnitt über Bau der Elektroporation Kammer.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare (optional) |
|---|---|---|---|
| Elektroporation Gericht, MicroSlide 453 | BTX Harvard Apparatus | 45-0105 | Siehe Protokoll Abschnitt 1 für Änderungen |
| 100% Silikon Aquarium Zement | Perfecto Fertigung | ||
| Plastic Mikroröhrchen Rack | Fisher Scientific | 05-541 | Nur das Gestell Griff verwendet werden |
| Dremel | Zum Schneiden der Griff aus dem Kunststoffrohr-Rack | ||
| DMEM | Gibco / Invitrogen | 11965 | |
| F12 | Gibco / Invitrogen | 11765 | |
| L-Glu/pen/strep | Gibco / Invitrogen | 10378-016 | 100X-Konzentration |
| Insulin | Sigma-Aldrich | I-6634 | Für 1000X Aktien, zu 5mg/ml in 5mM HCl und Filter-sterilisiert resuspendieren |
| FBS | Gibco / Invitrogen | 26140-079 | |
| ECM 830 Square-wave Elektroporator | BTX Harvard Apparatus | ||
| Nuclepore Filter | Whatman | 110606 | 25mm, 0,2 um |
| Gewebekultur-Inkubator | 37 ° C, 5% CO 2 | ||
| Deckgläser # 1.5 | Fisher Scientific | 12-544E | 0,16 mm dick |
| Fluoreszierende Verbindung Mikroskop mit Kamera ausgestattet | Kamera sollte einfarbig (zB ORCA-ER-Kamera von Hamamatsu) werden | ||
| EGFP / DsRed-Filter-Set für zusammengesetzte Mikroskop | Chroma Technology Corp | 86007 | Dieser Filter gesetzt minimiert Übersprechen zwischen den roten und grünen chanenels |
| ImageJ Software | NIH | http://rsbweb.nih.gov/ij/ |
Referenzen
- Carroll, S. B., Grenier, J. K., Weatherbee, S. D. . From DNA to diversity : molecular genetics and the evolution of animal design. , (2005).
- Davidson, E. H. . Genomic regulatory systems : development and evolution. , (2001).
- Ptashne, M., Gann, A. . Genes & signals. , (2002).
- Blow, M. J. ChIP-Seq identification of weakly conserved heart enhancers. Nat Genet. 42, 806-810 (2010).
- Visel, A. ChIP-seq accurately predicts tissue-specific activity of enhancers. Nature. 457, 854-858 (2009).
- Matsuda, T., Cepko, C. L. Electroporation and RNA interference in the rodent retina in vivo and in vitro. Proc Natl Acad Sci U S A. 101, 16-22 (2004).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- LoTurco, J., Manent, J. B., Sidiqi, F. New and improved tools for in utero electroporation studies of developing cerebral cortex. Cereb Cortex. 19, 120-125 (2009).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Lee, J., Myers, C. A., Williams, N., Abdelaziz, M., Corbo, J. C. Quantitative fine-tuning of photoreceptor cis-regulatory elements through affinity modulation of transcription factor binding sites. Gene Ther. 17, 1390-1399 (2010).
- Carter-Dawson, L. D., LaVail, M. M. Rods and cones in the mouse retina. II. Autoradiographic analysis of cell generation using tritiated thymidine. J Comp Neurol. 188, 263-272 (1979).
- Young, R. W. Cell differentiation in the retina of the mouse. Anat Rec. 212, 199-205 (1985).
- Corbo, J. C. CRX ChIP-seq reveals the cis-regulatory architecture of mouse photoreceptors. Genome Res. 20, 1512-1525 (2010).
- Kim, D. S., Matsuda, T., Cepko, C. L. A core paired-type and POU homeodomain-containing transcription factor program drives retinal bipolar cell gene expression. J Neurosci. 28, 7748-7764 (2008).
- Karra, D., Dahm, R. Transfection techniques for neuronal cells. J Neurosci. 30, 6171-6177 (2010).
- Onishi, A., Peng, G. H., Chen, S., Blackshaw, S. Pias3-dependent SUMOylation controls mammalian cone photoreceptor differentiation. Nat Neurosci. 13, 1059-1065 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten