Method Article
Multiplexado inmunoensayo fluorométrico Metodología de prueba y solución de problemas
En este artículo
Resumen
Gracias a la tecnología Luminex Corporation microesfera xMAP, hemos desarrollado el inmunoanálisis fluorométrico multiplexada (MFIA) para la vigilancia serológica de las diversas especies de animales de laboratorio. El MFIA es un microarray de suspensión donde se covalentemente con el antígeno, tejido de control o inmunoglobulinas vinculado a microesferas de poliestireno con código de color. El método de prueba MFIA, así como diversos temas de solución de problemas se aborda.
Resumen
Para garantizar la calidad de los modelos animales utilizados en la investigación biomédica se ha desarrollado un número de estrategias de ensayo y métodos de diagnóstico para determinar si los animales han sido expuestos a adventicios agentes infecciosos (virus, micoplasmas y otros microorganismos exigentes). Infecciones de los animales inmunocompetentes son generalmente transitorias, todavía respuestas de anticuerpos séricos a la infección a menudo se pueden detectar dentro de días a semanas y persisten durante toda la vida del huésped. La serología es el método de diagnóstico principal por la que los animales de laboratorio son monitoreadas. Históricamente, el indirecto ligado a enzimas (ELISA) ha sido el principal método de detección para la vigilancia serológica. El ELISA se realiza como una singleplex, en el que uno microbiana reacción antígeno-anticuerpo se mide por pocillo. En comparación, el MFIA se realiza como un ensayo de multiplexado. Dado que las microesferas vienen en 100 conjuntos de colores distintos, hasta 100 diferentes ensayos se pueden realizar simultaneously en un solo pocillo de microplaca. Esta innovación disminuye la cantidad de suero, reactivos y materiales desechables requeridos para las pruebas de rutina, mientras que el aumento de la cantidad de información obtenida a partir de una única prueba bien. Además, son capaces de incorporar múltiples bolas de control interno para verificar la muestra y la idoneidad del sistema y de ese modo asegurar la exactitud de los resultados. Éstos incluyen el control de tejido e IgG anti-inmunoglobulina de ensayo especies suero (αIg) recubiertos juegos de microesferas para evaluar la idoneidad de la muestra. Como en el ELISA e IFA, el tejido de control detecta la unión no específica de las inmunoglobulinas séricas. El control αIg (suero de control) confirma que se ha añadido suero y contiene una concentración suficiente de inmunoglobulina IgG, mientras que la bola de control (control de aptitud del sistema), recubiertos con inmunoglobulina especies suero, demuestra que los reactivos marcados y lector de Luminex están funcionando correctamente.
Protocolo
1. Explicación del procedimiento MFIA (Figura 1)
- El MFIA requiere microesferas antígeno recubierto de Charles River poliestireno (cuentas), los sueros de ensayo, reactivos marcados (BAG, SPE) y amortiguadores (diluyente de Primaria, tampón de ensayo).
- Los reactivos se añaden paso a paso a los pozos de 96-y placas de microtitulación de filtro de fondo.
- El MFIA se realiza como una incubaciones de ensayo heterogéneos significado son seguidos por etapas de lavado de filtro para eliminar los componentes de suero no unidos o etiquetados reactivos. Solución de lavado añadido a pocillos de la placa se retira por aspiración a través de filtro así-fondos, que retienen las perlas.
- Los ensayos MFIA se realizan a temperatura ambiente (27 ° C + / -2 ° C).
- Complejos antígeno-anticuerpo formados durante la etapa de ensayo de incubación de suero son detectados por incubación con biotina de cabra anti-especie conjugados (BAG) seguido de R-ficoeritrina-estreptavidina marcada (SPE).
- En el lector de ensayo, las perlas de pasar de una en una a travésun detector donde están expuestos a dos láseres. Un láser excita los colorantes internos que identifican el conjunto de bolas de color, que corresponde a un ensayo, y el otro excita el colorante indicador ficoeritrina capturado durante el ensayo. Un número predeterminado de perlas se leen por ensayo y la intensidad de fluorescencia de la ficoeritrina se informa como una media de índice de fluorescencia (MFI).
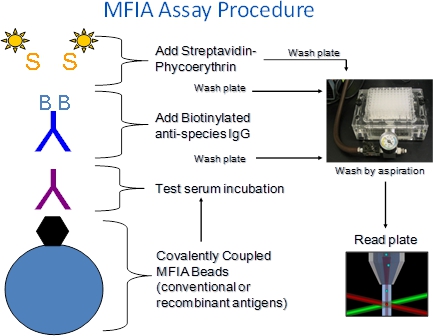
Figura 1. Procedimiento MFIA. El MFIA xMAP basado es un microarray de suspensión que utiliza códigos de colores de poliestireno 5,6 micras perlas a que los antígenos (o controles) están unidas covalentemente. Desde las perlas vienen en 100 conjuntos de colores diferentes, tantos como 100 diferentes ensayos se pueden realizar en un paso de pocillo de ensayo individuales se llevan a cabo en placas de microtitulación de fondo de filtro de modo que perlas pueden ser lavadas por aspiración en un colector de vacío. Las reacciones se leen con el Luminex xMAP 100 fluorómetro. La intensidad de phycoerytINDH fluorescencia se informa como un medio de índice de fluorescencia (MFI)
2. Antes de empezar Tenga en cuenta lo siguiente:
- Las cuentas MFIA son sensibles a la luz
- Limitar la cantidad de exposición a la luz directa es crucial. La cantidad normal de exposición a la luz que se produce durante las pruebas de rutina es aceptable pero la exposición prolongada puede conducir al fotoblanqueo de las perlas que hacen que no puedan leerse por el lector de ensayo.
- Es crucial para el éxito de la prueba de que las perlas MFIA siempre se agitaron en la suspensión y luego se sonicó (10-30 segundos) antes de su uso.
- El lector ensayo recopila información de cuentas individuales solamente. Grupos agregados de cuentas puede llevar a leer más veces.
- Asegúrese de mantener la placa de ensayo cubre con la tapa de la placa durante todas las etapas de incubación para evitar la evaporación de las soluciones de ensayo.
- Equipo de protección personal requerido: Laboratorio de abrigo, glOves y protección para los ojos se deben usar en todo momento mientras se trabaja en un laboratorio.
3. Reactivos
- La Tabla 1 incluye la mayor parte de los materiales necesarios para establecer un laboratorio interno MFIA. Los artículos adicionales o duplicados puede ser necesaria en función de sus necesidades específicas. Tenga en cuenta que este inventario no incluye reactivos adquiridos de Charles River (MFIA cuentas, controles y reactivos suplementarios). Varias fuentes comerciales de conjugados con biotina y estreptavidina ficoeritrina etiquetados están disponibles. Sin embargo, los reactivos disponibles de Charles River han sido ajustada para dar la señal óptima a la puntuación de ruido con nuestros reactivos, utilizando proveedores alternativos o lotes de reactivos no se recomienda.
Tabla 1. CR-RADS utiliza un lector de suspensión Matriz BioPlex de BioRad y lavador de microplacas automático de BioTek. Instrumentación equivalente está disponible de proveedores alternos.
Artículo Vendedor Número de Catálogo Equipo Suspensión lector array * BioRad 171-000205 96-así lavador de microplacas BioTek ELX50/8FMW Limpiador ultrasónico / baño Cole Palmer EW0884900 Mezclador de vórtice analógica VWR 58816-121 -20 ° C congelador Vario 4 ° C refrigerador Vario Pipeta de 12 canales, 20-200μl VWR 83009-718 Orbital agitador de placas VWR / Lab-Line 57019-600 Pipetas monocanal, 20-200μl, con consejos VWR 83009-732 Pipetas monocanal, 2-20μl, con consejos VWR 83009-726 Pipetas monocanal, 100-1000μl, con consejos VWR 83009-736 Vacushield dispositivo de ventilación VWR 55095-006 Bomba de vacío de presión VWR 54908-037 Sistema de vacío depósito de residuos VWR 80200-640 Desechables De 96 pocillos placa de poliestireno Fisher Scientific 14-245-145 MultiScreen HTS-BV placa, 1.2μm filtro, estireno Millipore MSBV N12 50 Tubos cónicos de 15 ml (polipropileno) Sarstedt 62554.002 Tubos de 50 ml cónicos (polipropileno) Sarstedt 62547.004 Los viales de suero Sarstedt 72694.007 Lámina de aluminio VWR 89079-068 Botellas de 1 litro, estéril VWR 28199-246 0.22μm mejores filtros de botella VWR 28199-307 Reservorios de reactivos (100 ml) VWR 82026-356 5ml, 10ml, 25ml pipetas para dispensar reactivos líquidos VWR Reactivos PBS, pH 7,4 1 BSA, polvo (bolsas) Sigma P3813 ProClin 300 Sigma / Supelco 48912-U Sin revestir microesferas Luminex variarse en función del tipo
4. Preparación de los reactivos
- Dos tampones son necesarios para el procedimiento MFIA. Diluyente primario está disponible a partir de Charles River y contiene propietarias agentes bloqueantes para disminuir las interacciones no específicas proteínas. Tampón de ensayo de lavado se hace en su centro con reactivos disponibles comercialmente.
- Ensayo Tampón de lavado: PBS / 1% BSA pH 7,4 está disponible como un polvo de Sigma-Aldrich.
- Eliminación de las partículas por filtración es crítico ya que estas partículas puede conducir a obstrucciones en el lector de ensayo. Filtrar la memoria intermedia a través de una botella-top 0.2micron unidad de filtro en recipientes esterilizados y etiquetados.
- BAG y SPE se diluyó a su concentración 2X de trabajo en tampón de ensayo de lavado. Nota: SPE es sensible a la luz y shía tiene exposición a la luz limitada.
5. Preparación de la muestra
- Reúna sus materiales de prueba, reactivos y material desechable.
- Micropipetas múltiples y de un solo canal y consejos
- De 96 pocillos bajo las placas de microtitulación de proteínas de unión (diluciones de suero) y las placas de filtro de fondo (ensayo MFIA)
- Recoger muestras de sangre de acuerdo con el procedimiento estándar. Permitir que las muestras de sangre para coagular completamente por el mantenimiento a temperatura ambiente durante al menos 30 minutos antes de la centrifugación y eliminación del suero. Undilute suero en un vórtex brevemente para mezclar los componentes del suero antes del muestreo.
- La dilución final de pruebas para la MFIA es 1/50. Es necesario hacer una 2X (1/25) muestra de suero de prueba para el ensayo. Diluir los sueros de prueba sin diluir mediante la adición de 1 parte de suero a 24 partes de diluyente MFIA primaria. Organización de su suero de ensayo en una placa de microtitulación de 96 pocillos reduce en gran medida el tiempo de transferencia de las muestras a los TESt placa y es muy recomendable.
6. Preparación de pruebas Plate
- Pre-mojar la placa de ensayo de 96 pocillos se requiere para asegurar adecuada, incluso así evacuación. Incluso si toda la placa no se utilizará este paso se requiere inicialmente, no se tendrá que añadir reactivo posterior o el tampón de lavado a los pocillos vacíos.
- Algunos laboratorios ejecutar menos de un total de 96 pocillos mediante el cierre de los pocillos no utilizados en la placa de prueba y el plan de reutilizar estos pozos en una fecha posterior. No se recomienda el uso de este método, ya que puede afectar a la filtración adecuada de la placa de prueba.
- Aspiración apropiada placa de ensayo es crucial para el éxito del ensayo MFIA. La evacuación de los pozos de la muestra debe tomar aproximadamente 5-10 segundos. La aspiración del contenido así demasiado rápidamente puede llevar a talón agregación y lentos tiempos de lectura al final del ensayo.
- Seque la cara inferior de la placa de ensayo con toallas de papel después de cada wpaso ceniza para asegurar el drenaje de líquido se ha detenido. Si no se seque la placa de ensayo se puede llevar a efecto de mecha reactivos líquidos fuera de los pocillos durante la incubación y el resultado en su defecto de cabra anti-especie y / o especies puntuaciones de IgG de talón. Estas bolas están diseñados para puntuación dentro de un rango predeterminado MFI cuando la cantidad apropiada de suero primario y reactivos marcados se añaden a cada pocillo.
7. MFIA bolas Preparación Suspensión
- Es crucial para el éxito de la prueba de que las perlas se sometieron a vórtice y se sonicó siempre antes de su uso. El lector ensayo recopila información de cuentas individuales solamente, los agregados de cuentas o grupos puede llevar a leer más veces.
- Vortex la acción unida cordón de suspensión (típicamente 10 ± 5 segundos)
- Resuspender las perlas seguido de sonicación en un baño sonicador durante 10-20 segundos.
- Diluir la suspensión madre 20X 2X a una suspensión de trabajo perla en el diluyente de Primaria. Dispensar 50μl de la suspensión de microesferas 2Xa cada pocillo de ensayo de la placa de prueba usada en húmedo.
8. La adición de sueros de ensayo y de control a la placa de ensayo
- Pipetear 50μl de cada prueba 2X y suero de control a la placa de prueba basado en el mapa de placa predefinida. Asegure la tapa a la placa con una banda elástica o papel de aluminio e incubar la placa de prueba para 60 minutos en un agitador orbital, en la oscuridad a temperatura ambiente.
- La velocidad de agitación debe ser mayor que 400 pero menor que 700rpm. Es crítico que las perlas se mantienen en suspensión para permitir que los anticuerpos en suero acceder a todas las superficies de los antígenos acoplados. Si no mantiene las perlas suspendidas se traducirá en bajas puntuaciones de IgG de control de talón y el ensayo tendrá que ser repetida.
9. Lavado de la placa de ensayo
- Aspirar el contenido de los pocillos utilizando un colector de vacío. La evacuación de los pozos de la muestra debe tomar aproximadamente 5-10 segundos.
- Seque la cara inferior de la placa de ensayo con papetoallas después de cada r para asegurar el drenaje de líquido se ha detenido.
- Volver a suspender las bolas en 50μl de tampón de ensayo de lavado. Es importante que las perlas no se les permite secarse durante el proceso de ensayo.
10. Adición de BAG y SPE a la placa de ensayo
- Dispensar 50μl de la bolsa 2X dilución de trabajo a todos los pozos que contienen granos MFIA. Asegurar la tapa a la placa con una banda elástica o papel de aluminio. Incubar la placa de ensayo de 30 minutos con agitación como anteriormente, en la oscuridad a temperatura ambiente.
- Después de esta incubación, lavar la placa de ensayo y se resuspenden las perlas con tampón de ensayo de lavado como se ha descrito previamente después de la adición de suero.
- Dispensar 50μl de SPE 2X dilución de trabajo a todos los pozos que contienen granos MFIA. Asegurar la tapa a la placa con una banda elástica o papel de aluminio. Incubar la placa de ensayo de 30 minutos con agitación como anteriormente, en la oscuridad a temperatura ambiente.
- Después de este incubación lavar la placa de prueba y volver a suspender las bolas con 125μl de tampón de ensayo de lavado y agitar la placa durante aproximadamente dos minutos para volver a suspender las bolas antes de colocar en el lector de ensayo.
11. Lectura de la placa de prueba
- Coloque la placa de ensayo en el lector de ensayo dentro de los 10 minutos de resuspensión de las cuentas. En el caso de un fallo de alimentación o el otro incidente, la placa de ensayo se pueden almacenar a temperatura ambiente en la oscuridad hasta 12 horas hasta que esté listo para leer.
- Observar la muestra primero bien para verificar que el panel de talón seleccionado coincide con el perfil del cordón en los pocillos de ensayo. Si hay cuentas que quedan fuera 'de la región perla' su designado en la pantalla del protocolo, una selección de perfiles correctos se ha hecho.
- Si las cuentas han sido debidamente resuspendió deben rellenar sus especificadas "regiones" se indica en el programa de lectura de ensayo.
- Si las cuentas se agregan llenarán en sus regiones a un ritmo lentotasa. Puede quitar la placa de la prueba del lector y manualmente resuspender los pozos. Se tritura cada pocillo con una pipeta multicanal 3-4 veces para ayudar a romper los agregados de talón. Vuelva a colocar la placa de ensayo en el lector y continuar.
12. Los resultados representativos
- Un número mínimo de perlas se leen por ensayo y la intensidad de fluorescencia de la ficoeritrina se informa como una media de índice de fluorescencia (MFI) en el intervalo de 0 a 32.667. Después de comparar los recuentos de 25, 50 o 100 perlas por bien no vimos ninguna diferencia estadística rutinaria y contar 25 perlas por agente por pocillo de muestra. Examinar el informe de resultados de los errores, como la insuficiencia de los recuentos de cuentas o en su defecto IgG / anti-IgG partituras de cuentas. Estas bolas están diseñados para "puntuación" dentro de un rango predeterminado MFI cuando la cantidad apropiada de suero primario y reactivos marcados se añaden a cada pocillo. Pozos de muestra con errores, (bajo recuento de grano) o en su defecto IgG puntajes de control de cuentas deberepetirse para adquirir resultados válidos.
- Exportar los resultados a una hoja de cálculo de Excel. Para nuestra interpretación de los datos de cada ensayo se le asigna:
- Un Tejido de control (TC) de la prueba: Para la mayoría de los ensayos de roedores MFIA, el control de los tejidos es un extracto de células de tipo salvaje insecto infectadas con baculovirus.
- Un corte del ensayo: Este valor es la fluorescencia mínima esperada y se ajusta para cada ensayo para maximizar la precisión del diagnóstico. Para la mayoría de los ensayos, el punto de corte de fluorescencia es 3000.
- Índice de Net fluorescencia media (MFI) se calcula para cada ensayo (excepto tejido y pruebas de IgG de control) por la siguiente fórmula. En otras palabras, la señal de ensayo específico es el total de ensayo de MFI menos el MFI TC (background) Este valor se divide por 1000 que simplemente establece el rango de Net MFI entre 0-32 en lugar de 0-32,667.
Net MFI = (Ensayo MFI Antibody - Control IMF Tissue) / 1000
Nordestet MFI MFI TC y se convierten en las puntuaciones en comparación con el corte del ensayo específico para cada antígeno.
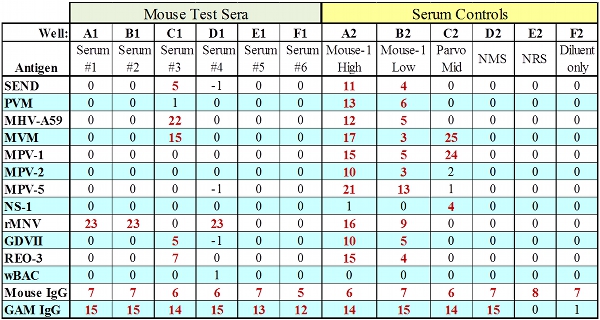
Figura 2. MFIA datos representativos de todos los sueros con IgG controles de paso.
- 12,4 MFIA Interpretación
- Los resultados del ensayo de placas sólo se debe interpretar si el sistema de control-Adecuación y control de suero (IgG / perlas anti-IgG) resultados cumplen con los criterios de aceptación indicados en la Tabla 2. La falta de estos dos bolas de control de IgG puede indicar varios errores de procedimiento tales como la dilución indebida o conjugado volumen insuficiente o dilución SPE, prueba inadecuada suero o el uso de suero de un animal immunocomprimised.
Tabla 2
Criterios de aceptación para probar controles Controle Resultado aceptable Puntuación Clasificación Alto Rango suero inmune ≥ 4,5 Positivo Rango Bajo suero inmune ≥ 1,5 ≥ Borderline Suero no inmune <2,5 ≤ Borderline Diluente <2,5 ≤ Borderline Ig Bead Set * ≥ Cutoff/1000 Pasar * Bolas fijado recubierto con especies específicas anti-suero de inmunoglobulina (Ig): Los resultados de defecto para este control de la idoneidad de la muestra podría resultar de la adición de muestra insuficiente, demasiado alta una dilución de la muestra, las especies incorrectos o suero de prueba a partir de un inmunodeficiente host.
- Si alguno de los controles de análisis de prueba fallan Plate excepto el suero inmune de alta gama, los resultados no son aceptables y deben repetirse. Pasando puntuaciones bajas gama de suero de control son fundamentales ya que demuestra el nivel de sensibilidad de detección de la placa de prueba.
- La cabra anti-IgG especies puntuación de talón se basa en la cantidad de suero de ensayo primario añadido al ensayo. Si este cordón de control falla, pero el IgG especie pasa (Bueno B1, Fig. 3) entonces indica que suficientes reactivos de prueba (BAG, SPE) se añadieron a la prueba del pozo y es una cuestión relacionada con suero. Si la cantidad de reactivos de prueba es insuficiente en un pozo en particular tanto la IgG y anti-IgG de bolas de control se producirá un error (E1 Bueno, Fig.3).
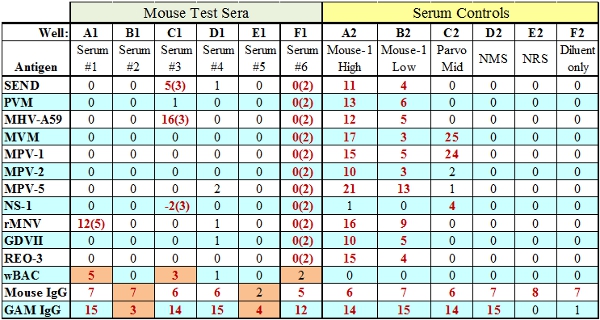
Figura 3. Representante MFIA resultados de la prueba con fallos (indicados en color naranja). Wells A1, C1 y F1 indicar una TC (reactiva del tejido) falladonde la puntuación TC está representado entre paréntesis. Wells B1 y E1 ilustran los dos tipos de fallos de IgG de control interno, de anticuerpos de prueba insuficiente (B1) o reactivos de ensayo (E1) BAG / SPE, respectivamente.
- Si los resultados de prueba de la placa de control del ensayo son satisfactorios, las puntuaciones individuales del ensayo se clasifican como se indica en la Tabla 3. Es muy importante confirmar cualquier hallazgo positivo limítrofe o por un método alternativo.
Tabla 3
MFIA Clasificación Score Puntuación Clasificación TC Neto TC + * Net ≥ 2 <0,5 <2,5 Negativo (-) ≥ 0,5 ≥ 2,5 TC de reacción (T) <2 <1,5 - 1,5 ≤ X <2,5 Borderline (B) ≥ 2,5 Positivo (+) * Una clasificación de negativo todavía se puede determinar con una puntuación distinta de cero siempre que el TC TC + puntuación neta (= puntuación de Ag) es negativo
- Los resultados del ensayo de placas sólo se debe interpretar si el sistema de control-Adecuación y control de suero (IgG / perlas anti-IgG) resultados cumplen con los criterios de aceptación indicados en la Tabla 2. La falta de estos dos bolas de control de IgG puede indicar varios errores de procedimiento tales como la dilución indebida o conjugado volumen insuficiente o dilución SPE, prueba inadecuada suero o el uso de suero de un animal immunocomprimised.
Discusión
El proceso de prueba MFIA es altamente eficiente, que requiere menos equipo y más pequeño de la muestra y volúmenes de reactivo de pruebas singleplex tradicionales. La funcionalidad del sistema multiplex le da al usuario la flexibilidad de pantalla de forma simultánea de múltiples cepas o serotipos de agentes comunes en roedores de laboratorio (es decir, Coronavirus, parvovirus, etc.) Esto también nos permite, para diseñar a medida los paneles de talón sobre la base de la zona de interés (es decir, virus de la familia específica) y es adaptable a otros tipos de detección de biomoléculas que incluyen citoquinas y otros biomarcadores. Además, permite incorporar varios ensayos de control interno para verificar la muestra y la idoneidad del sistema y de ese modo asegurar la exactitud de los resultados. Éstos incluyen el control de tejido e IgG anti-inmunoglobulina de ensayo especies suero (αIg) recubiertos juegos de microesferas para evaluar la idoneidad de la muestra. Un tejido bola de control detecta la unión no específica de inmunoglobulina del suero y el control αIg talón confirmaque se ha añadido suero y contiene una concentración suficiente de inmunoglobulina. Otra perla de control, revestido con inmunoglobulina especies suero, demuestra que los reactivos marcados y lector de ensayo están funcionando correctamente. Otros comercialmente disponibles múltiplex ensayos serológicos formato (microarrays ie., ImmunoComb) no pueden ofrecer el mismo nivel de confirmación de resultados.
La posibilidad de reducir el posible origen de la insuficiencia ensayo antes de la repetición de pruebas puede ayudar a un investigador ahorrar en tiempo y materiales. Aspectos críticos de la MFIA debe ser confirmado antes de repetir una muestra fallado. Dado que el ensayo se realiza a temperatura ambiente se debe verificar que la temperatura de laboratorio es de aproximadamente 27 ° C ± 2 ° C, las temperaturas más altas pueden conducir a la disminución de las puntuaciones esperadas para controles y muestras. Lavadora es quizás el paso más crítico en el ensayo. Asegurando que la placa de prueba se lavó correctamente, se secan y se resuspendieron puede eliminarla gran mayoría de errores de muestreo debido a recuento bajo de talón (debido a las perlas de agregados) o adición de reactivo insuficiente (perdido por efecto de mecha de prueba de la placa inferior del filtro). En forma rutinaria contar 25 perlas por ensayo (agente) y no han encontrado diferencias estadísticamente significativas en los resultados contando mayor número de cuentas que también dará lugar a un mayor tiempo de lectura de la placa.
Hemos llevado a cabo estudios exhaustivos de validación de MFIA en varias especies de animales de laboratorio de uso común (ratón, rata, hámster, cobaya y conejo) para demostrar la precisión diagnóstica, la reproducibilidad, la robustez y poniendo a prueba un gran número de muestras conocidas de suero positivo y negativo, y comparando su ELISA, IFA y los resultados MFIA. Los límites de detección (es decir, los criterios de valoración estándar de titulación del suero inmune) de MFIA fueron comparables a, y en algunos casos superaron, los de ELISA correspondiente. Especificidad de diagnóstico, medida con roedores SPF sueros, superó el 99%, el betwee correspondencia generaln ELISA y MFIA a cabo en sueros conocidos positivos y negativos conocidos fue mayor que 95%. En resumen, estos resultados demostraron que MFIA multiplex es una buena alternativa para el ELISA singleplex, y es adecuado para su uso previsto, es decir, en serovigilancia rutina de colonias de animales de laboratorio.
Divulgaciones
Todos los autores trabajan por Charles River RADS, un importante proveedor de servicios de pruebas serológicas de animales y reactivos.
Agradecimientos
La investigación presentada aquí fue apoyada por Charles River.
Referencias
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados