Method Article
Multiplexed Fluorometric Immunoassay Testing Methodology und Fehlerbehebung
In diesem Artikel
Zusammenfassung
Mit Luminex Corporation xMAP-Mikrokugel-Technologie haben wir die Multiplex Fluorometric Immunoassay (MFIA) für serologischen Überwachung von verschiedenen Labors Tierarten entwickelt. Die MFIA ist eine Suspension Microarray, wo Antigen, Gewebekontrolle oder Immunglobuline kovalent an farbkodierten Polystyrol-Mikrokügelchen verbunden sind. Die MFIA Prüfverfahren sowie verschiedene Themen zur Fehlerbehebung adressiert ist.
Zusammenfassung
Um die Qualität von Tiermodellen in der biomedizinischen Forschung verwendet sicherzustellen, haben wir eine Reihe von diagnostischen Tests Strategien und Methoden, um festzustellen, ob Tiere zufällige Infektionserregern (Viren, Mykoplasmen, und anderen anspruchsvollen Mikroorganismen) ausgesetzt wurden entwickelt. Infektionen von immunkompetenten Tieren im Allgemeinen vorübergehend, jedoch Serum-Antikörperantworten gegen Infektionen oft innerhalb von Tagen bis Wochen festgestellt werden und bleiben über die gesamte Lebensdauer des Wirts. Serologie ist die primäre diagnostische Methode, mit der Versuchstiere werden überwacht. Historisch die indirekter Enzym-linked Immunosorbent Assay (ELISA) ist die wichtigste Methode zur serologischen Überwachung Screening. Der ELISA ist als Singleplex durchgeführt, wobei ein mikrobielles Antigen-Antikörper-Reaktion pro Vertiefung gemessen. Im Vergleich der MFIA als gemultiplexte Assay durchgeführt. Da die Mikrokügelchen in 100 verschiedene Farbskalen kommen, können bis zu 100 verschiedene Assays simultan durchgeführt werdeneously in einem Mikrotiterplatten. Diese Innovation reduziert die Menge an Serum, Reagenzien und Verbrauchsmaterialien für Routinetests erforderlich, während die Erhöhung der Menge von Informationen aus einem einzigen Test gut erhalten. Darüber hinaus sind wir in der Lage, mehrere interne Kontrollsystem Perlen integrieren, um Probe und System Eignung zu überprüfen und dadurch sicherzustellen, die Genauigkeit der Ergebnisse. Dazu gehören Gewebe-Steuerung und IgG-Anti-Testserum Arten Immunglobulin (αIg) beschichtete Kugel-Sets zu Probe Eignung zu bewerten. Wie in den ELISA und IFA detektiert der Gewebekontrolle unspezifische Bindung von Serum-Immunglobulin. Die αIg Steuerung (Serum-Steuerung) bestätigt, dass das Serum wurde hinzugefügt und enthält eine ausreichende Immunglobulinkonzentration während die IgG-Kontrolle Wulst (System Suitability Kontrolle), mit Serum Arten Immunglobulin beschichtet, zeigt, dass die markierten Reagenzien und Luminex Leser ordnungsgemäß funktionieren.
Protokoll
Ein. Erläuterung der Vorgehensweise MFIA (Abbildung 1)
- Die MFIA erfordert Charles River Antigen beschichtete Polystyrol-Mikrosphären (Beads), Testseren markierten Reagenzien (BAG, SPE) und Puffer (Primary Diluent, Assay-Puffer).
- Die Reagenzien werden schrittweise zugegeben, um die Vertiefungen von 96-Well-Filterplatte-Mikrotiterplatten.
- Die MFIA durchgeführt wird, wie ein heterogener Test Bedeutung Inkubationen durch Filter-wash Schritte befolgt werden, um ungebundene Serum Bestandteile zu entfernen oder Reagenzien markiert. Waschlösung hinzugefügt Plattenvertiefungen wird durch Absaugen durch gut filter-Böden, die die Perlen behalten entfernt.
- Die MFIA Assays werden bei Raumtemperatur (27 ° C + / -2 ° C) durchgeführt.
- Antigen-Antikörper-Komplexe während der Testserum Inkubationsschritt gebildet werden durch Inkubationen mit biotinyliertem Ziege-Anti-Spezies-Konjugate (BAG) von R-Phycoerythrin-markiertem Streptavidin (SPE) gefolgt detektiert.
- In dem Assay-Leser durchlaufen die Kugeln einzeln durcheinen Detektor, wo sie zwei Laser ausgesetzt sind. Einen Laser erregt die internen Farbstoffe, daß der Wulst die Farbpalette, die ein Assay entspricht identifizieren, die andere erregt das Phycoerythrin Reporterfarbstoff während des Assays erfasst. Eine vorbestimmte Anzahl von Kügelchen pro Assay gelesen und die Intensität der Phycoerythrin-Fluoreszenz wird als Median Fluoreszenz (MFI) berichtet.
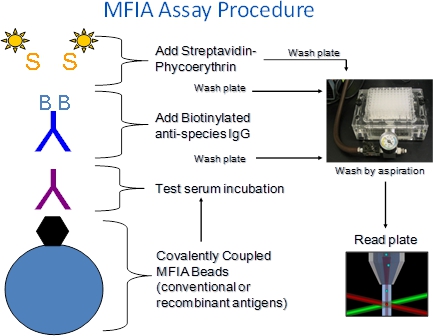
Abbildung 1. MFIA Vorgehensweise. Die xMAP-basierten MFIA ist eine Suspension Microarray, die farbcodierten Polystyrol 5,6 Mikron Perlen denen Antigene (oder Kontrolle) kovalent verknüpft sind verwendet. Da die Kügelchen in 100 verschiedene Farbskalen kommen, können bis zu 100 verschiedenen Assays in einem einzigen Assay gut Schritte durchgeführt werden in Filter-Mikrotiterplatten durchgeführt, so dass Perlen können durch Absaugen auf einem Vakuumverteiler gewaschen werden. Die Reaktionen werden mit der Luminex xMAP 100 Fluorometer gelesen. Die Intensität phycoerythrin Fluoreszenz wird als mittlere Fluoreszenz (MFI) gemeldet
2. Vor der Inbetriebnahme ist folgendes zu beachten:
- Die MFIA Perlen sind lichtempfindlich
- Begrenzen der Menge der direkten Belichtung ist entscheidend. Die normale Menge an Licht, Belichtung, während der Routineprüfung auftritt, ist akzeptabel, aber bei längerer Exposition kann zu Ausbleichen der Perlen, die sie unlesbar durch die Assay-Leser machen führen.
- Es ist entscheidend für den Erfolg des Assays, dass die Kügelchen MFIA immer in Suspension verwirbelt und dann mit Ultraschall behandelt (10-30 Sekunden) vor der Verwendung.
- Der Assay-Reader sammelt Informationen aus einzelnen Perlen nur. Aggregierte bead Clustern kann dazu führen, mehr gelesen Zeiten.
- Seien Sie sicher, dass die Testplatte mit der Platte Deckel abgedeckt bei allen Inkubationen zu halten, um die Verdampfung von Assay Lösungen zu vermeiden.
- Persönliche Schutzausrüstung erforderlich: Laborkittel, gloves und Augenschutz muss jederzeit getragen werden während der Arbeit im Labor.
3. Reagenzien
- Tabelle 1 enthält die meisten der notwendigen Materialien, um eine in-house MFIA Labor zu etablieren. Zusätzliche oder doppelte Elemente kann notwendig sein, je nach Ihren spezifischen Anforderungen. Bitte beachten Sie, dass dieses Inventar Reagenzien von Charles River (MFIA Perlen, Kontrollen und zusätzliche Reagenzien) gekauft ausschließt. Mehrere kommerzielle Quellen biotinylierte Konjugate und Streptavidin markiert Phycoerythrin zur Verfügung. Allerdings sind die erhältlichen Reagenzien von Charles River wurden titriert, um die optimale Signal-Rausch-Punktzahl erzielen mit unseren Reagenzien, mit alternativen Anbietern oder Reagenzienchargen wird nicht empfohlen.
Tabelle 1. CR-RADS verwendet eine BIOPLEX Suspension Array Reader von BioRad und automatisierte Waschgerät von BioTek. Equivalent Instrumentierung ist von alternativen Anbietern.
Artikel Verkäufer Catalog Number Ausrüstung Suspension Array Reader * BioRad 171-000205 96-well Mikroplatten-Washer BioTek ELX50/8FMW Ultraschallreiniger / Bad Cole Palmer EW0884900 Analog Wirbelmischer VWR 58816-121 -20 ° C Gefrierschrank Verschiedene 4 ° C Kühlschrank Verschiedene 12-Kanal-Pipette, 20-200 ul VWR 83009-718 Orbital Schüttler VWR / Lab-Line 57019-600 Einkanal-Pipetten, 20-200 ul, mit Tipps VWR 83009-732 Einkanal-Pipetten, 2-20 ul, mit Tipps VWR 83009-726 Einkanal-Pipetten, 100-1000μl, mit Tipps VWR 83009-736 Vacushield Entgasungsvorrichtung VWR 55095-006 Vacuum-Pumpe VWR 54908-037 Vakuum-System Abfallbehälter VWR 80200-640 Disposables 96-well Polystyrol Platte Fisher Scientific 14-245-145 MultiScreen HTS-BV Platte, 1.2μm Filter, Styrol Millipore MSBV N12 50 15 ml konische Röhrchen (Polypropylen) Sarstedt 62554.002 50 ml konische Röhrchen (Polypropylen) Sarstedt 62547.004 Serumampullen Sarstedt 72694.007 Aluminiumfolie VWR 89079-068 1L, sterile VWR 28199-246 0,22 &mgr; m Bottle-Top-Filter VWR 28199-307 Reagenz-Reservoirs (100ml) VWR 82026-356 5ml, 10ml, 25ml Pipetten zur Abgabe flüssigen Reagenzien VWR Reagenzien PBS, pH 7,4 1 BSA, Pulver (Beutel) Sigma P3813 ProClin 300 Sigma / Supelco 48.912-U Unbeschichteten Mikrokügelchen Luminex variiert basierend auf Typ
4. Vorbereitung der Reagenzien
- Zwei Puffer für die MFIA Verfahren gebraucht werden. Primäre Diluent ist erhältlich von Charles River und enthält geschützte Blockierungsmittel um nicht-spezifische Protein-Wechselwirkungen zu verringern. Assay Waschpuffer ist bei Ihnen vor Ort mit handelsüblichen Reagenzien hergestellt.
- Assay Waschpuffer: PBS / 1% BSA pH 7,4 ist als Pulver von Sigma-Aldrich.
- Entfernung von Partikeln durch Filtration ist kritisch, da diese Partikel zu Verstopfungen in den Assay-Leser führen kann. Filtern Sie die Puffer durch eine 0.2micron Bottle-Top-Filter-Einheit in sterile, gekennzeichneten Behältern.
- BAG und SPE an ihre 2X arbeiten Konzentration im Assay Waschpuffer verdünnt. Hinweis: SPE ist lichtempfindlich und should haben begrenzte Belichtung.
5. Probenvorbereitung
- Setzen Sie Ihre Prüfung Materialien, Reagenzien und Verbrauchsmaterialien.
- Multi-und Single-Kanal Pipetten und Spitzen
- 96-well geringe Proteinbindung Mikrotiterplatten (Serumverdünnungen) und Filter-Bodenplatten (MFIA assay)
- Sammeln von Blutproben nach Ihren Standard-Verfahren. Lassen Sie die Blutproben zur Gerinnung vollständig, indem Sie sie bei Raumtemperatur für mindestens 30 Minuten vor der Zentrifugation und Serum Entfernung. Undilute Serum sollte kurz gevortext werden, um die Serum-Komponenten vor der Probenahme zu mischen.
- Die Endprüfung Verdünnung für die MFIA ist 1/50. Es ist notwendig, ein 2X (1/25) Probe Ihrer Testserum für den Assay zu machen. Verdünnen Sie das unverwässerte Testseren durch Zugabe von 1 Teil Serum zu 24 Teile MFIA Primäre Diluent. Organisation Ihrer Testserum in einer 96-well Mikrotiterplatten reduziert die Übertragungszeit Ihrer Proben zu den test Platte und wird dringend empfohlen.
6. Prüfplatte Vorbereitung
- Pre-Benetzung der 96-well Prüfplatte ist verpflichtet, ordnungsgemäße, auch gut Evakuierung zu versichern. Selbst wenn die gesamte Platte nicht benutzt wird dieser Schritt zunächst erforderlich ist, werden Sie nicht haben, um nachfolgende Reagenz hinzuzufügen oder Waschpuffer zu den leeren Brunnen.
- Einige Labors laufen weniger als eine volle 96-Well-Platte durch die Abdichtung der unbenutzten Vertiefungen auf der Testplatte und planen, wieder verwenden diese Brunnen zu einem späteren Zeitpunkt. Wir empfehlen nicht mit dieser Methode, da sie die richtige Filtration der Testplatte beeinträchtigen können.
- Proper Testplatte Bestreben ist entscheidend für den Erfolg des MFIA Assay. Evakuierung der Probenbehälter sollte ca. 5-10 Sekunden. Absaugen des Inhalts auch zu schnell zu Wulst kann Aggregation und langsamen Lesezeiten am Ende des Assays führt.
- Tupfen Sie die Unterseite der Testplatte mit Papiertüchern nach jedem wash Schritt Flüssigkeitsablauf sicher gestoppt hat. Bei Nichtbeachtung der Testplatte auslöschen können Flüssigreagenzien Dochtwirkung aus den Wells während Inkubation und Ergebnis in Ermangelung Ziege anti-Arten und / oder Arten IgG bead Noten führen. Diese Kügelchen sind Wertung innerhalb eines vorbestimmten Bereichs, wenn der MFI geeignete Menge von primären Serum und markierten Reagenzien zu jedem Well zugegeben gestalten.
7. MFIA Bead Suspension Vorbereitung
- Es ist entscheidend für den Erfolg des Assays, dass die Perlen immer gevortext und vor der Verwendung mit Ultraschall behandelt. Der Assay-Reader sammelt Informationen aus einzelnen Perlen nur kann bead Aggregate oder Klumpen führen zu längeren Lesezeiten.
- Vortex die Aktie gekoppelt Partikelsuspension (typischerweise 10 ± 5 Sekunden)
- Resuspendieren der Beads durch Beschallung in einem Ultraschallgerät Bad für 10-20 Sekunden.
- Verdünnen Sie die 20X Stoffsuspension zu einer 2X arbeiten Partikelsuspension in Primary Diluent. Dispense 50 ul des 2X Kügelchensuspensionjedem Well der Assay vorbefeuchtenden Testplatte.
8. Neben der Test-und Kontrollseren auf die Testplatte
- Pipette 50 ul jedes 2X Test-und Kontroll-Serum auf die Testplatte auf Ihrem vordefinierten Platte Karte basiert. Sichere Deckel auf die Platte mit einem Gummiband oder Aluminiumfolie und inkubieren Sie den Test Platte für 60 Minuten auf einem Schüttler, im Dunkeln bei Raumtemperatur.
- Der Schüttler Drehzahl sollte größer als 400, aber weniger als 700U/min. Entscheidend ist, dass die Kügelchen in Suspension gehalten werden, damit Serumantikörpern an allen Oberflächen der gekoppelten Antigene übersetzen. Failure zu halten die Perlen ausgesetzt wird bei niedrigen IgG bead Kontrollkerben führen und der Test muss wiederholt werden.
9. Waschen der Testplatte
- Absaugen auch Inhalte über eine Vakuumkammer. Evakuierung der Probenbehälter sollte ca. 5-10 Sekunden.
- Tupfen Sie die Unterseite der Testplatte mit paper Handtücher nach jedem flüssige Entwässerung sicherzustellen, hat aufgehört.
- Resuspendieren der Beads in 50 ul Assay Waschpuffer. Wichtig ist, dass die Kügelchen nicht austrocknen während des Assays Prozess.
10. Hinzufügen BAG und SPE auf die Testplatte
- Dispense 50 ul 2X Gebrauchsverdünnung BAG in alle Vertiefungen mit MFIA Perlen. Sichern Sie den Deckel auf die Platte mit einem Gummiband oder Aluminiumfolie. Inkubieren Sie die Test-Platte für 30 Minuten unter Schütteln wie oben in der Dunkelheit bei Raumtemperatur.
- Nach dieser Inkubation der Testplatte und resuspendieren die Perlen mit Assay Waschpuffer wie zuvor nach Serumzugabe beschrieben.
- Dispense 50 ul 2X Gebrauchsverdünnung SPE in alle Vertiefungen mit MFIA Perlen. Sichern Sie den Deckel auf die Platte mit einem Gummiband oder Aluminiumfolie. Inkubieren Sie die Test-Platte für 30 Minuten unter Schütteln wie oben in der Dunkelheit bei Raumtemperatur.
- Nach dieser incubation waschen Sie den Test Plate und resuspendieren Perlen mit 125μl Assay-Waschpuffer und schütteln Sie die Platte für ~ 2 Minuten, um die Perlen vor dem Einsetzen in die Assay-resuspendieren.
11. Lesen Sie den Test Platte
- Legen Sie die Testplatte in die Assay-Reader innerhalb von 10 Minuten Resuspendieren der Beads. Im Falle eines Stromausfalls oder anderen einfallenden kann die Testplatte bei Raumtemperatur in der Dunkelheit bis zu 12 Stunden, bis zum Lesen bereit gespeichert werden.
- Beachten Sie die erste Probe auch um sicherzustellen, dass das ausgewählte Perlen Panel den Wulst Profil in den Testvertiefungen übereinstimmt. Wenn es Perlen, die außerhalb von ihnen benannten "Wulstbereich 'auf dem Protokoll sehen sind, hat ein falsches Profil Auswahl getroffen.
- Wenn die Perlen richtig resuspendiert haben sie füllen in ihrer spezifizierten "Regionen" im Assay-Reader-Software angezeigt.
- Wenn die Perlen aggregiert werden, werden sie in ihren Regionen mit einer langsamen füllentarif. Sie können die Testplatte aus dem Lesegerät entfernen und manuell resuspendieren Brunnen. Verreiben jede Vertiefung mit einem Multi-Kanal-Pipette 3-4 mal in Aufbrechen der Raupe Aggregate unterstützen. Ersetzen Sie die Testplatte in das Lesegerät und fortzufahren.
12. Repräsentative Ergebnisse
- Eine minimale Anzahl von Kügelchen pro Assay gelesen und die Intensität der Phycoerythrin-Fluoreszenz wird als Median Fluoreszenz (MFI) im Bereich von 0 bis 32.667 gemeldet. Nach einem Vergleich der Grafen von 25, 50 oder 100 Perlen pro Well sahen wir keinen statistischen Unterschied und routinemäßig zählen 25 Perlen pro Agent pro Probe gut. Untersuchen Sie die Ergebnisse Bericht für Fehler, wie unzureichende bead zählt oder ersatzweise IgG / Anti-IgG-Bead Partituren. Diese Kügelchen werden auf "Score" innerhalb eines vorbestimmten Bereichs, wenn der MFI entsprechende Menge an primären Serum und markierten Reagenzien zu jedem Well zugegeben gestalten. Probenvertiefungen mit Fehlern (low bead counts) oder ersatzweise IgG-Bead Scores solltenwiederholt, um valide Ergebnisse zu erwerben.
- Exportieren Sie die Ergebnisse in eine Excel-Arbeitsblatt. Für unsere Interpretation der Daten jedes Assay wird zugeordnet:
- Ein Tissue Control (TC) Test: Für die meisten Nager MFIA Assays ist das Gewebe Kontrolle einen Auszug von Wildtyp-Baculovirus-infizierten Insektenzellen.
- Ein Assay Cutoff: Dieser Wert ist die minimale Fluoreszenz erwartet und für jeden Test die diagnostische Genauigkeit zu maximieren angepasst. Für die meisten Assays, ist die Fluoreszenz Cutoff 3000.
- Net Median Fluoreszenz (MFI) für jedes Assay (ausgenommen Gewebe und IgG Kontrolltests) durch die folgende Formel berechnet. Mit anderen Worten ist die spezifischen Assay-Signal die Summe Assay MFI minus der TC (Hintergrund) MFI Dieser Wert wird dann geteilt durch 1000, die einfach setzt den Bereich von Net MFI zwischen 0-32 anstelle von 0-32,667.
Net MFI = (MFI Antibody Assay - MFI Gewebekontrolle) / 1000
Net MFI und TC MFI werden Scores durch Vergleich zur spezifischen Assay Cutoff für jedes Antigen umgewandelt.
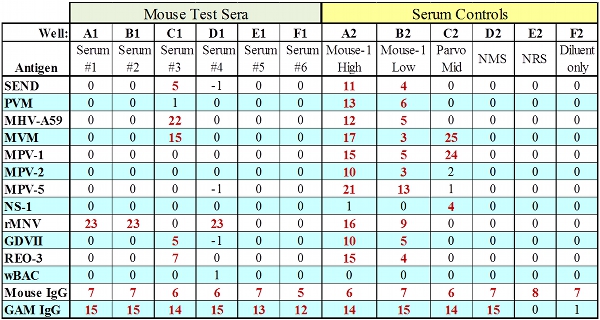
Abbildung 2. Vertreter MFIA Daten für Testseren mit allen IgG steuert vorbei.
- 12,4 MFIA Interpretation
- Prüfplatte Ergebnisse sollten nur interpretiert, wenn die System-Eignung Control und Serum Control (IgG / Anti-IgG-Beads) Ergebnisse erfüllen die Aufnahmekriterien in Tabelle 2 aufgeführt. Der Ausfall dieser beiden IgG-Kontrolle Perlen kann zeigen mehrere prozedurale Fehler wie falsche Verdünnung oder unzureichendes Volumen Konjugat oder SPE, unsachgemäße Testserum Verdünnung oder Verwendung von Serum aus einer immunocomprimised Tier.
Tabelle 2
Akzeptanzkriterien für Assay-Kontrollen Steuern Akzeptables Ergebnis Partitur Einstufung High Range Immunserum ≥ 4,5 Positiv Low Range Immunserum ≥ 1,5 ≥ Borderline Nicht-Immun-Serum <2,5 ≤ Borderline Diluent <2,5 ≤ Borderline Ig Bead Set * ≥ Cutoff/1000 Passieren * Beadset beschichtet mit artspezifischen anti-Testserum Immunglobulin (Ig): andernfalls Scores für diese Probe Eignung Kontrolle könnte durch den Zusatz von unzureichende Probe führen, zu hohe Verdünnung der Probe, fehlerhafte Arten oder Prüfungen Serum aus einer immundefizienten host.
- Wenn einer der Test-Platte Assay Bedienelemente mit Ausnahme des High Range Immunserum scheitern, sind die Ergebnisse nicht akzeptabel und muss wiederholt werden. Vorbei Low range Serumkontrolle Scores sind kritisch, da sie die Nachweisempfindlichkeit des Tests Platte zeigt.
- Der Ziege anti-Spezies-IgG Wulst errechnet sich aus der Menge des primären Test-Serum zugegeben, um den Assay basiert. Wenn dies fehlschlägt Steuerwulst aber die Art übergibt IgG (Well B1, Abb.3) dann zeigt dies an, dass genug Testreagenzien (BAG, SPE) wurden zum Test zugesetzt gut und es ist ein Serum ähnliches Problem. Wenn die Menge der Testreagenzien in einem bestimmten unzureichende auch sowohl die IgG-und Anti-IgG-Kontrolle Perlen fehl (Well E1, Abb. 3).
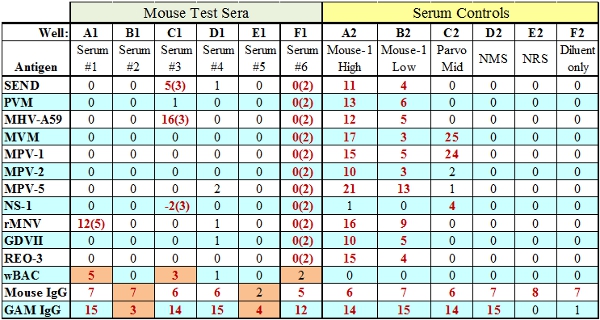
Abbildung 3. Vertreter MFIA Testergebnisse mit einem Defekt (in orange). Wells A1, C1 und F1 zeigen eine TC (Gewebe reaktive) Ausfallwo der TC score wird in Klammern dargestellt. Vertiefungen und E1 B1 veranschaulichen die zwei Arten von IgG interne Kontrolle Defekt, unzureichend Testantikörper (B1) oder Testreagenzien (E1) BAG / SPE sind.
- Wenn Testplatte Testkontrolle Ergebnisse zufrieden stellend sind, werden einzelne Assay klassifiziert, wie in Tabelle 3 gezeigt. Es ist wichtig, jede grenzwertig oder positiver Befund durch eine alternative Testmethode zu bestätigen.
Tabelle 3
MFIA Score Klassifizierung Partitur Einstufung TC Netz TC + Net * ≥ 2 <0,5 <2,5 Negative (-) ≥ 0,5 ≥ 2,5 TC Reaktion (T) <2 <1,5 - 1,5 ≤ X <2,5 Borderline (B) ≥ 2,5 Positive (+) * Eine Klassifizierung der negativen noch mit einem Nicht-Null TC score festzulegenden Zeitpunkt der TC + Net Score (= Ag score) ist negativ
- Prüfplatte Ergebnisse sollten nur interpretiert, wenn die System-Eignung Control und Serum Control (IgG / Anti-IgG-Beads) Ergebnisse erfüllen die Aufnahmekriterien in Tabelle 2 aufgeführt. Der Ausfall dieser beiden IgG-Kontrolle Perlen kann zeigen mehrere prozedurale Fehler wie falsche Verdünnung oder unzureichendes Volumen Konjugat oder SPE, unsachgemäße Testserum Verdünnung oder Verwendung von Serum aus einer immunocomprimised Tier.
Diskussion
Die MFIA Testprozess ist hoch effizient und erfordert weniger Ausrüstung und kleinere Probe und Reagenz Volumen als herkömmliche Singleplex Tests. Die Funktionalität des Multiplex-System gibt dem Benutzer die Flexibilität, um gleichzeitig zu screenen für mehrere Stämme oder Serotypen von gemeinsamen Agenten in Labornagetieren (dh Coronavirus, Parvoviren etc.). Dies ermöglicht es uns, maßgeschneiderte Perlen Panels basieren auf den Bereich von Interesse (zB spezifische Virus-Familie) entwerfen und ist anpassungsfähig an Screening andere Arten von Biomolekülen einschließlich Zytokine und andere Biomarker. Darüber hinaus ermöglicht es uns, mehrere interne Kontrollsystem Assays integrieren, um Probe und System Eignung zu überprüfen und dadurch sicherzustellen, die Genauigkeit der Ergebnisse. Dazu gehören Gewebe-Steuerung und IgG-Anti-Testserum Arten Immunglobulin (αIg) beschichtete Kugel-Sets zu Probe Eignung zu bewerten. Eine Gewebemarkiervorrichtung Steuerwulst erkennt unspezifische Bindung von Serum-Immunglobulin und das αIg Wulst Steuerung bestätigtdass Serum wurde hinzugefügt und enthält eine ausreichende Immunglobulin-Konzentration. Eine weitere Kontrolle Wulst mit Serum Immunglobulin Spezies beschichtet wird, zeigt, dass die markierten Reagentien und Assay Reader ordnungsgemäß funktionieren. Andere im Handel erhältliche Multiplex-Format serologischen Assays (zB Microarrays, ImmunoComb) nicht bieten diese gleiche Ergebnis Bestätigung.
Die Fähigkeit zu verengen die mögliche Quelle der Assay Versagen vor Nachprüfung helfen kann ein Ermittler auf Zeit und Material zu sparen. Kritische Aspekte des MFIA sollte vor der Wiederholung einer fehlgeschlagenen Probe bestätigt werden. Da der Test bei Raumtemperatur durchgeführt wird, sollte verifiziert, dass die Temperatur etwa 27 Labor ist ° C ± 2 ° C, höhere Temperaturen führen kann als erwartet Scores für Kontrollen und Proben zu senken. Waschen ist vielleicht der wichtigste Schritt im Assay. Die Versicherung, dass die Testplatte richtig gewaschen, abgetupft und resuspendiert beseitigen könnendie überwiegende Mehrzahl der Abtastfehler aufgrund einer geringen Anzahl Wulst (aufgrund aggregierten Kügelchen) oder unzureichende Reagenzzugabe (Passwort durch Dochtwirkung aus der Testplatte Filterboden). Wir routinemäßig zählen 25 Perlen pro Assay (Agent) und haben keinen statistischen Unterschied in den Ergebnissen durch Zählen höhere Anzahl von Perlen, die auch zu einer längeren Lesezeit für die Platte führen.
Wir haben umfassende Validierungsstudien MFIA auf mehrere Arten der am häufigsten verwendeten Versuchstiere (Maus, Ratte, Hamster, Meerschweinchen und Kaninchen) durchgeführt, um die diagnostische Genauigkeit, Reproduzierbarkeit und Robustheit durch das Testen einer großen Anzahl von bekannten positiven und negativen Serumproben zu demonstrieren und Vergleich ihrer ELISA, IFA und MFIA Ergebnisse. Die Nachweisgrenzen (dh Standard-Immunserum Titration Endpunkte) von MFIA vergleichbar waren, und in einigen Fällen übertroffen, wie bei entsprechenden ELISA. Diagnostische Spezifität, mit SPF Nager sera gemessen als 99%, die gesamte Korrespondenz between ELISA und MFIA durchgeführt am bekannten positiven und bekannten negativen Seren war größer als 95%. Zusammenfassend erwiesen diese Ergebnisse, dass eine gute Multiplex MFIA Stellvertreter für den ELISA ist Singleplex, und ist geeignet für die beabsichtigte Verwendung, dh in der Routine serologischen Überwachung von Versuchstieren Kolonien.
Offenlegungen
Alle Autoren arbeiten für Charles River RADS, ein führender Anbieter von Tier-Serologie Test-Dienstleistungen und Reagenzien.
Danksagungen
Die Forschung hier vorgestellte wurde von Charles River unterstützt.
Referenzen
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten