Method Article
多重化された蛍光イムノアッセイテスト方法とトラブルシューティング
要約
ルミネックス社のXMAPのミクロスフィア技術を使用して、我々は様々な実験動物種のserosurveillanceの多重蛍光イムノアッセイ(MFIA)を開発しました。 MFIAは、抗原、組織制御や免疫グロブリンが共有結合し、色分けされたポリスチレン微小球にリンクされているサスペンションマイクロアレイである。 MFIA試験法だけでなく、様々なトラブルシューティングのトピックが扱われています。
要約
生物医学研究に使用される動物モデルの品質を確保するために、我々は動物が外来性感染性病原体(ウイルス、マイコプラズマ、および他の潔癖な微生物)にさらされているかどうかを判断するための診断テスト戦略と方法を開発しました。免疫担当動物の感染症は、一般的に一時的なもので、まだ感染に対する血清抗体応答は、しばしば数日から数週間以内に検出することができ、ホストの寿命を通じて存続する。血清学的検査は、実験動物を監視する主要な診断方法である。歴史的には間接的な酵素免疫測定法(ELISA)はserosurveillanceのための主要なスクリーニング方法であった。 ELISAは、1つの微生物抗原抗体反応をウェル当たり測定される、singleplexとして実行されます。比較でMFIAは多重化アッセイとして実行されます。ミクロス100個別の色セットになっているので、最大100の異なるアッセイがsimultanを行うことができますeouslyシングルマイクロプレートのウェル。この技術革新はよく単一の試験から得られた情報の量を増加させながら、ルーチン検査に必要な血清、試薬および消耗品の量を減少させる。加えて、我々は、サンプルおよびシステム適合性を確認することにより、結果の精度を保証するために、複数の内部統制ビーズを取り込むことが出来るのです。これらはサンプルの適合性を評価するための組織制御とIgG抗血清試験種の免疫グロブリン(αIg)でコーティングされたビーズセットが含まれています。 ELISAとIFAのように、組織のコントロールは、血清免疫グロブリンの非特異的結合を検出します。 αIg制御(血清コントロール)は、血清が追加されたことを確認し、血清種の免疫グロブリンでコーティングされたIgGコントロールビーズ(システム適合性制御)は、標識試薬およびLuminexの読者が正しく機能していることを示していながら、十分な免疫グロブリン濃度が含まれています。
プロトコル
1。 MFIA手順の説明(図1)
- MFIAはチャールズリバーの抗原コーティングされたポリスチレン微小球(ビーズ)、被検血清、標識された試薬(バッグ、SPE)とバッファ(プライマリ希釈、アッセイ緩衝液)が必要です。
- 試薬は、96ウェルフィルター底マイクロタイタープレートのウェルに段階的に追加されます。
- 異種のテストの意味インキュベーションはバインドされていない血清成分又は標識化試薬を除去するためにフィルター洗浄ステップが続いているとしてMFIAが実行されます。洗浄溶液は、ビーズを保持するだけでなくフィルター底を通して吸引により除去されたプレートのウェルに添加。
- MFIAアッセイは、室温(27℃+ / -2℃)で行われます。
- テスト血清インキュベーション工程中に形成された抗原 - 抗体複合体は、R-フィコエリトリン標識ストレプトアビジン(SPE)に続くビオチン化ヤギ抗種複合体(袋)インキュベーションによって検出されます。
- アッセイリーダーに、ビーズが通って一つずつ渡す彼らは、2つのレーザーにさらされている検出器。一つのレーザは、アッセイに対応ビーズのカラーセットを識別し、内部色素を励起し、他は、アッセイ中にキャプチャフィコエリトリンレポーター色素を励起する。ビーズの所定数は、アッセイごとに読み出され、フィコエリトリン、蛍光の強度は中央蛍光インデックス(MFI)として報告されます。
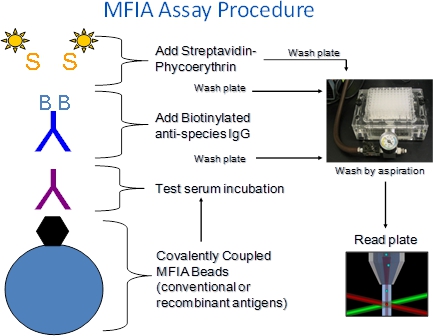
図1 MFIA手順。 XMAPベースMFIAは抗原(またはコントロール)が共有結合してリンクされている色分けされたポリスチレン5.6ミクロンビーズを利用したサスペンションマイクロアレイである。ビーズは100個別の色セットになっているので、最大100の異なるアッセイは、ビーズが真空マニホールドに吸引して洗浄することができるようにフィルター底マイクロタイタープレートで行われる単一ウェルアッセイの手順で実行することができます。反応は、Luminex XMAP 100蛍光光度計で読み込まれます。 phycoerytの強度hrin蛍光は中央蛍光インデックス(MFI)として報告されます
2。入門する前に以下の点に注意してください
- MFIAビーズは光に敏感アール
- 直接光露光量を制限することは重要です。定期試験中に発生した光露光の通常の量は許容範囲ですが、長時間の暴露により、アッセイ読者によってそれらを読み取り不能ビーズの光退色につながることができます。
- それはMFIAビーズは常に(10-30秒)使用前に懸濁液中にボルテックスし、その後超音波破砕されていることをアッセイの成功に不可欠です。
- アッセイリーダーは単一のビーズから情報を収集します。集約されたビーズのクラスタは、長い時間を読むためにつながることができます。
- アッセイ溶液の蒸発を避けるために、すべてのインキュベーションステップ中にプレートのふたで覆われた試験板を必ず保管してください。
- 必要な個人用保護具:白衣、GL実験室環境での作業中oves及び眼の保護を常に着用する。
3。試薬
- 表1は、社内MFIA実験室を確立するのに必要な材料のほとんどが含まれています。追加のまたは重複する項目は、特定のニーズに応じて必要となる場合があります。この在庫はチャールズリバー(MFIAビーズ、コントロールと補足試薬)から購入した試薬を除外していることに注意してください。ビオチン化されたコンジュゲートおよびストレプトタグを付けたフィコエリトリンのいくつかの商業的供給源が利用可能です。しかしチャールズリバーから入手可能な試薬は推奨されません代替ベンダーや試薬ロットを用いて、我々の試薬を用いてノイズのスコアに最適な信号を生成するために滴定されています。
表1。 CR-RADSは、BioTekからラッドと自動マイクロプレートウォッシャーからBioPlexサスペンションアレイリーダーを使用しています。同等の計装は、代替のベンダーから提供されています。
アイテム ベンダー カタログ番号 機器 サスペンションアレイリーダー * BioRad社 171-000205 96ウェルマイクロプレートウォッシャー BioTekの ELX50/8FMW 超音波洗浄器/お風呂 コールパーマー EW0884900 アナログボルテックスミキサー VWR 58816-121 -20℃の冷凍庫 さまざまな 4℃の冷蔵庫 さまざまな 12チャンネルピペッター、20-200μlの VWR 83009-718 オービタルプレートシェーカー VWR /ラボ·ライン 57019-600 シングルチャンネルピペッター,20-200μlの、ヒントと VWR 83009-732 ヒントとシングルチャンネルピペッター、2 - 20μL、 VWR 83009-726 ヒントとシングルチャンネルピペッター、100-1000μl、 VWR 83009-736 Vacushieldベント装置 VWR 55095-006 真空圧力ポンプ VWR 54908-037 真空システムの廃液溜め VWR 80200-640 消耗品 96ウェルプレートpolystryrene フィッシャー·サイエンティフィック 14-245-145 マルチスクリーンHTS-BVプレート、1.2μm帯フィルタ、スチレン ミリポア MSBV N12 50 15ミリリットルコニカルチューブ(ポリプロピレン) ザルスタット 62554.002 50mlコニカルチューブ(ポリプロピレン) ザルスタット 62547.004 血清バイアル ザルスタット 72694.007 アルミ箔 VWR 89079-068 1Lボトル、滅菌 VWR 28199-246 0.22μmボトルトップフィルター VWR 28199-307 試薬リザーバー(100ミリリットル) VWR 82026-356 液体試薬を分配するための5ミリリットル、10ミリリットル、25ミリリットルピペット VWR 試薬 PBS(pH7.4)で1 BSA、粉末(パウチ) シグマ P3813 プロクリン300 シグマ/スペルコ 48912-U ミクロスコーティングされていない ルミネックス タイプに基づいて変化
4。試薬の調製
- 2つのバッファーがMFIA手順のために必要とされる。一次希釈剤は、チャールズリバーから入手可能であり、非特異的タンパク質相互作用を減少させるために独自のブロッキング剤が含まれています。アッセイの洗浄バッファーは、市販の試薬を用いてあなたの施設で作られています。
- アッセイWashバッファー:PBS / 1%BSA液(pH7.4)は、Sigma-Aldrichから粉として利用可能です。
- これらの微粒子は、アッセイリーダーに下駄を招く可能性ろ過による微粒子の除去は重要です。無菌の、表示した容器に0.2μ、ボトルトップフィルターユニットを介してバッファをフィルタ処理します。
- バッグとSPEはアッセイの洗浄緩衝液で自分2X作業濃度まで希釈されています。注:SPEは、光感受性shですウルドは、限られた露光量を持っています。
5。試料調製
- あなたの試験材料、試薬、消耗品を組み立てます。
- マルチとシングルチャンネルピペットとヒント
- 96ウェルの低タンパク質結合マイクロタイタープレート(血清希釈)とフィルター底プレート(MFIAアッセイ)
- あなたの標準的な手順に従って、血液検体を採取します。遠心分離し、血清を除去する前に少なくとも30分間室温でそれらを保持することによって、完全に凝固血液検体を許可します。 Undilute血清を採取する前に血清成分を混合するために簡潔にボルテックスして下さい。
- MFIAための最終テストの希釈は1/50です。これは、アッセイのためのテスト·血清の2倍(1/25)のサンプルを作ることが必要である。 24部MFIAプライマリ希釈液に血清1部を追加することで、希釈していない試験血清を希釈します。 96ウェルマイクロタイタープレートでテスト·血清の組織が大幅にTESにあなたのサンプルの転送時間を削減トンプレートとを強くお勧めします。
6。テストプレートの準備
- プレウェッ96ウェル試験プレートはあってもよく、適切な避難を確保するために必要とされる。プレート全体がこのステップを最初に必要とされる使用されない場合でも、その後の試薬を追加するか、または空のウェルに洗浄液をする必要はありません。
- いくつかのラボには、テストプレート、後日これらの井戸を再利用する計画に使用されていない井戸を封鎖して、フル96ウェルプレート未満を実行します。我々は、それが試験板の適切なろ過に影響を与えるかもしれないので、この方法を使用することはお勧めしません。
- 適切なテストプレート吸引はMFIAアッセイの成功に不可欠です。サンプルウェルの避難は約5〜10秒かかります。早すぎるウェルの内容を吸引すると、アッセイの終了時にビーズの凝集と遅い読み込み時間も長くなります。
- 毎ワットの後にペーパータオルで試験板の下面を吸い取る排液を確実にするために灰のステップは停止しています。テストプレートをブロットに障害がヤギ抗種および/または種のIgGビーズスコア失敗でインキュベーションと結果の間に井戸の外ウィッキング液体試薬につながることができます。これらのビーズは一次血清と標識試薬の適切な量を各ウェルに添加する予め定められたMFIの範囲内のスコアに設計されています。
7。 MFIAビーズ懸濁液の調製
- それは、ビーズをボルテックスし、常に使用する前に超音波処理していることをアッセイの成功に不可欠です。アッセイリーダーは単一のビーズから情報を収集し、ビーズ集合体または塊は長い時間を読むためにつながることができます。
- 渦株式結合ビーズ懸濁液(通常は10±5秒間)
- 10から20秒間ソニケーター浴中の超音波処理に続いてビーズを再懸濁します。
- 一次希釈液で2倍の作業ビーズ懸濁液に20X純正サスペンションを希釈します。 2Xビーズ懸濁液を50μlを分注しプリウェットテストプレートの各ウェルをアッセイする。
8。試験板に試験及びコントロール血清の添加
- 各2Xテストと事前に定義されたプレートの地図に基づいて試験用プレートへのコントロール血清50μlのピペット。室温で暗闇の中で安全なゴムバンドまたはアルミホイルでプレートにふたとオービタルシェーカーで60分のテストプレートをインキュベートし、。
- シェーカー速度が400より大きいが700rpm未満でなければなりません。それは、ビーズは血清抗体が結合する抗原のすべての面にアクセスできるように懸濁状態に維持することが重要です。ビーズを一時停止しないと、低IgGビーズ制御得点という結果になり、このアッセイは、繰り返す必要があります。
9。テストプレートを洗浄
- 吸引マニホールドを用いて十分に内容を吸引します。サンプルウェルの避難は約5〜10秒かかります。
- パプと試験板の下面を吸い取る排液を確実にするために、すべての後にRタオルは停止しています。
- アッセイの洗浄バッファーを50μlのビーズを再懸濁します。それは、ビーズは、アッセイプロセス中に乾燥させないことが重要です。
10。試験板にバッグとSPEの追加
- MFIAビーズを含有するすべてのウェルに2倍希釈作業袋の50μlを分注します。ゴムバンドまたはアルミホイルでプレートに蓋を固定します。室温で暗闇の中で、上記のように振とうしながら30分間のテストプレートをインキュベートする。
- このインキュベーション後にテストプレートを洗浄し、以前に血清を添加した後に記載のアッセイの洗浄バッファーでビーズを再懸濁します。
- MFIAビーズを含有するすべてのウェルに2Xワーキング希釈SPEの50μlずつ分注します。ゴムバンドまたはアルミホイルでプレートに蓋を固定します。室温で暗闇の中で、上記のように振とうしながら30分間のテストプレートをインキュベートする。
- このインキュベーションの後bationはテストプレートを洗浄し、アッセイリーダーに配置する前にビーズを再懸濁するアッセイの洗浄緩衝液125μlでビーズを再懸濁し、〜2分間プレートを横に振る。
11。試験板を読んで
- ビーズを再懸濁してから10分以内にアッセイリーダーに試験板を置きます。停電やその他の事故の場合には、試験板を12時間まで読んで準備が整うまで、暗闇の中で室温で保存することができます。
- 選択されたビードパネルが試験ウェルのビードプロファイルと一致することを確認するだけでなく、最初のサンプルを観察します。プロトコルディスプレイ上の彼らの指定 'ビード領域 "から外れたビーズがある場合、間違ったプロファイル選択がなされている。
- ビーズが適切に再懸濁していた場合、彼らは記入すべきアッセイリーダーソフトウェアに示されているそれらの指定された '地域'。
- ビーズが集約されている場合、彼らは低速で自分の地域で記入します率。あなたは読者からテストプレートを外して、手動で井戸を再懸濁することができます。ビーズの凝集体を破壊するのを助けるために、マルチチャンネルピペッター3-4回各ウェルをひいて粉にする。読者にテストプレートを交換して続行します。
12。代表的な結果
- ビーズの最小数は、アッセイごとに読み出され、フィコエリトリン蛍光強度は、0から32667までの範囲の中央蛍光インデックス(MFI)として報告されます。ウェルあたり25個、50個または100ビーズの数を比較した後、我々は統計学的有意差を見なかったし、日常的によくサンプルあたりエージェント当たり25ビーズを数える。このような不十分なビーズカウントまたはIgG /抗IgGビーズスコアを失敗などのエラーのための結果のレポートを調べます。これらのビーズは一次血清と標識試薬の適切な量を各ウェルに添加する予め定められたMFIの範囲内の "スコア"に設計されています。エラーが発生したサンプルウェル、(低ビーズカウント)か、失敗したIgGコントロールビーズスコアべき有効な結果を取得するために繰り返される。
- Excelワークシートに結果をエクスポートします。我々のデータの解釈については、各アッセイが割り当てられます。
- 組織制御(TC)試験:ほとんどのげっ歯類MFIAアッセイのために、組織制御、野生型バキュロウイルス感染昆虫細胞の抽出物である。
- アッセイカットオフ:この値は、予想される最小蛍光であると診断精度を最大化するために、それぞれのアッセイのために調整されます。ほとんどのアッセイでは、蛍光カットは3000です。
- 当期純中央蛍光インデックス(MFI)は以下の式で(組織及びIgG対照試験を除く)それぞれのアッセイのために計算される。言い換えれば、特定のアッセイシグナルは、単に0から32の代わりに0-32,667の間に純MFIの範囲を設定し全アッセイMFIマイナスTC(バックグラウンド)のMFIは、この値が1000で割った値である。
ネットMFI =(MFIの抗体アッセイ - MFIの組織制御 )/ 1000
ねートンMFIとTC MFIはそれぞれの抗原に特異的なアッセイカットオフとの比較によってスコアに変換されます。
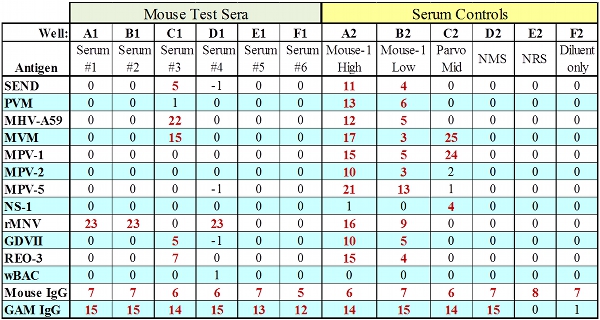
図2:すべてのIgGと被検血清のための代表的なMFIAデータが通過を制御します。
- 12.4 MFIAの解釈
- システムスータビリティコントロールおよび血清コントロール抗体(IgG /抗IgGビーズ)の結果は表2に記載されている受入基準を満たすかどうかをテストプレートの結果のみ解釈されるべきである。これら二つのIgG対照ビーズの失敗は、このような不適切な希釈または不十分なボリュームコンジュゲートまたはimmunocomprimised動物からの血清のSPE、不適切な試験血清希釈や使用など、いくつかの手続き上のエラーを示すことができます。
表2
アッセイコントロールのための受入基準 コントロール まずまずの結果 スコア 分類 ハイ·レンジ免疫血清 ≥4.5 正の ロー·レンジ免疫血清 ≥1.5 ≥ボーダーライン 非免疫血清 <2.5 ≤ボーダーライン 希釈剤 <2.5 ≤ボーダーライン Igのビーズは、*を設定 ≥Cutoff/1000 合格 免疫不全鎬から高すぎるサンプル希釈、間違った種や試験血清、不十分な試料の添加に起因する可能性があり、このサンプルの適性制御のための失敗を見る:*ビーズは、種特異的な抗血清検査免疫グロブリン(Ig)でコーティングされた設定セント。
- テストプレートアッセイコントロールのいずれかがハイ·レンジ免疫血清を除いて失敗した場合、結果は受け入れられないと繰り返す必要があります。それが試験板の検出感度のレベルを示していますので、受け渡し低レンジコントロール血清のスコアは非常に重要です。
- ヤギ抗種IgG抗体ビーズスコアは、アッセイに加え、一次試験血清の量に基づいている。このコントロールビーズが失敗しても、種IgGが(まあ、B1、図3)合格した場合、それは、十分な検査試薬(バッグ、SPEは)よくテストに追加されたことを示し、それは血清関連の問題です。検査試薬の量がよく、特に不足している場合はIgGおよび抗IgG対照ビーズ両方が失敗する(まあ、E1、図3)になります。
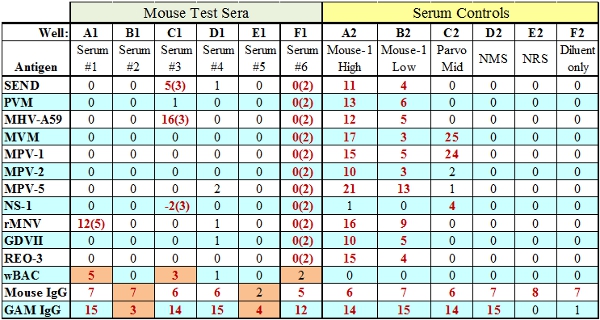
図3障害を有する代表的なMFIA試験結果(オレンジ色で示されます)。ウェルズA1、C1とF1は、TC(組織反応性)障害が発生したことを示すどこTCのスコアは、括弧で表されます。ウェルズB1とE1には、IgGの内部統制の障害、不十分な試験抗体(B1)またはBAG / SPEそれぞれ検査試薬(E1)の2種類を示しています。
- テストプレートアッセイコントロールの結果が満足できるものであれば、表3に示すように、個々の検定のスコアが分類されます。これは、代替試験法により、任意の境界線または陽性所見を確認することが重要です。
表3
MFIAスコア分類 スコア 分類 TC ネット TC +ネット* ≥2 <0.5 <2.5 マイナス( - ) ≥0.5 ≥2.5 TCの反応(T) <2 <1.5 - 1.5≤X <2.5 境界線(B)を ≥2.5 プラス(+) *負の分類は未だ提供される非ゼロTCのスコアで決定することができる、TC +ネットスコアは(= Agのスコア)が負
- システムスータビリティコントロールおよび血清コントロール抗体(IgG /抗IgGビーズ)の結果は表2に記載されている受入基準を満たすかどうかをテストプレートの結果のみ解釈されるべきである。これら二つのIgG対照ビーズの失敗は、このような不適切な希釈または不十分なボリュームコンジュゲートまたはimmunocomprimised動物からの血清のSPE、不適切な試験血清希釈や使用など、いくつかの手続き上のエラーを示すことができます。
ディスカッション
MFIAのテストプロセスは、従来のsingleplexテストより少ない機器や小さいサンプルと試薬を正確な容量を必要とする、非常に効率的です。多重システムの機能は、実験用げっ歯類における共通エージェントの複数の株または血清(すなわち、コロナウイルス、パルボウイルスなど)を同時にスクリーニングするために、ユーザに柔軟性を提供します。これはまた、関心のある領域(すなわち、特定のウイルスの家族)に基づいてカスタマイズされたビーズのパネルを設計するために、私たちを可能にし、サイトカインおよび他のバイオマーカーを含む生体分子の他の種類のスクリーニングに適応可能です。また、それは私たちがサンプルおよびシステム適合性を確認することにより、結果の精度を保証するために、いくつかの内部統制アッセイを組み込むことができます。これらはサンプルの適合性を評価するための組織制御とIgG抗血清試験種の免疫グロブリン(αIg)でコーティングされたビーズセットが含まれています。組織制御ビードは血清免疫グロブリンの非特異的結合を検出し、αIgビードコントロールが確認その血清を添加し、十分な免疫グロブリン濃度が含まれているされています。血清種の免疫グロブリンでコーティングされた別のコントロールビーズは、標識された試薬及びアッセイリーダーが正常に機能していることを示しています。他の市販の多重フォーマット血清学的アッセイは、(つまり、マイクロアレイ、ImmunoComb)結果確認のこの同じレベルを提供しません。
前に再テストをアッセイ失敗の可能性のあるソースを絞り込むために能力は研究者が時間と材料を節約することができます。 MFIAの重要な側面は、失敗したサンプルを繰り返す前に確認すべきである。アッセイは、周囲温度で行われるので、それは℃±2℃、高温がコントロールとサンプルの予想より低いスコアにつながることができます約27実験室の温度であることを確認する必要があります。洗濯は、おそらく検定の中で最も重要なステップです。試験板を適切に洗浄されることを保証する、ブロットし、排除することができます再懸低ビーズカウント(集約ビーズのために)または不十分な試薬添加(試験板フィルター底から吸い上げによって失われた)のためにサンプリング誤差の大半。我々は日常的にアッセイ当たり25ビーズ(エージェント)を数え、また、プレートのための時間を読むために長くつながるビーズの高い数を数えることによって、結果に有意差は認められません。
我々は、既知の陽性及び陰性血清多数のサンプルをテストすることにより、診断精度、再現性、耐久性を実証するために一般的に使用される実験動物の数種(マウス、ラット、ハムスター、モルモット及びウサギ)でMFIAの包括的な検証試験を行い、き彼らのELISA、IFAおよびMFIA結果を比較する。 MFIAの検出限界(すなわち、標準的な免疫血清滴エンドポイント)が同程度であった、といくつかのケースでは、対応するELISA法を上回りました。 SPFの齧歯類の血清を用いて測定し診断特異性は、99%を超え、全体の対応betwee既知の陽性および既知の陰性血清で行わnのELISAとMFIAは95%以上であった。要約すると、これらの結果は、多重MFIAがsingleplex ELISAと良い代替であり、実験動物コロニーのルーチンserosurveillanceすなわち、その使用目的に適していることを証明した。
開示事項
チャールズ川RADS、動物血清学検査サービスおよび試薬の主要なプロバイダのすべての著者が仕事。
謝辞
ここで紹介する研究はチャールズ川によってサポートされていました。
参考文献
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved