Method Article
Multiplexados Metodologia de Testes de imunoensaio fluorimétrico e solução de problemas
Neste Artigo
Resumo
Usando a tecnologia Luminex Corporation microesfera xMAP, desenvolvemos o imunoensaio multiplexado fluorométrico (MFIA) para serovigilância de várias espécies de animais de laboratório. O MFIA é um microarray de suspensão onde o antigénio controlo de tecido, ou imunoglobulinas são ligados covalentemente a um código de cores de poliestireno microesferas. O método de ensaio MFIA, bem como vários tópicos de resolução de problemas é abordada.
Resumo
Para assegurar a qualidade dos modelos animais utilizados em pesquisa biomédica, temos desenvolvido um número de estratégias de ensaio e métodos de diagnóstico para determinar se os animais foram expostos a agentes infecciosos adventícias (vírus, micoplasmas e outros microorganismos aeróbios). Infecções de animais imunocompetentes são geralmente transitórios, mas as respostas de anticorpos séricos a infecção, muitas vezes pode ser detectado dentro de dias a semanas e persistir durante toda a vida do hospedeiro. Serologia é a metodologia de diagnóstico primário pelo qual os animais de laboratório são monitorizados. Historicamente, o ensaio com enzima ligada indirecto (ELISA) foi o principal método de rastreio para serovigilância. O ELISA é realizado como uma singleplex, em que uma reacção antigénio-anticorpo microbiana é medida por poço. Em comparação a MFIA é realizado como um ensaio multiplex. Uma vez que as micro-esferas entram em 100 conjuntos de cores distintas, até 100 diferentes ensaios podem ser realizados Simultaneously numa única microplaca bem. Esta inovação diminui a quantidade de soro, os reagentes e produtos descartáveis requeridos para testes de rotina, enquanto que aumentando a quantidade de informação obtida a partir de um único teste bem. Além disso, são capazes de incorporar múltiplas esferas de controlo internos para verificação da amostra e adequação do sistema e, assim, garantir a precisão dos resultados. Estes incluem o controlo de tecido e ensaio de IgG anti-imunoglobulina de espécies de soro (αIg) conjuntos de esferas revestidas para avaliar a adequação da amostra. Tal como no ELISA e IFA, o controlo de tecido detecta a ligação não específica de imunoglobulina no soro. O controle αIg (controle de Soro) confirma que o soro tenha sido adicionado e contém uma concentração de imunoglobulinas suficiente enquanto o IgG esfera de controlo (controle de Adequação do Sistema), revestido com imunoglobulina espécie de soro, demonstra que os reagentes marcados e Luminex leitor estão funcionando corretamente.
Protocolo
1. Explicação do Procedimento MFIA (Figura 1)
- O MFIA requer antígeno revestido da Charles River poliestireno microesferas (contas), teste de soros, reagentes marcados (BAG, SPE) e amortecedores (Diluente Primária, tampão de ensaio).
- Os reagentes são adicionados gradualmente aos poços de placas de 96 poços de microtitulação de fundo do filtro.
- O MFIA é realizado como um ensaio incubações significado heterogéneos são seguidas por lavagem do filtro-passos para remover os constituintes do soro não ligados ou rotulados reagentes. Solução de lavagem adicionado à placa de cavidades é removido por aspiração através do filtro, bem-fundos, que retêm os grânulos.
- Os ensaios MFIA são realizados à temperatura ambiente (27 ° C + / -2 ° C).
- Complexos antigénio-anticorpo formados durante o passo de incubação do soro de teste são detectados por incubação com biotinilados de cabra anti-espécies conjugados (BAG) seguido por R-ficoeritrina-estreptavidina marcada (SPE).
- No leitor de ensaio, as pérolas de passar um de cada vez atravésum detector de onde eles são expostos a dois lasers. Um laser excita os corantes internas que identificam o conjunto de talão de cor, o que corresponde a um ensaio, o outro excita o corante repórter ficoeritrina capturado durante o ensaio. Um número predeterminado de grânulos são lidos por ensaio e a intensidade da fluorescência ficoeritrina é relatado como um Índice de fluorescência mediana (MFI).
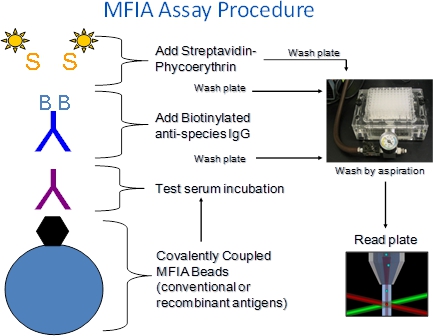
Figura 1. Procedimento MFIA. O MFIA xMAP-baseado é um microarray de suspensão, que utiliza um código de cores de poliestireno 5,6 micron grânulos a que os antigénios (ou controlo) são ligados de forma covalente. Uma vez que as esferas entram em 100 conjuntos de cores distintas, até 100 diferentes ensaios podem ser realizados em uma única passos de ensaio bem são realizados em placas de microtitulação de fundo do filtro de modo que as esferas podem ser lavadas por aspiração sobre um tubo de vácuo. Reações são lidos com o xMAP Luminex 100 fluorímetro. A intensidade da phycoerythrin fluorescência é relatado como um índice de fluorescência média (IFM)
2. Antes de começar, observe o seguinte:
- As contas MFIA são sensíveis à luz
- Limitar a quantidade de exposição à luz direta é crucial. A quantidade normal de exposição à luz, que ocorre durante o teste de rotina é aceitável, mas a exposição prolongada pode levar a fotodegradação dos grânulos que as tornam ilegíveis para o leitor de Ensaio.
- É crucial para o sucesso do ensaio que as contas são sempre MFIA em vórtex e, em seguida, a suspensão foi sonicada (10-30 segundos), antes da utilização.
- O leitor Ensaio reúne informações de contas únicos. Agregados grupos de contas pode levar a mais ler vezes.
- Certifique-se de manter a placa de teste coberto com a tampa placa durante todas as etapas de incubação para evitar a evaporação de soluções de ensaio.
- Equipamentos de proteção individual necessários: Laboratório casaco, glOves e proteção dos olhos deve ser usado em todos os momentos, enquanto trabalhava em um laboratório.
3. Reagentes
- A Tabela 1 inclui a maior parte dos materiais necessários para estabelecer uma in-house laboratório MFIA. Itens adicionais ou duplicados podem ser necessárias, dependendo de suas necessidades específicas. Por favor note que este inventário exclui reagentes adquiridos de Charles River (esferas MFIA, controles e reagentes suplementares). Várias fontes comerciais de conjugados biotinilados e estreptavidina marcada com ficoeritrina estão disponíveis. No entanto, os reagentes disponíveis a partir de Charles River foram titulados, para se obter o melhor sinal de pontuação ruído com os reagentes, usando fornecedores alternativos ou lotes de reagentes não é recomendada.
Tabela 1. CR-RADS usa um leitor de matriz Bioplex Suspensão de BioRad e lavadora automática de BioTek. Instrumentação equivalente está disponível a partir de fornecedores alternativos.
Item Vendedor Número de catálogo Equipamento Leitor matriz suspensão * BioRad 171-000205 96 poços lavador de microplacas BioTek ELX50/8FMW Limpador ultra-sônico / banho Cole Palmer EW0884900 Misturador de vórtice analógico VWR 58816-121 -20 ° C congelador Vário 4 ° C refrigerador Vário Pipetador de 12 canais, 20-200 ul VWR 83009-718 Orbital placa do vibrador VWR / Lab-Line 57019-600 Canal único pipetas, 20-200 ul, com dicas VWR 83009-732 Canal único pipetas, 2-20 uL, com dicas VWR 83009-726 Canal único pipetas, 100-1000μl, com dicas VWR 83009-736 Vacushield dispositivo de ventilação VWR 55095-006 Bomba de pressão de vácuo VWR 54908-037 Reservatório de resíduos de vácuo do sistema VWR 80200-640 Descartáveis Placa de 96 poços poliestireno Fisher Scientific 14-245-145 MultiScreen-BV HTS placa, 1.2μm filtro, estireno Millipore MSBV N12 50 15ml tubos cônicos (polipropileno) Sarstedt 62554.002 50ml tubos cônicos (polipropileno) Sarstedt 62547.004 Os frascos para soro Sarstedt 72694.007 Folha de alumínio VWR 89079-068 Garrafas de 1L, estéril VWR 28199-246 0.22μm garrafa top-filtros VWR 28199-307 Reservatórios de reagentes (100 ml) VWR 82026-356 5ml, 10ml, 25ml Pipetas para dispensar reagentes líquidos VWR Reagentes PBS, pH 7,4, BSA a 1, o pó (bolsas) Sigma P3813 ProClin 300 Sigma / Supelco 48912-U Não revestidos microesferas Luminex variou com base no tipo
4. Preparação do Reagente
- Dois tampões são necessários para o processo MFIA. Diluente principal está disponível a partir de Charles River e contém agentes bloqueadores de propriedade para diminuir as interacções não específicas da proteína. Tampão de lavagem ensaio é feito em suas instalações com reagentes disponíveis comercialmente.
- Ensaio Tampão de lavagem: PBS / BSA a 1% pH 7,4 está disponível como um pó a partir de Sigma-Aldrich.
- A remoção de partículas por filtração é crítica uma vez que estes podem conduzir a partículas obstruções no leitor de ensaio. Filtra-se a através de um tampão de garrafa 0.2micron-top unidade de filtro estéril, em recipientes rotulados.
- BAG e SPE são diluídos para a concentração de 2X tampão de lavagem de trabalho no Ensaio. Nota: SPE é sensível à luz e should tem exposição à luz limitada.
5. Preparação da Amostra
- Monte seus materiais de testes, reagentes e produtos descartáveis.
- Micropipetas e multi-canal único e dicas
- 96 poços baixas de proteína de ligação placas de microtitulação (diluições de soro) e as placas de fundo de filtro (teste de MFIA)
- Coletar amostras de sangue de acordo com o procedimento padrão. Permitir que as amostras de sangue para coagular completamente, segurando-os à temperatura ambiente durante pelo menos 30 minutos antes da centrifugação e remoção do soro. Undilute soro devem ser centrifugadas brevemente para misturar os componentes do soro antes da amostragem.
- A diluição final de testes para o MFIA é de 1/50. É necessário fazer uma amostra (1/25) 2X de seu soro de ensaio para o ensaio. Diluir o soro teste diluído pela adição de uma parte de soro a 24 Diluente MFIA partes Primário. Organização de seu soro de teste numa placa de microtitulação de 96 poços reduz grandemente o tempo de transferência de amostras para os seus test placa e é altamente recomendado.
6. Preparação placa teste
- Pré-humedecimento da placa de ensaio de 96 poços é necessária para assegurar a adequada, mesmo assim a evacuação. Mesmo se toda a placa não vai ser utilizado neste passo é inicialmente requerida, não será necessário adicionar o reagente subsequente ou tampão de lavagem para os poços vazios.
- Alguns laboratórios de correr inferior a uma placa de 96 poços completo selando os poços não utilizados na placa de ensaio e um plano de reutilização destes poços numa data posterior. Nós não recomendamos o uso deste método, uma vez que pode afetar a filtragem adequada da placa de teste.
- Aspiração chapa adequada de teste é crucial para o sucesso do ensaio MFIA. Evacuação dos poços de amostra deve ter segundo aproximadamente 5-10. Aspiração do conteúdo assim muito rapidamente pode levar à agregação e talão lentos tempos de leitura no final do ensaio.
- Blot o lado de baixo da placa de teste com toalhas de papel após cada wpasso de cinzas para assegurar uma drenagem de líquido ter parado. A falha para apagar a placa de teste pode levar a reagentes líquidos wicking fora dos poços durante a incubação e resultar em falha de cabra anti-espécies e / ou contagens Espécie IgG grânulo. Estes grânulos são concebidos para contagem dentro de um intervalo pré-determinado MFI quando a quantidade adequada de soro primário e os reagentes marcados são adicionados a cada poço.
7. MFIA Preparação Suspensão Bead
- É crucial para o sucesso do ensaio que as contas são sempre agitada em vórtex e sonicada antes da utilização. O leitor ensaio reúne informações de contas de uma única vez, agregados ou aglomerados de contas pode levar a mais ler vezes.
- Vortex a suspensão de esferas acopladas estoque (tipicamente de 10 ± 5 segundos)
- Voltar a suspender as pérolas seguida por sonicação em banho de ultra-sons durante 10-20 segundos.
- Diluiu-se a suspensão de estoque 20X a uma suspensão de trabalho 2X grânulo em Diluente principal. Pipetar 50 ul da suspensão de esferas 2Xpara cada ensaio poço da placa de teste pré-molhada.
8. Além de soros de teste e comando para a placa de teste
- Pipetar 50 l de cada teste 2X e Controle de soro para a placa de teste com base em seu mapa da placa predefinida. Tampa segura para a placa com um elástico ou uma folha de alumínio e incuba-se a placa de teste de 60 minutos num agitador orbital, no escuro, à temperatura ambiente.
- A velocidade do agitador deve ser superior a 400 mas inferior a 700rpm. É fundamental que as pérolas sejam mantidas em suspensão para permitir que os anticorpos séricos acesso a todas as superfícies dos antigénios acoplados. Falha em manter os grânulos em suspensão irá resultar em pontos baixos de IgG de controlo do grânulo e o ensaio deverá ser repetido.
9. Lavar a placa de teste
- Aspirar o conteúdo do poço, utilizando um colector de vácuo. Evacuação dos poços de amostra deve ter segundo aproximadamente 5-10.
- Blot o lado de baixo da placa de teste com papetoalhas r após cada para garantir a drenagem de líquido parou.
- Ressuspender as contas em 50 l de tampão de lavagem de Ensaio. É importante que os grânulos não são permitidos a secar durante o processo de ensaio.
10. Adicionando BAG e SPE para a placa de teste
- Pipetar 50 ul de diluição 2X BAG trabalho a todos os poços que contêm grânulos MFIA. Fixar a tampa para o prato, com um elástico ou uma folha de alumínio. Incubar a placa de ensaio durante 30 minutos com agitação como acima, no escuro, à temperatura ambiente.
- Após esta incubação, lava-se a placa de teste e ressuspender as esferas com tampão de lavagem conforme descrito anteriormente Ensaio após a adição de soro.
- Pipetar 50 ul de diluição 2X SPE de trabalho para todos os poços que contêm grânulos MFIA. Fixar a tampa para o prato, com um elástico ou uma folha de alumínio. Incubar a placa de ensaio durante 30 minutos com agitação como acima, no escuro, à temperatura ambiente.
- Após este INCUexacerbação lava-se a placa de teste e voltar a suspender as pérolas com 125μl de tampão de lavagem de Ensaio e agitar a placa de ~ dois minutos para ressuspender as esferas antes da colocação no leitor de ensaio.
11. Lendo a placa de teste
- Colocar a placa de ensaio para o leitor de ensaio no prazo de 10 minutos de ressuspender as esferas. No caso de uma falha de energia ou outros incidentes, a placa de teste podem ser armazenadas à temperatura ambiente na escuridão até 12 horas até estar pronto para ser lido.
- Observar a primeira amostra assim para verificar se o painel seleccionado talão corresponde ao perfil de rebordo nos poços de teste. Se há contas que não se enquadram "região pérola" sua designado no visor protocolo, uma seleção de perfil incorreta foi feita.
- Se as esferas foram ressuspensas devidamente devem preencher nas suas "regiões" especificadas indicadas no software de leitura de ensaio.
- Se os grânulos são agregados irão preencher as suas regiões de um lentotaxa. Você pode remover a placa de teste do leitor e manualmente ressuspender os poços. Tritura-se cada poço com um pipetador de canais múltiplos, 3-4 vezes para ajudar a romper-se os agregados de grânulo. Substitua a placa de teste para o leitor e continuar.
12. Resultados representativos
- Um número mínimo de grânulos são lidos por ensaio e a intensidade da fluorescência ficoeritrina é relatado como um Índice de fluorescência mediana (MFI) variando de 0 a 32.667. Depois de comparar a contagem de 25, 50 ou 100 pérolas por bem não vimos nenhuma diferença estatística e rotineiramente contar 25 pérolas por agente por amostra. Examinar o relatório de resultados de erros, como inadequados conta talão ou que não IgG / pontuações anti-IgG de contas. Estes grânulos são concebidos para «resultado» dentro de um intervalo pré-determinado MFI quando a quantidade adequada de soro primário e os reagentes marcados são adicionados a cada poço. Poços de amostras com erros, (baixa contagem de contas) ou que não IgG pontuações de controle de contas deveser repetida para obter resultados válidos.
- Exportar os resultados para uma planilha do Excel. Para a nossa interpretação dos dados de cada ensaio é atribuído:
- Um tecido de controlo de ensaio (TC): Para a maioria dos ensaios MFIA de roedores, o controlo de tecido é um extracto de tipo selvagem de baculovírus, células de insecto infectadas.
- Um corte de Ensaio: Este valor é a fluorescência mínima esperada e é ajustado para cada ensaio para maximizar a precisão do diagnóstico. Para a maioria dos ensaios, o corte de fluorescência é 3000.
- Índice de fluorescência líquida mediana (MFI) é calculado para cada ensaio (excepto o tecido e os testes de controlo de IgG) com a seguinte fórmula. Em outras palavras, o sinal de ensaio específico é o total do ensaio menos a MFI TC (fundo) MFI Este valor é então dividido por 1000, que simplesmente define o intervalo de MFI líquida entre 0-32, em vez de 0-32,667.
Net MFI = (MFI Ensaio Anticorpo - MFI Controlo Tissue) / 1000
Net IMF e IMF TC são convertidas em pontuações em comparação com o ensaio de corte específico para cada antigénio.
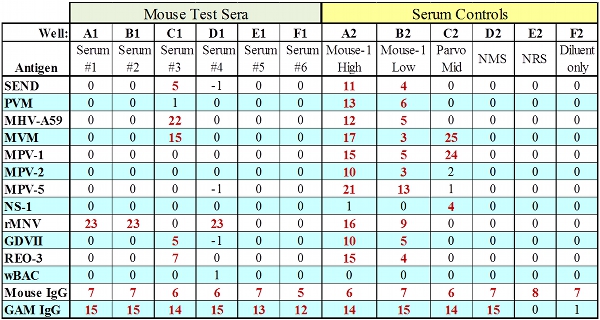
Figura 2. Dados representativos MFIA para o teste com todos os soros IgG controla passagem.
- 12,4 Interpretação MFIA
- Os resultados placa de teste só deve ser interpretado, se o sistema de controlo de aptidão e soro de controlo (IgG / IgG anti-esferas) resultados satisfazem os critérios de aceitação listados na Tabela 2. Fracasso dessas duas esferas de controlo de IgG pode indicar vários erros processuais, tais como a diluição inadequada ou conjugado volume insuficiente ou SPE, diluição teste imprópria soro ou uso de soro de um animal immunocomprimised.
Tabela 2
Critérios de aceitação para controles de análise Controlar Resultado aceitável Contagem Classificação High Range soro imune ≥ 4,5 Positivo Intervalo de baixo soro imune ≥ 1,5 ≥ Borderline Não-imune Soro <2,5 ≤ Borderline Diluente <2,5 ≤ Borderline Ig Bead Definir * ≥ Cutoff/1000 Passar * Bead definido revestido com espécies específicas de ensaio anti-soro de imunoglobulina (Ig): pontuações falhando para este controle adequação amostra poderia resultar da adição de amostra suficiente, muito elevada a diluição da amostra, a espécie incorrectos ou soro de teste a partir de uma ho imunodeficienteSt.
- Se qualquer um dos testes dos controles de ensaio em placa falhar, exceto o soro Gama Alta Imune, os resultados não são aceitáveis e deve ser repetido. Passando gama baixa pontuação soro controle são fundamentais uma vez que demonstra o nível de sensibilidade de detecção da placa de teste.
- A espécie de cabra anti-IgG de pontuação do grânulo é baseado na quantidade de soro de teste primário adicionado ao ensaio. Se esta pérola de controlo falhar mas a IgG espécies passa (Bem B1, Fig.3), então isso indica que os reagentes de teste em quantidade suficiente (BAG, SPE) foram adicionados ao poço de teste, e é uma questão relacionada com soro. Se a quantidade de reagentes de teste é insuficiente num determinado bem tanto a IgG e grânulos anti-IgG de controlo irá falhar (Bem E1, Fig.3).
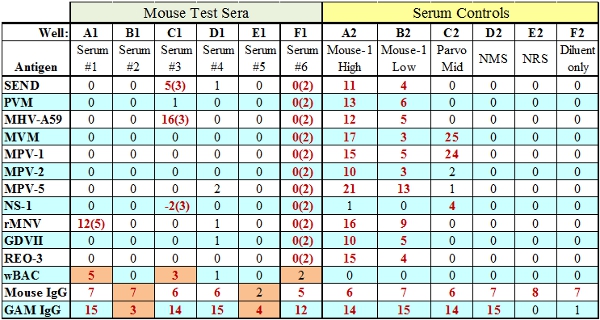
Figura 3. Representante MFIA resultados de testes com falhas (indicados em laranja). Os poços A1, C1 e F1 indicar uma falha de TC (reactivo tecido)onde a pontuação TC é representada entre parênteses. Wells B1 e E1 ilustram os dois tipos de falhas de controlo de IgG de anticorpo de teste internos, insuficiente (B1) ou reagentes de teste (E1) SACO / SPE respectivamente.
- Se os resultados de teste placa de controlo do ensaio são satisfatórias, as pontuações individuais de ensaio são classificados como mostrado na Tabela 3. É crítico para confirmar qualquer resultado positivo limítrofe ou por um método de teste alternativo.
Tabela 3
MFIA Classificação Pontuação Contagem Classificação TC Rede TC + * Net ≥ 2 <0,5 <2,5 Negativo (-) ≥ 0,5 ≥ 2,5 TC A reacção (T) <2 <1,5 - 1,5 ≤ X <2,5 Borderline (B) ≥ 2,5 Positivo (+) * A classificação de negativo pode ainda ser determinada, com uma pontuação diferente de zero TC desde que o TC + Pontuação Líquida (= pontuação Ag) é negativo
- Os resultados placa de teste só deve ser interpretado, se o sistema de controlo de aptidão e soro de controlo (IgG / IgG anti-esferas) resultados satisfazem os critérios de aceitação listados na Tabela 2. Fracasso dessas duas esferas de controlo de IgG pode indicar vários erros processuais, tais como a diluição inadequada ou conjugado volume insuficiente ou SPE, diluição teste imprópria soro ou uso de soro de um animal immunocomprimised.
Discussão
O processo de teste MFIA é altamente eficiente, que requer menos equipamento e menores volumes de amostra e de reagente do que os testes tradicionais singleplex. A funcionalidade do sistema de multiplex dá ao utilizador a flexibilidade para rastrear simultaneamente por várias estirpes ou serotipos de agentes comuns em roedores de laboratório (Coronavirus ie, parvovírus, etc.) Isto também permite, de concepção personalizada painéis grânulo com base na área de interesse (ou seja, a família de vírus específico) e é adaptável a outros tipos de triagem de biomoléculas, incluindo citocinas e outros biomarcadores. Além disso, permite-nos incorporar vários ensaios de controlo interno a fim de verificar a adequação do sistema de amostra e e, assim, garantir a precisão dos resultados. Estes incluem o controlo de tecido e ensaio de IgG anti-imunoglobulina de espécies de soro (αIg) conjuntos de esferas revestidas para avaliar a adequação da amostra. Um tecido de controlo do grânulo detecta a ligação não específica de imunoglobulina do soro e a esfera de controlo αIg confirmaque o soro foi adicionado e contém uma concentração de imunoglobulina suficiente. Outra grânulo de controlo, revestidas com imunoglobulina de espécies de soro, demonstra que os reagentes marcados e leitor de ensaio estão a funcionar correctamente. Outros comercialmente disponíveis multiplex ensaios formato sorológicos (microarrays ie, ImmunoComb) pode não oferecer o mesmo nível de confirmação de resultado.
A habilidade para diminuir a possível fonte de fracasso ensaio antes de reteste pode ajudar o pesquisador economizar em tempo e materiais. Aspectos críticos do MFIA deve ser confirmada antes de repetir uma amostra falhou. Uma vez que o ensaio é realizado à temperatura ambiente, deve-se verificar que a temperatura de laboratório é de cerca de 27 ° C ± 2 ° C, as temperaturas mais elevadas podem conduzir a uma redução do que esperado para controlos e amostras. Lavagem é, talvez, o passo mais importante no ensaio. Garantindo que a placa de teste é devidamente lavado e ressuspenso blotted pode eliminara grande maioria dos erros de amostragem, devido à baixa contagem de talão (devido esferas de agregados) ou a adição de reagente insuficiente (perdido por capilaridade para fora da parte inferior da placa de ensaio do filtro). Rotineiramente contar 25 pérolas por ensaio (agente) e não encontraram nenhuma diferença estatística nos resultados por contagem maior número de pérolas que também conduzem a um maior tempo de leitura para a placa.
Realizamos estudos de validação abrangentes de MFIA em várias espécies de animais de laboratório comumente utilizados (camundongo, rato, hamster, porquinhos e coelho) para demonstrar a precisão diagnóstica, reprodutibilidade e robustez, testando um grande número de conhecidos positivos e negativos amostras de soro, e comparando sua ELISA, IFA e resultados MFIA. Os limites de detecção (isto é, o padrão de titulação de soro imune endpoints) de MFIA foram comparáveis, e em alguns casos ultrapassou, os de ELISA correspondente. Especificidade do diagnóstico, medida com roedores SPF soros, superou 99%, o betwee correspondência geraln ELISA e MFIA realizada em conhecidos soros positivos e negativos conhecidos foi superior a 95%. Em resumo, estes resultados mostraram que MFIA multiplex é um bom substituto para o ELISA singleplex, e é adequada para a sua pretendida utilização, ou seja, em serovigilância rotina de colónias de animais laboratoriais.
Divulgações
Todo o trabalho de autores por Charles River RADS, um importante fornecedor de serviços de sorologia em animais de testes e reagentes.
Agradecimentos
A pesquisa apresentada aqui foi apoiado por Charles River.
Referências
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados