Method Article
Multiplexed Florometrik immunoassay Test Metodolojisi ve Sorun Giderme
Özet
Luminex Corporation Xmap mikroküre teknolojisini kullanarak, çeşitli laboratuvar hayvanı türlerinin serosurveillance için Multiplexed Florometrik immunoassay (MFIA) geliştirdik. MFIA antijeni, doku kontrolü veya immünglobulin kovalent renk kodlu polistiren mikroküreler bağlantılı bir süspansiyon mikroarray olduğunu. MFIA test yöntemi hem de çeşitli giderme konularını ele almaktadır.
Özet
Biyomedikal araştırmalarda kullanılan hayvan modellerinin kalitesini sağlamak için biz hayvanlar adventif enfeksiyöz ajanlar (mycoplasma virüsler, ve diğer titiz mikroorganizmalar) maruz kalmış olmadığını belirlemek için tanısal test stratejileri ve yöntemleri bir dizi geliştirdik. Immünkompetan hayvanların Enfeksiyonlar genellikle geçicidir, henüz enfeksiyona serum antikor yanıtları genellikle hafta için gün içinde tespit edilebilir ve konağın ömrü boyunca devam etmektedir. Seroloji laboratuvar hayvanları izlenmektedir hangi birincil tanısal yöntemdir. Tarihsel dolaylı enzim-linked immunosorbent assay (ELISA) serosurveillance için temel tarama yöntemi olmuştur. ELISA bir mikrobik antijen-antikor reaksiyonu başına iyi ölçüldüğü, bir singleplex olarak gerçekleştirilir. Buna karşılık MFIA bir çoklanmış tahlil olarak gerçekleştirilir. Mikroküreler 100 farklı renk kümeleri gelir bu yana, 100 kadar farklı deneyler eş zamanlı olarak yapılabilireously tek bir mikroplak iyi. Bu yenilik de, tek bir testten elde edilen bilgi miktarını artırırken rutin testler için gerekli serum, reaktifler ve disposables miktarını azaltır. Buna ek olarak, örnek sistem ve uygunluk doğrulamak için birden fazla iç kontrol boncuk birleştirmek ve böylece sonuçlarının doğruluğunu sağlamak mümkündür. Bu doku, kontrol ve numune uygunluğunu değerlendirmek için IgG anti-test serumu türler immunglobulin (αIg) kaplı boncuk seti bulunmaktadır. ELISA ve IFA içinde olduğu gibi, doku ve serum immunoglobulin spesifik olmayan bağlanma tespit eder. ΑIg kontrol (serum kontrol) serum eklendi onaylar ve serum immünglobulin türleri ile kaplı IgG kontrol boncuk (Sistem uygunluğu kontrol), etiketli reaktifler ve Luminex okuyucu düzgün çalıştığını gösteriyor ise yeterli immünoglobulin konsantrasyonu içerir.
Protokol
1. MFIA Prosedür açıklaması (Şekil 1)
- MFIA Charles River antijen kaplı polistiren mikroküreler (boncuk), test serumu, etiketli reaktifler (BAG, SPE) ve tamponlar (İlköğretim Dilüent, Assay buffer) gerektirir.
- Tepkin maddeler 96-filtre-alt mikrotitrasyon levha kuyuları ile adım adım eklenmiştir.
- Heterojen bir testi anlam inkübasyonlar reaktifleri ilişkisiz serum bileşenleri kaldırmak için filtre yıkama adımları takip veya etiketli olarak MFIA gerçekleştirilir. Yıkama çözeltisi boncuk korumak iyi filtre-dipleri aracılığıyla aspirasyon tarafından kaldırılır plaka kuyucuklara eklenir.
- MFIA deneyleri, oda sıcaklığında (27 ° C + / -2 ° C) gerçekleştirilir.
- Test serum inkübasyon adım sırasında oluşan antijen-antikor komplekslerini R-fikoeritrin-işaretli streptavidin (SPE) tarafından takip biotinlenmiş keçi anti-tür konjugatları (BAG) ile inkubasyon ile tespit edilir.
- Tahlil okuyucu içinde, boncuk her seferinde bir tane geçirmekiki lazerler maruz bir detektör. Bir lazer bir deneyde karşılık boncuk renk kümesi tanımlamak iç boyalar heyecanlandıran, diğer tahlil sırasında yakalanan fikoeritrin muhabiri boya heyecanlandırıyor. Boncuklar bir önceden belirlenmiş sayıda deney başına okunur ve fikoeritrin floresans yoğunluğunu bir medyan Flüoresans endeksi (MFI) olarak rapor edilir.
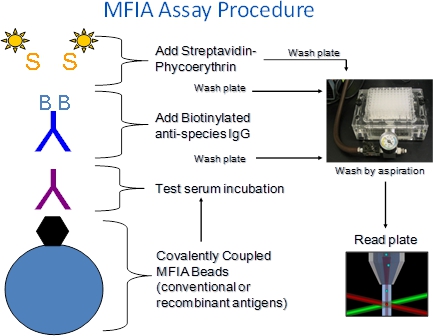
Şekil 1. MFIA Prosedürü. Xmap tabanlı MFIA antijenleri (veya kontrol) kovalent bağlı olduğu renk kodlu polistiren 5.6 mikron boncuk kullanan bir süspansiyon mikroarray olduğunu. Boncuklar 100 ayrı bir renk kümesi gelir beri boncuklar bir vakumlu manifold üzerindeki aspirasyon ile yıkandı, böylece, 100 kadar farklı testler filtre-alt mikrotiter plakalar içinde gerçekleştirilen, tek bir iyi Assay adımda gerçekleştirilebilir. Tepkiler Luminex Xmap 100 florimetre ile okunur. Phycoeryt yoğunluğuhrin floresans medyan floresan indeksi (MFI) olarak rapor edilir
2. Başlarken önce aşağıdaki hususlara dikkat ediniz:
- MFIA boncuklar duyarlı ışık
- Doğrudan ışığa maruz kalma miktarını sınırlayan önemlidir. Rutin testler sırasında oluşan ışığa maruziyet normal miktarı kabul edilebilir ama uzun süreli maruz Testi okuyucu tarafından okunamaz hale boncuk photobleaching yol açabilir.
- Bu MFIA boncuklar her zaman (10-30 saniye) kullanmak için önce süspansiyon içine vortekslenerek sonra sonicated olduğunuz testin başarısı için çok önemlidir.
- Testi okuyucu sadece tek boncuk gelen bilgileri toplar. Toplulaştırılmış boncuk kümeleri artık kez okundu yol açabilir.
- Tahlil çözümler buharlaşma önlemek için tüm İnkübasyon sırasında plakası kapak ile kaplı Test plakası tutmak için emin olun.
- Gerekli Kişisel Koruyucu Ekipman: Laboratuvar mont, gllaboratuvar ortamında çalışırken oves ve göz koruması her zaman giyilmelidir.
3. Reaktifler
- Tablo 1, bir in-house MFIA laboratuvar kurmak için gerekli malzemelerin çoğu içerir. Ek veya yinelenen öğeler özel ihtiyaçlarına bağlı olarak gerekli olabilir. Bu envanter Charles River (MFIA boncuk, kontroller ve ek reaktifler) satın reaktifler dahil olmadığını lütfen unutmayın. Biotinlenmiş konjugatları ve streptavidin etiketlendi fikoeritrin çeşitli ticari kaynaklarında bulunmaktadır. Ancak Charles River edinilebilir reaktifler alternatif satıcıları veya reaktif sürü kullanarak, bizim reaktifleri ile gürültü skoru optimal sinyal verecek şekilde titre edilmiştir tavsiye edilmez.
Tablo 1. CR-RADS BioRad ve Biotek gelen otomatik mikroplak yıkayıcı bir Bioplex Süspansiyon Dizi Okuyucu kullanır. Eşdeğer enstrümantasyon alternatif satıcıları edinilebilir.
Madde Satıcı Katalog Numarası Ekipman Süspansiyon dizi okuyucu * BioRad 171-000205 96 çukurlu bir mikrolevhadaki yıkayıcı Biotek ELX50/8FMW Ultrasonik temizleyici / banyo Cole Palmer EW0884900 Analog vorteks karıştırıcı VWR 58816-121 -20 ° C derin dondurucu Çeşitli 4 ° C'de soğutma cihazı Çeşitli 12-kanallı pipet, 20-200μl VWR 83009-718 Orbital plaka çalkalayıcı VWR / Lab-Line 57019-600 Ipuçları Tek kanallı pipet, 20-200μl, VWR 83009-732 Ipuçları Tek kanallı pipet, 2-20uL, VWR 83009-726 Ipuçları Tek kanallı pipet, 100-1000μl, VWR 83009-736 Vacushield havalandırma cihazı VWR 55095-006 Vakum basınç pompası VWR 54908-037 Vakum sistemi atık haznesi VWR 80200-640 Sarf 96-polystryrene plaka Fisher Scientific 14-245-145 MultiScreen HTS-BV plaka, 1.2μm filtresi, stiren Millipore MSBV N12 50 15ml konik tüpler (polipropilen) Sarstedt 62554.002 50ml konik tüpler (polipropilen) Sarstedt 62547.004 Serum şişeleri Sarstedt 72694.007 Alüminyum folyo VWR 89079-068 1L şişeleri, steril VWR 28199-246 0.22μm şişe üstü filtreler VWR 28199-307 Reaktif rezervuar (100ml) VWR 82026-356 Sıvı reaktifler dağıtımı için 5ml, 10ml, 25ml pipetler VWR Reaktifler PBS, pH 7.4 1 BSA, tozu (poşet) Sigma P3813 ProClin 300 Sigma / Supelco 48912-U Mikroküreler Kaplanmamış Luminex türüne göre değişmektedir
4. Reaktif Hazırlama
- İki tamponlar MFIA işlem için gereklidir. Birincil Dilüent Charles River mevcuttur ve non-spesifik protein etkileşimleri azaltmak için özel bloke edici ajanlar içerir. Test yıkama tamponu ticari olarak mevcut reajanlardır ile tesis yapılır.
- Test Yıkama tamponu: PBS /% 1 BSA, pH 7.4, Sigma-Aldrich bir toz olarak kullanılabilir.
- Parçacık tahlil okuyucu tıkanmasına neden olabilir gibi süzme ile, partikül kaldırılmasını önemlidir. Steril, etiketli kaplara bir 0.2micron şişe üstü filtre ünitesi ile tampon filtreleyin.
- BAG ve SPE Assay Yıkama tamponu kendi 2X çalışma konsantrasyonu seyreltilir. Not: SPE ışığa duyarlı ve sh olduğunuould sınırlı ışık pozlama var.
5. Örnek Hazırlanması
- Sizin test materyalleri, reaktifler ve disposables birleştirin.
- Çoklu ve tek kanallı mikropipetler ve ipuçları
- 96-düşük protein bağlama mikrotiter plakalar (serum dilüsyon) ve filtre-alt plakalar (MFIA assay)
- Standart prosedüre göre kan örnekleri toplayın. Tam santrifüj ve serum kaldırılmadan önce en az 30 dakika boyunca oda sıcaklığında onları tutarak pıhtı kan örneklerinde izin verin. Undilute serum örneği alınmasından önce serum bileşenlerini karıştırmak için kısaca vortekslenerek olmalıdır.
- MFIA için son test dilüsyon 1/50 olduğunu. Bu tahlil için, test serum bir 2X (1/25) örnek yapmak için gereklidir. 24 parça MFIA İlköğretim Dilüent serum 1 kısım ekleyerek sulandırılmamış test serumu seyreltin. Bir 96-kuyu mikrotiter plaka test serum Organizasyonu büyük ölçüde tes için örnekler arasında aktarma süresini kısaltırt plaka ve şiddetle tavsiye edilir.
6. Testi Plaka Hazırlık
- 96-Test plakası Ön-ıslatma uygun, hatta iyi tahliye sağlamak için gereklidir. Tüm plaka bu adım gerekli olan ilk olarak kullanılmaz bile, sonradan reaktif eklemek ya da hazneyi ile tampon yıkama için gerek kalmaz.
- Bazı laboratuvarlar test plakasına ve daha sonraki bir tarihte bu kuyuların yeniden kullanmak planı üzerinde kullanılmayan kuyuları mühürledi tarafından tam 96-plaka daha az çalıştırın. Biz Test plakası uygun filtrasyon etkileyebilir beri bu yöntemi kullanmanızı tavsiye etmiyoruz.
- Uygun test plakasına aspirasyon MFIA testin başarısı için çok önemlidir. Örnek kuyuların Tahliye yaklaşık 5-10 saniye sürer. Çok hızlı bir şekilde iyi içeriği Çekiş Testin sonunda, damla toplama ve yavaş okuma kez yol açabilir.
- Her w sonra kağıt havlu ile test plakasının alt Blotsıvı drenajı sağlamak için kül adım durdu. Test plakası leke uyulmaması Keçi anti-tür ve / veya türler IgG boncuk puanları başarısız kuluçka ve sonuç sırasında kuyulardan esneklik sıvı reaktifler yol açabilir. Bu boncuk birincil serum ve etiketlenmiş reaktiflerin uygun miktar her bir oyuğa ilave edilir, önceden belirlenmiş bir aralık içinde MFI skor şekilde tasarlanmıştır.
7. MFIA Boncuk Süspansiyon Hazırlama
- Bu boncuklar her zaman vortekslenerek kullanmadan önce sonicated olduğu testin başarısı için çok önemlidir. Tahlil okuyucu sadece tek boncuk gelen bilgileri toplar, boncuk toplamları veya kümeleri uzun defa okundu yol açabilir.
- Vorteks stok birleştiğinde boncuk süspansiyonu (tipik olarak 10 ± 5 saniye)
- 10-20 saniye için bir sonikatör banyosunda sonikasyon takiben boncuklar yeniden süspanse edin.
- İlköğretim Dilüent bir 2X çalışan boncuk süspansiyon 20X stok süspansiyon seyreltin. 2X boncuk süspansiyonu 50μl dağıtınıslatılmalı Testi Plate de her bir deney için.
8. Testi Plate Test ve Kontrol Sera eklenmesi
- Her 2X test edin ve önceden tanımlanmış plaka haritası dayalı Testi Plaka serum Kontrol Pipet 50μl. Elastik bir bant veya alüminyum folyo ile plaka ve oda sıcaklığında karanlıkta orbital çalkalayıcı üzerinde 60minutes için Test Plakası inkübe Güvenli kapak.
- Çalkalayıcı hızı 400 den büyük ama 700Rpm az olmalıdır. Bu boncuklar serum antikorları birleştiğinde antijenlerin tüm yüzeyleri erişimine izin vermek için askıya tutulması önemlidir. Boncuk askıya tutmakta başarısız düşük IgG boncuk kontrol puanları neden olur ve tahlil tekrarlanması gerekir.
9. Testi Tabak Yıkama
- Bir vakum manifoldu kullanılarak iyice içeriğini aspire. Örnek kuyuların Tahliye yaklaşık 5-10 saniye sürer.
- Pape ile deney plakasının alt Blotsıvı drenajı sağlamak için her türlü sonra r havlu durdu.
- Test yıkama tamponu 50μl olarak boncuklar yeniden süspanse edin. Bu boncuk tahlil işlem sırasında kurumasına izin verilmemesi önemlidir.
10. Testi Plate BAG ve SPE ekleme
- MFIA boncuklar içeren tüm kuyulara 2X çalışma seyreltme BAG 50μl dağıtın. Elastik bir bant veya alüminyum folyo ile plaka kapağı sabitleyin. Oda sıcaklığında, karanlıkta, yukarıdaki gibi sallama ile 30 dakika için test plakasına inkübe edin.
- Bu inkübasyon Testi Plaka yıkayın ve önceden serum ilavesinden sonra açıklandığı gibi Assay Yıkama tamponu ile tekrar süspansiyon boncuk sonra.
- MFIA boncuklar içeren tüm kuyulara 2X çalışma seyreltme SPE 50μl dağıtın. Elastik bir bant veya alüminyum folyo ile plaka kapağı sabitleyin. Oda sıcaklığında, karanlıkta, yukarıdaki gibi sallama ile 30 dakika için test plakasına inkübe edin.
- Bu incu sonrabation Testi Plaka yıkayın ve Assay Yıkama tampon 125μl ile boncuklar tekrar süspansiyon ve önceki tahlil okuyucuya yerleştirerek boncuklar tekrar süspansiyon ~ iki dakika plakası sallayın.
11. Testi Plaka Okuma
- Boncuk resuspending 10 dakika içinde test okuyucu test plakasına yerleştirin. Bir elektrik kesintisi veya başka bir olay durumunda, Test Plakası 12 saate kadar okumak için hazır olana kadar karanlıkta oda sıcaklığında saklanabilir.
- Seçilen boncuk paneli testi kuyularda boncuk profil eşleştiğini doğrulamak için de ilk örnek gözlemleyin. Protokol ekranda onların belirleyeceği 'boncuk bölgenin dışında kalan boncuklar varsa, yanlış bir profil seçimi yapılmadı.
- Boncuk düzgün süspanse edilmiş ise onlar girmeniz gerekir tahlil okuyucu yazılımı belirtilen kendi Belirtilen 'bölgeler'.
- Boncuklar toplanır Eğer onlar yavaş tesisindeki bölgelerinde dolduracakoranı. Siz okuyucu testi plaka kaldırmak ve el kuyular tekrar süspansiyon yapabilirsiniz. Boncuk agrega kırma yardımcı olmak için bir çok kanallı pipet 3-4 kez her iyi Karışım. Okuyucu testi plakasını değiştirin ve devam edin.
12. Temsilcisi Sonuçlar
- Boncuklar bir minimum sayıda deney başına okunur ve fikoeritrin floresan yoğunluğu 0 ila 32.667 arasında değişen bir ortalama floresans endeksi (MFI) olarak rapor edilir. 25 sayıları karşılaştırarak sonra, kuyu başına 50 veya 100 boncuk biz anlamlı bir fark gördüm ve rutin de numune başına ajan başına 25 boncuk saymak. Örneğin yetersiz boncuk sayım veya IgG / anti-IgG boncuk puanları başarısız gibi hatalar için sonuç raporu inceleyin. Bu boncuk birincil serum ve etiketlenmiş reaktiflerin uygun miktar her bir oyuğa ilave edilir, önceden belirlenmiş bir aralık içinde MFI 'skor' için tasarlanmıştır. Hataları ile örnek kuyu, (düşük boncuk sayım) veya başarısız IgG kontrolü boncuk puanları gerekirgeçerli sonuçlar elde etmek için tekrarlanır.
- Bir Excel çalışma sayfasına sonuçları aktarın. Bizim veri yorumlama için her bir deney atanır:
- Bir Doku Kontrolü (TC) Testi: En kemirgen MFIA testlerde, doku, kontrol vahşi tip bakülovirüs-enfekte böcek hücreleri bir özüdür.
- Bir Assay Cutoff: Bu değer, beklenen minimum floresans ve tanısal doğruluğu artırmak için her bir deney için ayarlanır. Çoğu testlerde, floresans cutoff 3000.
- Ortalama net Flüoresans endeksi (MFI) aşağıdaki formül ile her bir deney (doku ve IgG kontrol testleri dışında) için hesaplanmıştır. Diğer bir deyişle, söz konusu test sinyalinin sadece 0-32 yerine 0-32,667 arasındaki net MFI aralığını belirler toplam tahlil MFI eksi TC (geri plan) MFI Bu değer daha sonra 1000 ile ayrılır.
Net MFI = (MFI Antikor Testi - MFI Doku Kontrolü) / 1000
Net MFI ve TC MFI her antijen için spesifik Test Kesim kıyasla puanları dönüştürülür.
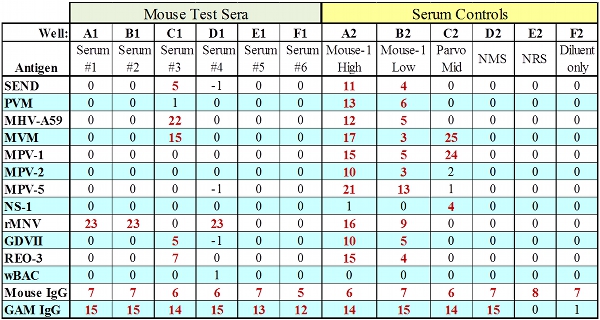
Şekil 2. Hepsi IgG ile test serumu için Örnek MFIA veri geçirerek denetler.
- 12.4 MFIA Yorumlama
- Sistem Uygunluk Kontrolü ve Serum Kontrolü (IgG / anti-IgG boncuk) sonuçları Tablo 2'de listelenen kabul kriterleri karşılamak durumunda Testi Plakalı sonuçlar yorumlanmalıdır. Bu iki IgG kontrol boncuk Başarısızlık böyle uygunsuz seyreltme veya yetersiz miktarda konjuge veya bir immunocomprimised hayvandan serum SPE, yanlış testi serum seyreltme veya kullanımı gibi birçok usul hataları gösterebilir.
Tablo 2
Assay Kontroller için Kabul Kriterleri Kontrol Memnuniyet Sonucu Skor Sınıflandırma Yüksek Menzil İmmün Serum ≥ 4,5 Olumlu Düşük Menzil İmmün Serum ≥ 1.5 ≥ Borderline Non-immün serum <2.5 ≤ Borderline Seyreltici <2.5 ≤ Borderline Ig Boncuk * Set ≥ Cutoff/1000 Geçmek * Boncuk türe özgü anti-testi serum immunglobulin (Ig) ile kaplı ayarlayın: Bu örnek uygunluk denetimi için başarısız puanları çok yüksek, yetersiz numune ilavesinden neden olabilecek bir immünyetmezligi ho bir seyrelme, yanlış tür veya test serumust.
- Testi Plate Test Kontrolleri herhangi Yüksek Oranda Bağışıklık Serum dışında başarısız olursa, sonuç kabul edilemez ve tekrar edilmelidir. O Test plakası algılama hassasiyet seviyesi göstermektedir yana geçen Düşük aralık Serum kontrol puanları önemlidir.
- Keçi anti-IgG tür boncuk skor tahlil eklendi birinci deney serum miktarına dayanmaktadır. Bu denetim boncuk başarısız ama türler IgG (Eh B1, Şek.3) geçerse o kadar test reaktifleri (BAG, SPE) de test eklenmiştir gösterir ve bu serum ile ilgili bir konudur. Test reaktifleri miktarı, belli bir yetersiz ise IgG ve anti-IgG kontrol boncuklar hem başarısız (Eh E1, Şek.3) olacaktır.
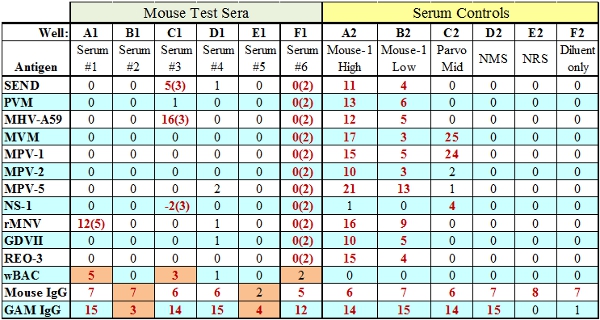
Şekil 3. Başarısızlıkları ile Örnek MFIA test sonuçları (turuncu gösterilir). Wells A1, C1 ve F1 TC (doku reaktif) arıza belirtisiburada TC skoru parantez içinde gösterilir. Wells B1 ve E1 IgG iç kontrol hataları, yetersiz testi antikor (B1) veya BAG / SPE sırasıyla test reaktifleri (E1) iki tür göstermektedir.
- Deney plaka deneyinde kontrol sonuçlar tatmin edici ise Tablo 3'te gösterildiği gibi, bireysel tahlil skorları sınıflandırılır. Bu alternatif bir test yöntemi, herhangi bir sınırda ya da pozitif bir bulgu onaylamak için çok önemlidir.
Tablo 3
MFIA Puan Sınıflandırma Skor Sınıflandırma TC Net TC + Net * ≥ 2 <0.5 <2.5 Negatif (-) ≥ 0.5 ≥ 2,5 Reaksiyon TC (T) <2 <1.5 - 1.5 ≤ X <2.5 Borderline (B) ≥ 2,5 Pozitif (+) * Negatif bir sınıflama halen sağlanan sıfırdan TC skoru ile tespit edilebilir TC + Net skoru (= Ag puan) negatif
- Sistem Uygunluk Kontrolü ve Serum Kontrolü (IgG / anti-IgG boncuk) sonuçları Tablo 2'de listelenen kabul kriterleri karşılamak durumunda Testi Plakalı sonuçlar yorumlanmalıdır. Bu iki IgG kontrol boncuk Başarısızlık böyle uygunsuz seyreltme veya yetersiz miktarda konjuge veya bir immunocomprimised hayvandan serum SPE, yanlış testi serum seyreltme veya kullanımı gibi birçok usul hataları gösterebilir.
Tartışmalar
MFIA test süreci geleneksel singleplex testlerine göre daha az ekipman ve küçük numune ve reaktif hacimlerini gerektiren, son derece verimlidir. Multipleks sisteminin işlevselliği kullanıcı laboratuvar kemirgenler ortak ajanların birden fazla suşları veya serotipler (yani Coronavirüs, parvovirüsler vb) için eş zamanlı olarak taranması için esneklik sağlar. Bu da faiz (yani belirli virüs ailesi) alanında dayalı özelleştirilmiş boncuk paneller tasarımı, bize sağlar ve sitokinler ve diğer biyobelirteçlerin gibi biyomoleküllerin tarama diğer türleri uyarlanabilir. Buna ek olarak, bize örnek sistem ve uygunluk doğrulamak için çeşitli iç kontrol deneyleri birleştirmek ve böylece sonuçlarının doğruluğunu sağlamak için olanak sağlar. Bu doku, kontrol ve numune uygunluğunu değerlendirmek için IgG anti-test serumu türler immunglobulin (αIg) kaplı boncuk seti bulunmaktadır. Bir doku kontrol boncuk serum immunoglobulin spesifik olmayan bağlanma ve αIg boncuk kontrol teyit algılarserum ilave edilir ve yeterli bir immünoglobülin konsantrasyon içermemektedir. Serum immünglobulin türleri ile kaplı diğer bir kontrolü boncuk, etiketli reaktifler ve tahlil okuyucu düzgün çalıştığını gösteriyor. Diğer ticari multipleks biçimi serolojik testler (yani microarrays, ImmunoComb) sonucu teyit Bu aynı düzeyde satışa sunmamış olabilir.
Önceden deneye için tahlil başarısızlık olası kaynak daraltmak için yeteneği bir araştırmacı zaman ve malzeme tasarrufu yardımcı olabilir. MFIA Kritik yönlerini başarısız bir örnek tekrarlanmadan önce teyit edilmelidir. Tahlil çevre sıcaklığında gerçekleştirilmektedir yana laboratuar sıcaklığında yaklaşık 27 olduğunu teyit edilmelidir ° C ± 2 ° C, daha yüksek sıcaklıklar kontrol ve numune için beklenen ölçüme göre daha düşük olmasına yol açan olabilir. Yıkama belki tayininde en önemli adımdır. Test plakası düzgün yıkanmış olduğundan sigorta, lekelenen ve ortadan kaldırabilir tekrar süspanseDüşük boncuk sayısı (toplu boncuk nedeniyle) veya yetersiz reaktif ekleme (testi plaka filtresi alt dışarı ıslanma tarafından kayıp) nedeniyle örnekleme hataları büyük çoğunluğu. Biz rutin tahlil başına 25 boncuk (ajan) saymak ve ayrıca plaka için uzun bir okuma zaman götürecek boncuk yüksek sayarak sonuçları arasında istatistiksel olarak anlamlı bir fark bulduk.
Biz bilinen pozitif ve negatif serum örneklerinde çok sayıda test ederek tanısal doğruluk, tekrarlanabilirlik ve sağlamlık göstermek için sık kullanılan laboratuar hayvanlarının çeşitli türler (Fare, Sıçan, hamster, kobay ve tavşan) üzerinde MFIA kapsamlı validasyon çalışmaları yapılmıştır ve adres Onların ELISA, IFA ve MFIA sonuçları karşılaştırarak. MFIA ve tespit limitleri (örneğin, standart immün serum titrasyon bitiş noktası) karşılaştırılabilir ve bazı durumlarda ilgili ELISA olanlar aştı. SPF kemirgen sera ile ölçülen Teşhis özgüllük,% 99 aştı; genel yazışmalar between ELISA ve MFIA% 95 daha fazlaydı bilinen pozitif ve bilinen negatif kontrol serumları uygulandı. Özetle, bu sonuçlar multipleks MFIA singleplex ELISA için iyi bir alternatif olduğunu ve laboratuvar hayvanı kolonileri rutin serosurveillance kullanım amacına, yani için uygun olduğunu kanıtladı.
Açıklamalar
Charles River RADS, hayvan seroloji test hizmetleri ve reaktifler önemli bir sağlayıcısı için tüm yazarlar iş.
Teşekkürler
Burada sunulan araştırma Charles River tarafından desteklenmiştir.
Referanslar
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır