Method Article
Multiplex fluorimetrico Metodologia di test immunoenzimatico e risoluzione dei problemi
In questo articolo
Riepilogo
Utilizzo di microsfere Luminex Corporation xMAP tecnologia, abbiamo sviluppato il immunoenzimatico Multiplexed fluorimetrico (MFIA) per sierosorveglianza di varie specie di animali da laboratorio. Il MFIA è un microarray sospensione dove antigene, controllo di tessuto o immunoglobuline sono legati covalentemente a microsfere di polistirene codice colore. Il metodo di prova MFIA così come i vari argomenti di risoluzione dei problemi è indirizzata.
Abstract
Al fine di garantire la qualità dei modelli animali utilizzati nella ricerca biomedica, abbiamo sviluppato una serie di strategie di sperimentazione e dei metodi diagnostici per determinare se gli animali sono stati esposti a accidentali agenti infettivi (virus, micoplasmi, e altri microrganismi esigenti). Infezioni di animali immunocompetenti sono generalmente transitori, ma le risposte anticorpali sierici infezione spesso possono essere rilevate entro giorni o settimane e persistono per tutta la vita dell'ospite. La sierologia è il metodo diagnostico primario attraverso il quale vengono monitorati animali da laboratorio. Storicamente la indiretto enzyme-linked test immunoenzimatico (ELISA) è stato il principale metodo di screening per sierosorveglianza. L'ELISA è eseguita come singleplex, in cui uno microbica reazione antigene-anticorpo è misurato per pozzetto. In confronto la MFIA viene eseguita come saggio multiplex. Dal momento che le microsfere sono in 100 set di colori distinti, fino a 100 diversi test possono essere eseguiti Simultanogni cambio in una micropiastra solo bene. Questa innovazione diminuisce la quantità di siero, reagenti e prodotti monouso necessarie per il test di routine, aumentando la quantità di informazioni ottenute da un singolo test ben. Inoltre, siamo in grado di integrare molteplici sfere di controllo interno per verificare l'idoneità del campione e sistema e quindi garantire l'accuratezza dei risultati. Questi includono il controllo di tessuti e IgG anti-immunoglobulina specie di prova del siero (αIg) rivestite insiemi di sferette per valutare l'idoneità del campione. Come in ELISA e IFA, il controllo di tessuto rileva legame non specifico di immunoglobulina sierica. Il controllo αIg (siero di controllo) conferma che il siero è stato aggiunto e contiene una concentrazione sufficiente di immunoglobuline IgG, mentre la sfera di controllo (idoneità del sistema di controllo), ricoperti di siero di immunoglobuline specie, dimostra che i reagenti marcati e Luminex lettore funzionino correttamente.
Protocollo
1. Spiegazione della procedura MFIA (Figura 1)
- Il MFIA richiede antigene rivestito Charles River microsfere di polistirene (perle), sieri, reagenti marcati (BAG, SPE) e buffer (Diluente primaria, tampone).
- I reagenti sono aggiunti gradualmente ai pozzetti di piastre a 96 pozzetti con fondo filtro piastre di microtitolazione.
- Il MFIA viene eseguita come un eterogenei incubazioni significato del test sono seguite da filtro-lavaggio procedura per rimuovere componenti del siero non legati o etichettati reagenti. Soluzione di lavaggio aggiunto alla piastra pozzetti viene rimosso mediante aspirazione attraverso oltre filtro-bottoms, che trattengono i talloni.
- I saggi MFIA vengono eseguiti a temperatura ambiente (27 ° C + / -2 ° C).
- Complessi antigene-anticorpo formatisi durante la fase di test siero incubazione vengono rilevati mediante incubazione con biotinilato di capra anti-specie coniugati (BAG) seguiti da R-ficoeritrina-streptavidina marcata (SPE).
- Nel lettore di dosaggio, le perline passare uno alla volta attraversoun rivelatore dove sono esposti a due laser. Uno eccita i coloranti interne che identificano set di colori del tallone, che corrisponde ad un saggio, l'altro eccita il colorante ficoeritrina giornalista catturati durante il dosaggio. Un predeterminato numero di perle sono letti per dosaggio e l'intensità di fluorescenza ficoeritrina è riportata come un indice medio di fluorescenza (MFI).
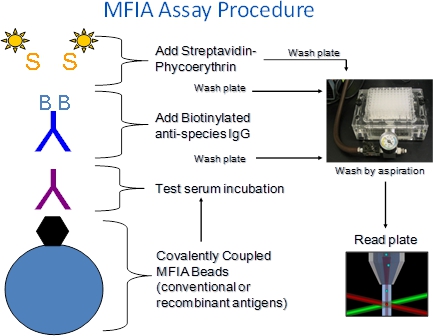
Figura 1. Procedura MFIA. Il xMAP basata MFIA è un microarray sospensione che utilizza colorate perline di polistirene 5,6 micron a cui antigeni (o controlli) sono legati covalentemente. Poiché le perline vengono in 100 set di colori distinti, ben 100 differenti test può essere eseguito in un passo singolo dosaggio e vengono eseguite in filtro-bottom piastre di microtitolazione in modo che le microsfere possono essere lavati con aspirazione su un collettore sotto vuoto. Le reazioni vengono letti con il xMAP Luminex 100 fluorimetro. L'intensità di phycoerythrin fluorescenza viene segnalato come un indice medio di fluorescenza (MFI)
2. Operazioni preliminari Si prega di notare quanto segue:
- Le perle MFIA sono sensibili alla luce
- Limitando la quantità di luce diretta è cruciale. La normale quantità di esposizione alla luce che si verifica durante le prove di routine è accettabile ma l'esposizione prolungata può portare alla fotodegradazione delle perle che rendono illeggibili dal lettore del saggio.
- È fondamentale per il successo del test che le perle sono sempre MFIA vortexate in sospensione e quindi sonicato (10-30 secondi) prima dell'uso.
- Il lettore saggio raccoglie informazioni da perline singole. Aggregati cluster tallone può portare a leggere più volte.
- Essere sicuri di mantenere la piastra di prova coperto con il coperchio piatto in tutte le fasi di incubazione per evitare l'evaporazione delle soluzioni da dosare.
- Dispositivi di Protezione Individuale richiesti: camice da laboratorio, gloves e occhiali di protezione devono essere indossati in ogni momento mentre si lavora in un ambiente di laboratorio.
3. Reagenti
- Tabella 1 include la maggior parte dei materiali necessarie per istituire un laboratorio interno MFIA. Elementi aggiuntivi o duplicato può essere necessario a seconda delle esigenze specifiche. Si prega di notare che questo inventario esclude reagenti acquistati da Charles River (perline MFIA, controlli e reagenti supplementari). Diverse fonti commerciali di coniugati biotinilati e ficoeritrina streptavidina tag sono disponibili. Tuttavia i reagenti disponibili da Charles River sono stati titolati per ottenere il segnale ottimale a segnare rumore con i nostri reagenti, utilizzando fornitori alternativi o lotti di reagenti non è raccomandato.
Tabella 1. CR-RADS utilizza un lettore di Bioplex Array Sospensione dal BioRad e lavatore automatico di micropiastre da BioTek. Strumentazione equivalente è disponibile da fornitori alternativi.
Voce Venditore Numero di catalogo Attrezzatura Sospensione matrice lettore * BioRad 171-000205 96 pozzetti di lavaggio per micropiastre BioTek ELX50/8FMW Pulitore ad ultrasuoni / bagno Cole Palmer EW0884900 Vortex mixer analogico VWR 58816-121 -20 ° C freezer Vario 4 ° C frigorifero Vario 12-channel pipettatore, 20-200μl VWR 83009-718 Orbitale tavola oscillante VWR / Lab-Line 57019-600 Singolo canale pipette, 20-200μl, con punte VWR 83009-732 Singolo canale pipette, 2-20μl, con punte VWR 83009-726 Singolo canale pipette, 100-1000μl, con punte VWR 83009-736 Vacushield dispositivo di sfiato VWR 55095-006 Pressione della pompa del vuoto VWR 54908-037 Sistema di serbatoio vuoto rifiuti VWR 80200-640 Monouso 96 pozzetti piastra di polistirolo Fisher Scientific 14-245-145 MultiScreen HTS-BV piastra, filtro 1.2μm, stirene Millipore MSBV N12 50 Provette coniche da 15ml (polipropilene) Sarstedt 62554.002 50 ml provette coniche (polipropilene) Sarstedt 62547.004 Fiale di siero Sarstedt 72694.007 Foglio di alluminio VWR 89079-068 Bottiglie 1L, sterile VWR 28199-246 0.22μm bottiglia migliori filtri VWR 28199-307 Serbatoi di reagente (100 ml) VWR 82026-356 5ml, 10ml, 25ml pipette per il dosaggio di reagenti liquidi VWR Reagenti PBS, pH 7,4 1 BSA, polvere (sacchetti) Sigma P3813 ProClin 300 Sigma / Supelco 48912-U Uncoated microsfere Luminex varia in base al tipo
4. Preparazione dei reagenti
- Due buffer sono necessari per la procedura MFIA. Diluente primario è disponibile da Charles River e contiene proprietà bloccanti per ridurre interazioni non specifiche di proteine. Tampone di lavaggio del test viene effettuato presso la vostra struttura con i reagenti disponibili in commercio.
- Dosaggio Wash Buffer: PBS / 1% BSA pH 7,4 è disponibile come polvere da Sigma-Aldrich.
- Rimozione di particolato per filtrazione è critica come queste particelle possono causare intasamenti nel lettore dosaggio. Filtrare il buffer tramite un 0.2micron per bottiglia unità filtro in sterili, contenitori etichettati.
- BAG e SPE sono diluiti alla loro concentrazione 2X lavoro nel tampone del saggio di lavaggio. Nota: SPE è sensibile alla luce e should hanno limitato l'esposizione alla luce.
5. Preparazione del campione
- Assemblare il materiale di prova, reagenti e materiali di consumo.
- Micropipette multi-e single-channel e suggerimenti
- 96 pozzetti a basso contenuto proteico micropiastre vincolanti (diluizioni di siero) e filtro a fondo piatti (saggio MFIA)
- Raccogliere campioni di sangue in base alle proprie procedure standard. Sottoporre i campioni di sangue di coagulare completamente tenendole a temperatura ambiente per almeno 30 minuti prima della centrifugazione e la rimozione del siero. Undilute siero devono essere agitati brevemente per miscelare i componenti del siero prima del prelievo.
- La diluizione collaudo finale per il MFIA è 1/50. È necessario fare una 2X (1/25) del campione di siero del test per il dosaggio. Diluire i sieri non diluiti di prova con l'aggiunta di 1 parte di siero a 24 parti di diluente MFIA primaria. Organizzazione del siero del test in una piastra a 96 pozzetti microtitolo riduce notevolmente il tempo di trasferimento dei campioni ai tespiastra t ed è altamente raccomandato.
6. Test di piastra di preparazione
- Pre-bagnare la piastra a 96 pozzetti si richiede la prova per assicurarne un corretto, anche ben evacuazione. Anche se l'intera piastra non verrà utilizzato questo passo è inizialmente richiesto, non sarà necessario aggiungere reagente successivo o tampone di lavaggio ai pozzetti vuoti.
- Alcuni laboratori di eseguire meno di un pieno piastra a 96 pozzetti isolando i pozzetti non utilizzati sulla piastra di prova e il piano di ri-utilizzare questi pozzi in un secondo momento. Non è consigliabile utilizzare questo metodo in quanto possono influire sul corretto filtraggio della piastra di prova.
- Corretta aspirazione piastra di prova è cruciale per il successo del test MFIA. Evacuazione dei pozzetti del campione dovrebbe prendere circa 5-10 secondi. Aspirare il contenuto dei pozzetti troppo rapidamente può portare a tallone aggregazione e lenti tempi di lettura al termine del saggio.
- Asciugare la parte inferiore della piastra di prova con carta assorbente dopo ogni wpasso cenere per assicurare il drenaggio del liquido si è fermato. La mancata asciugare la piastra di prova può portare a reagenti liquidi assorbenti fuori dei pozzetti durante l'incubazione e il risultato non avendo di capra anti-specie e / o Specie IgG punteggi tallone. Queste perle sono progettati per segnare entro un predeterminato intervallo MFI quando la quantità appropriata di siero primario e reagenti marcati vengono aggiunti a ciascun pozzetto.
7. MFIA perlina Sospensione Preparazione
- È fondamentale per il successo del dosaggio delle microsfere sempre vortexate e sonicato prima dell'uso. Il lettore saggio raccoglie informazioni da perline singole solo, aggregati tallone o grumi può portare a leggere più volte.
- Vortex lo stock accoppiato tallone sospensione (in genere 10 ± 5 secondi)
- Risospendere le sfere seguito da sonicazione in un bagno sonicatore per 10-20 secondi.
- Diluire la sospensione madre 20X ad un 2X sospensione di lavoro tallone nel diluente primario. Dispensare 50μl della sospensione 2X talloneper ogni dosaggio ben del pre-bagnato piastra di prova.
8. L'aggiunta di sieri di prova e di controllo per la piastra di prova
- Pipettare 50μl di ciascun test 2X e siero di controllo alla piattaforma di prova basato sulla mappa piatto predefinito. Coperchio sicuro alla piastra con un elastico o un foglio di alluminio e incubare la piastra di prova per 60 minuti su agitatore orbitale, al buio a temperatura ambiente.
- La velocità agitatore dovrebbe essere maggiore di 400 ma inferiore a 700rpm. È fondamentale che le perline essere tenuti in sospensione per consentire anticorpi sierici di accedere a tutte le superfici degli antigeni accoppiati. Mancata mantenere le microsfere in sospensione si tradurrà in basso IgG punteggi sfera di controllo e il test dovrà essere ripetuto.
9. Lavare la piastra di prova
- Aspirare il contenuto dei pozzetti usando un collettore di vuoto. Evacuazione dei pozzetti del campione dovrebbe prendere circa 5-10 secondi.
- Asciugare la parte inferiore della piastra di prova con papeasciugamani dopo ogni r per garantire il drenaggio del liquido si è fermato.
- Risospendere le sfere in 50μl di tampone di lavaggio. È importante che le microsfere non possono asciugarsi durante il processo di saggio.
10. Aggiunta di BAG e SPE alla piattaforma di prova
- Dispensare 50μl di 2X BORSA diluizione di lavoro a tutti i pozzetti contenenti perline MFIA. Fissare il coperchio alla piastra con un elastico o un foglio di alluminio. Incubare la piastra di prova per 30 minuti con agitazione di cui sopra, al buio a temperatura ambiente.
- Dopo questa incubazione lavare la piastra di prova e risospendere le sfere con il tampone di lavaggio test come descritto in precedenza in seguito aggiunta di siero.
- Dispensare 50μl di 2X SPE diluizione di lavoro a tutti i pozzetti contenenti perline MFIA. Fissare il coperchio alla piastra con un elastico o un foglio di alluminio. Incubare la piastra di prova per 30 minuti con agitazione di cui sopra, al buio a temperatura ambiente.
- Dopo questo incudi incubazione lavare la piastra di prova e risospendere le sfere con 125μl di tampone di lavaggio e agitare la piastra per ~ due minuti per risospendere le sfere prima di mettere nel lettore di test.
11. Lettura della piastra di prova
- Posizionare la piastra di prova nel lettore analisi entro 10 minuti risospendere le sfere. In caso di mancanza di corrente o altro incidente, la piastra di prova può essere conservato a temperatura ambiente al buio fino a 12 ore fino al momento di leggere.
- Osservare il campione primo pozzo per verificare che il pannello selezionato tallone corrisponde al profilo del tallone in pozzetti di test. Se ci sono perle che non rientrano 'regione del tallone' loro designato sul display protocollo, una selezione errata del profilo è stato fatto.
- Se i grani sono state correttamente risospeso devono compilare i loro specifici "regioni" indicati nel software di lettura del test.
- Se i grani vengono aggregati riempiranno nelle loro regioni ad una lentatasso. È possibile rimuovere la piastra di prova da parte del lettore e manualmente risospendere i pozzetti. Triturare ogni pozzetto con una pipetta multicanale 3-4 volte per aiutare a rompere gli aggregati tallone. Sostituire la piastra di prova nel lettore e continuare.
12. Risultati rappresentativi
- Un numero minimo di perle sono letti per dosaggio e l'intensità di fluorescenza ficoeritrina è riportata come un indice medio di fluorescenza (MFI) da 0 a 32.667. Dopo aver confrontato conti di 25, 50 o 100 perle per pozzetto abbiamo visto alcuna differenza statistica e di routine conta 25 perline per agente per ogni pozzetto. Esaminare il rapporto sui risultati di errori, come inadeguate conta tallone o, in mancanza IgG / IgG anti-punteggi tallone. Queste perle sono progettati per 'score' all'interno di un predeterminato campo di MFI quando la quantità appropriata di siero primario e reagenti marcati vengono aggiunti a ciascun pozzetto. I pozzetti dei campioni con errori, (bassa conta tallone) o, in mancanza di IgG di controllo punteggi tallone dovrebbeessere ripetuta per acquisire risultati validi.
- Esportare i risultati in un foglio di lavoro di Excel. Per la nostra interpretazione dei dati ogni test viene assegnato:
- Un Tessuto per controllo (TC) Test: Per la maggior parte dei saggi di roditori MFIA, il controllo di tessuto è un estratto di wild-type baculovirus infettate cellule di insetto.
- Un valore soglia del test: Questo valore è la fluorescenza minimo previsto e viene regolato in ogni test per ottimizzare l'accuratezza diagnostica. Per la maggior parte dei saggi, il taglio di fluorescenza è di 3000.
- Net Index fluorescenza mediana (MFI) è calcolata per ogni dosaggio (eccetto tessuti e IgG test di controllo) con la seguente formula. In altre parole, il segnale di dosaggio specifico è il dosaggio totale meno il MFI (sfondo) TC MFI Questo valore viene diviso per 1000 che definisce semplicemente la gamma di Net MFI tra 0-32 anziché 0-32,667.
Net MFI = (dosaggio degli anticorpi MFI - Tessuto per controllo MFI) / 1000
Net MFI MFI e TC vengono convertiti in punteggi rispetto al valore soglia del test specifico per ciascun antigene.
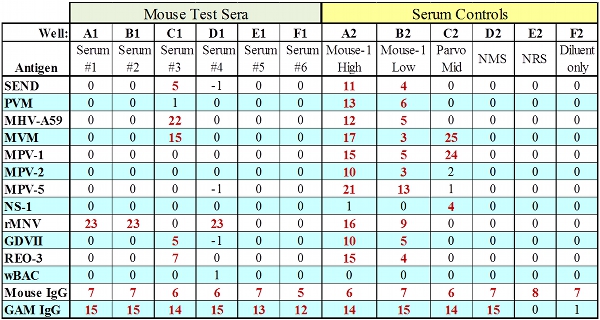
Figura 2. Dati rappresentativi MFIA per i sieri con tutte IgG controlli di passaggio.
- 12,4 MFIA Interpretazione
- Risultati della piastra di prova deve essere interpretato solo se il sistema di controllo-Idoneità e Siero di controllo (IgG / IgG anti-perle) risultati soddisfano i criteri di accettazione di cui alla tabella 2. In mancanza di queste due sfere di controllo IgG può indicare diversi errori procedurali, quali diluizione improprio o coniugato volume insufficiente o SPE, diluizione di prova improprio siero o l'utilizzo di siero di un animale immunocomprimised.
Tabella 2
Criteri di accettazione per i controlli del dosaggio Controllo Risultato accettabile Punteggio Classificazione High Range siero immune ≥ 4,5 Positivo Low Range siero immune ≥ 1,5 ≥ Borderline Non immune Siero <2,5 ≤ Borderline Diluente <2,5 ≤ Borderline Ig Bead Set * ≥ Cutoff/1000 Passare * Tallone set rivestita con specie-specifico anti-siero di immunoglobuline (Ig): punteggi in mancanza di questo controllo idoneità campione potrebbe risultare dall'aggiunta del campione insufficiente, troppo alta diluizione del campione, specie errati o siero test da immunodeficienza host.
- Se uno qualsiasi dei Controlli dei Test piastra di analisi non riescono ad eccezione del siero High Range immunitario, i risultati non sono accettabili e deve essere ripetuto. Passa-basso punteggio di controllo gamma di siero sono fondamentali dal momento che dimostra il livello di sensibilità di rilevamento della piastra di prova.
- L'anti-IgG di capra specie punteggio tallone si basa sulla quantità di siero di test primario aggiunto al dosaggio. Se questo controllo non tallone ma l'IgG specie passa (Well B1, Fig.3) allora indica che i reagenti di prova sufficienti (BAG, SPE) sono stati aggiunti al pozzetto ed è un problema correlato siero. Se la quantità di reagenti di prova è insufficiente in un particolare bene sia le IgG e anti-IgG sfere di controllo avrà esito negativo (Beh E1, Fig.3).
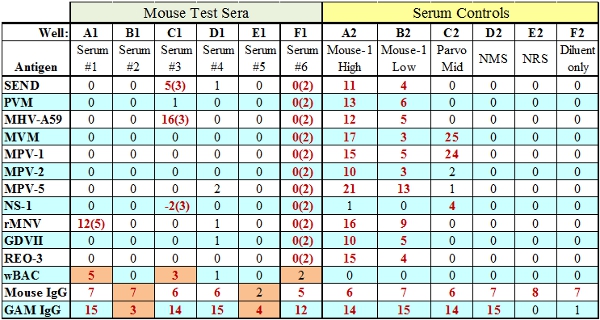
Figura 3. Rappresentativi i risultati dei test MFIA con avaria (indicate in arancione). Wells A1, C1 e F1 indicare una (reattivo tessuto) TC fallimentoin cui il punteggio TC è rappresentato tra parentesi. Wells B1 e E1 illustrare i due tipi di carenze di controllo interno, di anticorpi IgG di prova insufficiente (B1) o reagenti di prova (E1) BORSA / SPE rispettivamente.
- Se i risultati dei test di controllo del dosaggio piastre sono soddisfacenti, i punteggi delle singole analisi sono classificati come indicato nella Tabella 3. E 'fondamentale la conferma di qualsiasi risultato positivo borderline o con un metodo alternativo.
Tabella 3
MFIA Punteggio Classificazione Punteggio Classificazione TC Netto TC + * Net ≥ 2 <0,5 <2,5 Negativo (-) ≥ 0.5 ≥ 2,5 TC reazione (T) <2 <1,5 - 1,5 ≤ X <2.5 Borderline (B) ≥ 2,5 Positivo (+) * Una classificazione di negativo può ancora essere determinata con un punteggio diverso da zero a condizione che il TC TC + punteggio netto (= punteggio Ag) è negativo
- Risultati della piastra di prova deve essere interpretato solo se il sistema di controllo-Idoneità e Siero di controllo (IgG / IgG anti-perle) risultati soddisfano i criteri di accettazione di cui alla tabella 2. In mancanza di queste due sfere di controllo IgG può indicare diversi errori procedurali, quali diluizione improprio o coniugato volume insufficiente o SPE, diluizione di prova improprio siero o l'utilizzo di siero di un animale immunocomprimised.
Discussione
Il processo di test MFIA è altamente efficiente, richiedono meno materiale e più piccolo del campione e volumi di reagente rispetto ai test tradizionali singleplex. La funzionalità del sistema multiplex dà all'utente la flessibilità di schermo contemporaneamente per più ceppi o sierotipi di agenti comuni in roditori da laboratorio (cioè Coronavirus, parvovirus, ecc). Questo ci consente anche, a progettare pannelli personalizzati tallone sulla base dell'area di interesse (cioè famiglia di virus specifico) ed è adattabile a tipi di screening altre biomolecole quali citochine e altri indicatori biologici. Inoltre, ci permette di incorporare diversi saggi di controllo interno per verificare campione e idoneità sistema e quindi assicurare l'accuratezza dei risultati. Questi includono il controllo di tessuti e IgG anti-immunoglobulina specie di prova del siero (αIg) rivestite insiemi di sferette per valutare l'idoneità del campione. Un tessuto sfera di controllo rileva il legame non specifico di immunoglobulina siero e il controllo αIg tallone confermache il siero è stato aggiunto e contiene una concentrazione sufficiente di immunoglobulina. Un'altra perla di controllo, rivestito con immunoglobuline specie siero, dimostra che i reagenti marcati e lettore di test funzionano correttamente. Altri multiplex disponibili in commercio test sierologici formato (es. microarrays, ImmunoComb) non può offrire lo stesso livello di risultato conferma.
La possibilità di ridurre la possibile fonte di fallimento prima della rianalisi dosaggio può aiutare un investigatore risparmiare tempo e materiali. Aspetti critici della MFIA deve essere confermata prima di ripetere un campione fallito. Dal momento che il test è condotto a temperatura ambiente è necessario verificare che la temperatura del laboratorio è di circa 27 ° C ± 2 ° C, temperature più elevate possono portare a una riduzione di punteggi previsti per i controlli ed i campioni. Lavaggio è forse la fase più critica nel saggio. Assicurare che la piastra di prova viene adeguatamente lavati, cancellati e risospese può eliminarela maggior parte degli errori di campionamento dovuti a basso numero di tallone (per perline aggregati) o addizione del reagente insufficiente (perso per wicking su fondo piastra prova filtro). Abbiamo regolarmente contare 25 perline per dosaggio (agente) e hanno trovato alcuna differenza statistica tra i risultati contando più alto numero di perline, che porterà anche ad un tempo più lungo di lettura per la piastra.
Abbiamo effettuato studi di convalida complete di MFIA su diverse specie di animali da laboratorio di uso comune (topo, ratto, criceto, cavia e coniglio), per dimostrare l'accuratezza diagnostica, la riproducibilità e robustezza testando un gran numero di noti campioni di sieri positivi e negativi, e confrontando il loro ELISA, IFA e risultati MFIA. I limiti di rilevazione (cioè, standard endpoint immunitarie titolazione del siero) di MFIA erano paragonabili a, e in alcuni casi superato, quelli corrispondenti ELISA. Specificità diagnostica, misurata con roditore sieri SPF, ha superato il 99%, il betwee corrispondenza generalen ELISA e MFIA eseguita noto sieri positivi e negativo noto era superiore al 95%. In sintesi, questi risultati hanno dimostrato che MFIA multiplex è una buona alternativa al singleplex ELISA, ed è adatto per la sua destinazione d'uso, ovvero in sierosorveglianza routine delle colonie di animali da laboratorio.
Divulgazioni
Tutti i lavori di autori per Charles River RADS, uno dei principali fornitori di servizi di sierologia sperimentazione animale e reagenti.
Riconoscimenti
La ricerca qui presentata è stata sostenuta da Charles River.
Riferimenti
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon