Method Article
멀티 플렉스 Fluorometric 면역 분석법 테스트 방법론 및 문제 해결
요약
Luminex Corporation의 xMAP의 microsphere 기술을 사용, 우리는 다양한 실험실 동물 종의 serosurveillance에 대한 다중 Fluorometric 면역 분석법 (MFIA)를 개발했습니다. MFIA는 항원, 조직 제어 또는 면역 글로불린이 covalently 색으로 구분되는 폴리스티렌 마이크로에 연결되어 정지 microarray입니다. MFIA 테스트 방법뿐만 아니라 다양한 문제 해결 항목은 해결됩니다.
초록
생물 의학 연구에 사용되는 동물 모델의 품질을 보장하기 위해 우리는 동물 우발적 인 전염성 대리인 (mycoplasma 바이러스, 및 기타 까다로운 미생물)에 노출 된 경우 결정하기 위해 진단 테스트 전략 및 방법의 수를 개발했습니다. 면역 적격 동물의 감염은 일반적으로 과도 있으며, 아직 감염 혈청 항체 반응은 종종 주 일 이내에 감지 할 수 있으며 호스트의 수명이 다할 때까지 유지됩니다. 혈청학은 실험실 동물 모니터링하는이 기본 진단 방법입니다. 역사적으로 간접 효소 연결된 면역 분석 (엘리사)는 serosurveillance의 주요 심사 방법이었습니다. 엘리사는 하나 미생물 항원 항체 반응은 당 잘 측정되는, singleplex으로 수행됩니다. 비교 MFIA은 멀티 플렉스 분석으로 수행됩니다. 마이크로 100 고유 한 색상 세트에 온 이후, 많은 백 등 다양한 assays는 simultan을 수행 할 수 있습니다eously 하나의 microplate에 잘. 이 혁신은 물론 하나의 실험에서 얻은 정보의 양을 증가시키는 동시에 일상적인 테스트에 필요한 혈청, 시약 및 disposables의 양을 감소시킵니다. 또한, 샘플 및 시스템 적합성을 확인하기 위해 여러 내부 통제 비즈를 통합함으로써 결과의 정확성을 보장 할 수 있습니다. 이러한 조직 제어 및 샘플 적합성을 평가하기 위해 IgG 방지 테스트 혈청 종 면역 글로불린 (αIg) 코팅 구슬 세트가 포함되어 있습니다. 엘리사와 IFA에서와 같이, 조직 제어는 혈청 면역 글로불린의 비 특정 바인딩을 감지합니다. αIg 제어 (세럼 컨트롤)은 혈청이 추가되었습니다 확인하고 혈청 종 면역 글로불린으로 코팅 IgG 제어 구슬 (시스템 적합성 컨트롤), 레이블 시약 및 Luminex 독자가 제대로 작동을 증명하는 동안 충분한 면역 글로불린 농도가 포함되어 있습니다.
프로토콜
1. MFIA 절차에 대한 설명 (그림 1)
- MFIA는 찰스 강 (Charles River)의 항원 코팅 폴리스티렌 마이크로 (구슬), 테스트 커, 표시 시약 (가방, SPE) 및 버퍼 (기본 희석제, 검정 버퍼)가 필요합니다.
- 시약은 96 - 웰 필터 하단 microtiter 플레이트의 우물에 stepwise 추가됩니다.
- 이기종 테스트 의미 incubations이 시약을 언 바운드 혈청 성분을 제거하는 필터 세척 단계에 이어 또는 표시된대로 MFIA이 수행됩니다. 워시 솔루션은 구슬을 유지 잘 필터 바닥을 통해 흡인하여 제거 판 우물에 추가됩니다.
- MFIA의 assays은 실온 (27 ° C + / -2 ° C)에서 수행됩니다.
- 시험 혈청 배양 단계에서 형성된 항원 - 항체 복합체는 R-phycoerythrin - 라벨 streptavidin (SPE)에 의해 다음 biotinylated 염소 안티 - 종 conjugates (가방)와 incubations에 의해 감지됩니다.
- 검정 리더에서 구슬을 통해 한 번에 하나의를 통과그들은 두 레이저에 노출되어 검출기. 하나의 레이저 검정에 해당하는 구슬의 색상 세트를 식별 내부 염료를 자극하고, 다른 하나는 분석하는 동안 캡처 phycoerythrin 기자 염료을 일 깨우 죠. 구슬의 미리 결정된 번호는 분석에 따라 읽기와 phycoerythrin 형광의 강도는 중간 형광 지수 (MFI)로보고됩니다.
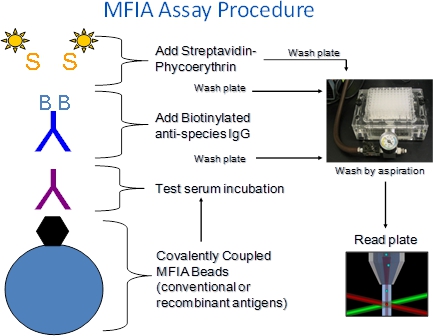
그림 1. MFIA 절차. xMAP 기반 MFIA는 항원 (또는 컨트롤) covalently 연결되어하는 색으로 구분되는 폴리스티렌 5.6 마이크론 구슬을 이용하여 정지 microarray입니다. 구슬 100 고유 한 색상 세트에 온 이후 구슬이 진공 매니 폴드에 흡인하여 세척 할 수 있도록, 많은 백 등 다양한 assays는 필터 하단 microtiter 플레이트에서 수행되는 하나의 잘 분석 단계에서 수행 할 수 있습니다. 반응은 Luminex xMAP 100 fluorometer를 읽을 수 있습니다. phycoeryt의 강도hrin 형광은 중간 형광 지수 (MFI)로보고
2. 시작하기 전에 다음 사항에 유의하십시오 :
- MFIA 비즈 민감한 빛
- 직접 빛 노출의 양을 제한하는 것은 매우 중요합니다. 일상적인 테스트를하는 동안 발생하는 빛 노출의 정상적인 금액은 허용하지만 장시간 노출은 검정 리더로 그들을 읽을 수 렌더링 구슬을 photobleaching 될 수 있습니다.
- 이 MFIA 비즈는 항상 (10-30초)를 사용하기 전에 정지로 vortexed하고 sonicated되는 분석의 성공에 매우 중요합니다.
- 검정 리더는 하나의 구슬에서 정보를 수집합니다. 수집 된 구슬 클러스터는 더 이상 시간을 읽는 될 수 있습니다.
- 분석 솔루션의 증발을 방지하기 위해 모든 인큐베이션 단계에서 플레이트 뚜껑으로 덮여 테스트 판을 유지해야합니다.
- 필요한 개인 보호 장비 : 실험실 코트, GL실험실 환경에서 작업하는 동안 oves와 눈 보호가 항상 착용해야합니다.
3. 시약
- 표 1은 내부 MFIA 연구소를 설립하는 데 필요한 자료의 대부분을 포함하고 있습니다. 추가 또는 중복 항목은 사용자의 특정 요구에 따라 필요할 수 있습니다. 이 인벤토리는 찰스 강 (Charles River) (MFIA 비즈, 컨트롤 및 보조 시약)에서 구입 한 시약을 제외 되오니, 이용에 참고하여주십시오. biotinylated conjugates과 streptavidin 태그 phycoerythrin 여러 상용 소스를 사용할 수 있습니다. 그러나 찰스 강 (Charles River)에서 사용할 수있는 시약이 다른 업체 나 시약을 많이 사용하여 우리의 시약과 소음 점수에 최적의 신호를 얻을 수 있도록 titrated 한하지 않는 것이 좋습니다.
표 1. CR-래드는 BioRad과 BioTek에서 자동 microplate 와셔에서 BioPlex 흔들 배열 리더를 사용합니다. 이에 상응하는 장비는 다른 공급 업체에서 구할 수 있습니다.
항목 공급 업체 카탈로그 번호 장비 정지 배열 리더 * BioRad 171-000205 96 잘 microplate 와셔 BioTek ELX50/8FMW 초음파 청소기 / 욕조 콜 파머 EW0884900 아날로그 와류 믹서 VWR 58816-121 -20 ° C의 냉동고 여러 4 ° C 냉장고 여러 12 채널 pipettor, 20 200μl VWR 83009-718 궤도 판 흔드는 VWR / 랩 라인 57019-600 팁 단일 채널 pipettors, 20 200μl, VWR 83009-732 팁 단일 채널 pipettors, 2 20μl, VWR 83009-726 팁 단일 채널 pipettors, 100 1000μl, VWR 83009-736 Vacushield 배기 장치 VWR 55095-006 진공 압력 펌프 VWR 54908-037 진공 시스템 폐기물 저장소 VWR 80200-640 Disposables 96 - 웰 polystryrene 판 피셔 과학 14-245-145 멀티 HTS-BV 판, 1.2μm 필터, 스티렌 Millipore MSBV N12 50 15ml 원뿔 튜브 (폴리 프로필렌) Sarstedt 62554.002 50ml 원뿔 튜브 (폴리 프로필렌) Sarstedt 62547.004 세럼 튜브 Sarstedt 72694.007 알루미늄 호일 VWR 89079-068 1L 병, 무균 VWR 28199-246 0.22μm 병 상단 필터 VWR 28199-307 시약 저수지 (100ml) VWR 82026-356 액체 시약을 분배를위한 5ml, 10ml, 25ml pipets VWR 시약 PBS, 산도 7.4 일 BSA, 분말 (파우치) 시그마 P3813 ProClin 300 시그마 / Supelco 48912-U 마이크로을 코팅 Luminex 유형에 따라 다양
4. 시약 준비
- 두 버퍼는 MFIA 절차가 필요합니다. 기본 희석제는 찰스 강 (Charles River)에서 가능하며, 이외의 특정 단백질 상호 작용을 감소 독점 차단 에이전트가 포함되어 있습니다. 검정 워시 버퍼는 상업적으로 이용 가능한 시약과 시설로 구성되어 있습니다.
- 검정 워시 버퍼 : PBS / 1% BSA의 산도를 7.4은 시그마 - 알드리치에서 파우더로 사용할 수 있습니다.
- 이 미립자는 검정 리더의 나막신을 초래할 수 있으므로 여과에 의한 미립자의 제거가 중요합니다. 살균, 라벨이 붙은 용기에 0.2micron 병 상단 필터 장치를 통해 버퍼를 필터링 할 수 있습니다.
- 가방과 SPE는 검정 워시 버퍼에서의 2X 작업 농도로 희석합니다. 참고 : SPE 민감한 빛과 쉬입니다ould는 제한된 빛 노출되어 있습니다.
5. 샘플 준비
- 테스트 자료, 시약 및 disposables을 조립.
- 멀티 및 싱글 채널 micropipettes 및 팁
- 96 - 웰 낮은 단백질 바인딩을 microtiter 플레이트 (혈청 dilutions)와 필터 하단 플레이트 (MFIA 분석)
- 표준 절차에 따라 혈액 표본을 수집합니다. 완전히 원심 분리 및 혈청 제거하기 전에 최소 30 분 동안 실온에서를 개최하여 응고에 혈액 표본을 허용합니다. Undilute 혈청은 샘플링하기 전에 혈청 구성 요소를 섞어 간단히 vortexed해야합니다.
- MFIA에 대한 최종 테스트 희석 1 / 50입니다. 이 분석에 대한 테스트 혈청의 2 배 (1 / 25) 샘플을 만들 필요가 있습니다. 24 부품 MFIA 기본 희석제로 혈청 한 부분을 추가하여 undiluted 테스트 커를 희석. 96 잘 microtiter 플레이트에서 테스트 혈청 조직은 크게 tes에 샘플의 전송 시간을 단축t 판과하는 것이 좋습니다.
6. 시험 플레이트 준비
- 96 - 웰 시험 플레이트를 사전 으러는 적절한에도 잘 피난을 확보해야합니다. 전체 플레이트가이 단계는 초기에 필요합니다 사용되지 않습니다 경우에도 이후의 시약을 추가하거나 빈 우물에 버퍼를 씻어 필요가 없습니다.
- 일부 실험실의 테스트 판 및 나중에이 우물을 다시 사용 계획에 사용하지 않는 우물를 봉쇄하여 전체 96 - 웰 플레이트 이하를 실행합니다. 우리는 테스트 판의 적절한 여과에 영향을 미칠 수 있기 때문에이 방법을 사용하는 것은 권장하지 않습니다.
- 적절한 테스트 판 열망은 MFIA 분석의 성공에 매우 중요합니다. 샘플 우물의 피난은 약 5-10초을해야합니다. 너무 빠르게 잘 내용을 Aspirating하면 검정의 끝 부분에 구슬 집계과 느린 읽기 시간 될 수 있습니다.
- 모든 w 후 종이 타올로 테스트 판의 아래쪽을 가릴액체 배수를 보장하기 위해 재 단계가 중지되었습니다. 테스트 판을 도말하지 않으면 염소 항 - 종 및 / 또는 종 IgG 구슬 점수 실패의 부화 및 결과 동안 우물 밖으로 wicking 액체 시약 될 수 있습니다. 이 구슬은 기본 혈청 및 표시 시약의 적절한 금액을 각 잘에 추가됩니다 미리 정해진 MFI 범위 내에서 점수 설계되었습니다.
7. MFIA 비드 흔들 준비
- 이 구슬은 항상 vortexed하고 사용하기 전에 sonicated되는 분석의 성공에 매우 중요합니다. 검정 리더는 하나의 구슬에서 정보를 수집, 구슬 집계 또는 clumps는 더 이상 시간을 읽는 될 수 있습니다.
- 소용돌이 재고가 결합 된 구슬 정지 (일반적으로 10 ± 5 초)
- 10-20초에 대한 sonicator 목욕탕에서 sonication 다음 구슬을 Resuspend.
- 기본 희석제의 2 배 작업 구슬 정지 20X 재고 현탁액을 희석. 2X 구슬 정지 50μl을 투여사전 젖은 테스트 플레이트 잘 각 분석합니다.
8. 테스트 판으로 테스트 및 제어 세라의 추가
- 각 2X 테스트 및 미리 정의 된 판지도에 따라 테스트 판에 혈청 제어 피펫 50μl. 탄성 밴드 또는 알루미늄 호일로 접시와 상온에서 어둠 속에서 궤도 셰이커에 60분의 테스트 판을 길러 보안 뚜껑.
- 흔드는 속도는 400보다 큰하지만, 700rpm 미만이어야합니다. 이 구슬은 혈청 항체가 결합 된 항원의 모든 표면에 액세스 할 수 있도록 정지에 보관하는 것이 중요합니다. 구슬이 일시 중지 유지하지 않으면 낮은 IgG 비드 제어 점수를 얻을 수 있으며 검정은 반복해야합니다.
9. 테스트 플레이트를 세척
- 진공 매니 폴드를 사용하여 잘 내용을 대기음. 샘플 우물의 피난은 약 5-10초을해야합니다.
- 파페로 테스트 판의 아래쪽을 가릴액체 배수를 보장하기 위해 모든 후 R 수건이 중지되었습니다.
- 검정 워시 버퍼의 50μl에 구슬을 Resuspend. 이 구슬은 분석 과정에서 밖으로 건조 할 수 없습니다하는 것이 중요합니다.
10. 테스트 판에 가방과 SPE 추가
- MFIA 비즈를 포함하는 모든 우물에 배 작업을 희석 가방의 50μl을 투여. 탄성 밴드 또는 알루미늄 호일로 접시에 뚜껑을 고정합니다. 실온에서 어둠 속에서, 위와 같이 흔들림과 함께 삼십분에 대한 테스트 판을 품다.
- 이 부화는 테스트 판을 씻고 이전에 혈청 또한 다음 설명에 따라 검정 워시 버퍼로 구슬을 resuspend 후.
- MFIA 비즈를 포함하는 모든 우물에 배 작업을 희석 SPE의 50μl을 투여. 탄성 밴드 또는 알루미늄 호일로 접시에 뚜껑을 고정합니다. 실온에서 어둠 속에서, 위와 같이 흔들림과 함께 삼십분에 대한 테스트 판을 품다.
- 이 incu 후bation는 테스트 판을 씻고 검정 워시 버퍼의 125μl로 구슬을 resuspend 사전 검정 판독기에 배치하는 구슬을 resuspend하기 ~ 2 분 동안 판을 흔들.
11. 테스트 판 읽기
- 구슬을 resuspending 10 분 이내에 분석 리더기로 테스트 판을 놓습니다. 정전이나 기타 사고의 경우, 테스트 판은 시간 12까지 읽을 준비가 될 때까지 어둠 속에서 실온에서 저장 될 수 있습니다.
- 선택한 비드 패널은 테스트 우물의 구슬 프로필을 일치하는지 확인도 첫 번째 샘플을 관찰. 프로토콜 디스플레이의 지정 '비드 지역'밖에 떨어지는 구슬이있을 경우, 잘못된 프로필 선택이 이루어졌습니다.
- 구슬이 제대로 resuspended 된 경우 그 대리해야 검정 리더 소프트웨어에 표시된 자신의 지정된 '지역'.
- 구슬이 집계하는 경우 그들은 속도가 느린에서 자신의 지역을 작성합니다속도. 당신은 리더에서 테스트 판을 제거하고 수동으로 우물을 resuspend 할 수 있습니다. 비드 집계을 분할을 지원하는 멀티 채널 pipettor 3-4 회 각 우물을 씹다. 판독기에 테스트 판을 교체하고 계속합니다.
12. 대표 결과
- 구슬의 최소 숫자는 분석에 따라 읽기와 phycoerythrin 형광의 강도는 0에서 32667까지의 평균 형광 지수 (MFI)로보고됩니다. 25 카운트를 비교 한 후, 잘 당 50 또는 100 구슬 우리는 통계 차이를 보지 못하고 정기적으로 잘 샘플 당 에이전트 당 25 구슬을 계산합니다. 이러한 부적절한 구슬 카운트 또는 IgG / 반 IgG 구슬 점수를 실패 등의 오류에 대한 결과 보고서를 검토합니다. 이 구슬은 기본 혈청 및 표시 시약의 적절한 금액을 각 잘에 추가됩니다 미리 정해진 MFI 범위 내에서 '점수'로 설계되었습니다. 오류가있는 샘플 우물, (낮은 비드 카운트) 또는 실패 IgG 제어 구슬 점수해야유효한 결과를 얻기 위해 반복.
- Excel 워크 시트에 결과를 보냅니다. 우리의 데이터 해석 각 분석이 할당됩니다 :
- 조직 제어 (TC) 시험 : 대부분의 쥐 MFIA의 assays의 경우는 조직 제어는 야생 형 baculovirus에 감염된 곤충 세포의 추출물입니다.
- 검정 컷오프 :이 값은 예상 최소 형광이며, 진단 정확성을 극대화하기 위해 각 분석에 대해 조정됩니다. 대부분의 assays를 들어, 형광 컷오프는 3000입니다.
- 순 평균 형광 지수 (MFI)은 다음 공식에 의해 각 분석 (조직 및 IgG 제어 테스트 제외)에 대해 계산됩니다. 즉, 특정 분석 신호는 단순히 0-32 대신 0-32,667 사이의 네트워크 MFI의 범위를 설정 전체 분석 MFI 마이너스 TC (배경) MFI이 값은 다음 1,000으로 나눈 값이다.
순 MFI = (MFI 항체 분석 - MFI의 조직 제어) / 1000
NEt MFI와 TC MFI는 각 항원에 대한 특정 검정 컷오프와 비교하여 점수로 변환됩니다.
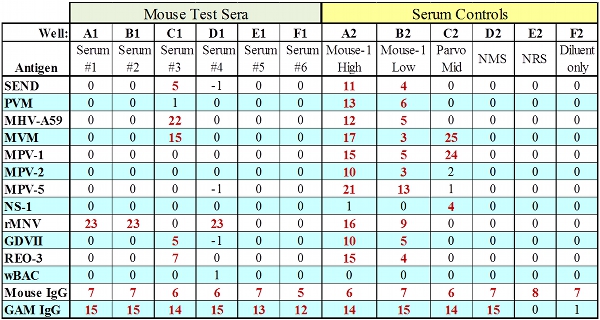
그림 2. 모든 IgG와 시험 커를위한 대표 MFIA 데이터가 전달 제어합니다.
- 12.4 MFIA 통역
- 시스템 - 적합성 제어 및 세럼 컨트롤 (IgG / 안티 IgG 비즈)는 결과가 표 2에 나와있는 허용 기준을 충족하는 경우 테스트 판 결과는 해석해야합니다. 이 두 IgG 제어 구슬의 실패는 부적절한 희석 또는 불충분 볼륨 켤레 또는 immunocomprimised 동물의 혈청 SPE, 부적절한 테스트 혈청 희석 또는 사용과 같은 여러 절차 오류를 표시 할 수 있습니다.
표 2
검정 컨트롤에 대한 허용 기준 제어 허용 결과 점수 분류 높은 범위 면역 혈청 ≥ 4.5 긍정적 인 낮은 범위 면역 혈청 ≥ 1.5 ≥ 경계 비 면역 혈청 <2.5 ≤ 경계 희석제 <2.5 ≤ 경계 IG 비드는 *를 설정 ≥ Cutoff/1000 패스 * 비드는 종 특정 백신 검사 혈청 면역 글로불린 (IG)로 코팅 설정 :이 샘플 적합성 제어를위한 실패 점수가 너무 높은 불충분 한 샘플을 추가로 발생할 수 immunodeficient 호에서 샘플 희석, 잘못된 종 또는 테스트 혈청ST.
- 테스트 판 검정 컨트롤 중 하나가 높은 범위 면역 혈청을 제외하고 실패하면, 결과는 허용되지 않습니다 반복해야합니다. 이 테스트 판의 검출 감도 수준을 보여줍니다부터 합격 낮은 범위의 혈청 제어 점수는 중요합니다.
- 염소 안티 - 종 IgG 구슬 점수는 검정에 추가 기본 테스트 혈청의 양에 따라 달라집니다. 이 컨트롤 비드가 실패하지만 종 IgG가 (물론 B1, Fig.3) 통과한다면 그것은 충분한 테스트 시약 (가방, SPE)가 잘 테스트에 추가 된 표시하며 혈청 관련 문제입니다. 테스트 시약의 양이 잘 특히 부족한 경우 IgG 및 항 IgG 제어 구슬 모두가 실패 (자 E1, Fig.3)합니다.
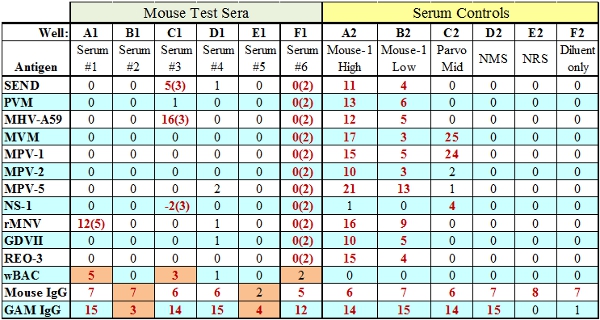
그림 3. 실패와 대표 MFIA 테스트 결과 (주황색으로 표시). 웰스 A1, C1과 F1은 TC (조직 반응) 실패를 나타냅니다어디 TC 점수는 괄호 안에 표시됩니다. 웰스 B1과 E1은 IgG 내부 통제 실패, 불충분 한 테스트 항체 (B1) 또는 가방 / SPE 각각 테스트 시약 (E1)의 두 가지 유형을 보여줍니다.
- 테스트 판 검정 제어 결과가 만족하는 경우 표 3에 도시 된 바와 같이, 개별 검정 점수는 분류됩니다. 그것은 다른 시험 방법에 의해 모든 경계선이나 긍정적 인 결과에 확인하는 것이 중요합니다.
표 3
MFIA 점수 구분 점수 분류 TC 그물 TC + 순 * ≥ 2 <0.5 <2.5 음극 (-) ≥ 0.5 ≥ 2.5 TC 반응 (T) <2 <1.5 - 1.5 ≤ X <2.5 경계선 (B) ≥ 2.5 긍정적 (+) * 부정적인의 분류는 여전히 제공 0이 아닌 TC 점수 결정 할 수있는 TC + 인터넷 점수는 (= 자세 점수) 부정적이다
- 시스템 - 적합성 제어 및 세럼 컨트롤 (IgG / 안티 IgG 비즈)는 결과가 표 2에 나와있는 허용 기준을 충족하는 경우 테스트 판 결과는 해석해야합니다. 이 두 IgG 제어 구슬의 실패는 부적절한 희석 또는 불충분 볼륨 켤레 또는 immunocomprimised 동물의 혈청 SPE, 부적절한 테스트 혈청 희석 또는 사용과 같은 여러 절차 오류를 표시 할 수 있습니다.
토론
MFIA 테스트 과정은 전통적인 singleplex 테스트보다 장비와 작은 샘플 및 시약 볼륨을 필요로하는, 매우 효율적입니다. 멀티 플렉스 시스템의 기능은 사용자에게 실험실 동물에 공통 에이전트의 여러 변종 또는 serotypes (즉, Coronavirus, parvoviruses 등)를 동시에 상영 할 수있는 유연성을 제공합니다. 이것은 또한 관심을 (예 : 특정 바이러스의 가족)의 영역에 따라 맞춤 비드 패널을 설계하기 위해 우리가 할 수 있으며 크린 시토 킨 및 기타 생체 분자 등의의 심사 다른 유형에 적용 할 수 있습니다. 또한, 우리가 샘플 및 시스템 적합성을 확인하기 위해 몇 가지 내부 통제의 assays를 통합함으로써 결과의 정확성을 보장 할 수 있습니다. 이러한 조직 제어 및 샘플 적합성을 평가하기 위해 IgG 방지 테스트 혈청 종 면역 글로불린 (αIg) 코팅 구슬 세트가 포함되어 있습니다. 조직 제어 구슬은 혈청 면역 글로불린의 비 특정 바인딩과 αIg 비드 제어 확인을 감지그 혈청을 추가하고 충분한 면역 글로불린 농도를 포함하고 있습니다. 혈청 종 면역 글로불린으로 코팅 다른 컨트롤 구슬은, 라벨 시약 및 분석 리더가 제대로 작동하고 있는지 보여줍니다. 기타 상업적으로 이용 가능한 멀티 플렉스 형식 serologic의 assays (예 : MicroArrays, ImmunoComb)는 결과 확인이 동일한 수준을 제공하지 않을 수도 있습니다.
이전 retesting에 대한 분석 실패의 가능한 소스를 좁힐 수있는 능력은 조사관 시간과 물질을 절약 할 수 있습니다. MFIA의 중요한 측면은 실패 샘플을 반복하기 전에 확인해야합니다. 검정은 주위 온도에서 실시되어 있기 때문에이 실험실 온도가 약 27 것을 확인해야합니다 ° C ± 2 ° C, 높은 온도가 컨트롤과 샘플 예상 점수보다 낮은 될 수 있습니다. 세탁은 아마도 분석에서 가장 중요한 단계입니다. 테스트 판이 제대로 씻어되어 일지, blotted 및 제거 할 수 있습니다 resuspended낮은 비드 카운트 (누적 구슬로 인해) 또는 부족 시약 추가 (테스트 판 필터 아래에서 wicking에 의해 손실)으로 인한 샘플링 오류의 대부분. 우리는 정기적으로 분석 당 25 구슬 (에이전트)를 계산하고 또한 접시 이상 읽기 시간에 이끌 비즈 높은 수를 계산하여 결과에 통계적 차이를 발견 없습니다.
우리는 알려진 긍정적이고 부정적인 혈청 샘플을 다수의 테스트하여 진단 정확성, 재현성 및 견고성을 입증하기 위해 일반적으로 사용되는 실험실 동물의 여러 종 (마우스, 쥐, 햄스터, 기니 돼지와 토끼)에 MFIA 종합 검증 연구를 수행하고,이 자신의 엘리사, IFA와 MFIA 결과를 비교. MFIA의 검출 한계 (즉, 표준 면역 혈청 적정 종점)에 비교했고, 경우에 해당 엘리사의 사람들, 능가. SPF 쥐 커로 측정 진단 특이성은 99 % 초과, 전체 통신 betweeN 엘리사와 MFIA 95 % 이상이었다 알려져 긍정적 알려진 부정적인 커 수행. 요약이 결과는 멀티 플렉스 MFIA는 singleplex 엘리사에게 좋은 대체하며, 실험실 동물 식민지의 일상 serosurveillance에서의 용도, 즉에 적합한 것을 증명.
공개
찰스 강 (Charles River) 래드, 동물 혈청학 시험 서비스와 시약의 주요 공급자에 대한 모든 작가 작동합니다.
감사의 말
여기에 제시된 연구는 찰스 강 (Charles River)에 의해 지원되었다.
참고문헌
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유