Method Article
Méthodologie d'essai fluorométrique multiplexés dosage immunologique et dépannage
Dans cet article
Résumé
Grâce à la technologie Luminex Corporation microbille xMAP, nous avons développé le test immunologique multiplexée fluorométrique (MFIA) pour la surveillance de diverses espèces d'animaux de laboratoire. Le MFIA est une micropuce suspension, si l'antigène, le tissu de contrôle ou d'immunoglobulines sont liés de façon covalente à du polystyrène code couleur microsphères. La méthode de test MFIA ainsi que diverses rubriques de dépannage est adressée.
Résumé
Pour garantir la qualité des modèles animaux utilisés en recherche biomédicale, nous avons développé un certain nombre de stratégies de tests de diagnostic et les méthodes permettant de déterminer si les animaux ont été exposés à des agents adventices infectieux (virus, les mycoplasmes et autres micro-organismes exigeants). Infections des animaux immunocompétents sont généralement transitoires, mais les réponses en anticorps sériques à l'infection peuvent souvent être détectés dans les jours ou semaines et persistent pendant toute la vie de l'hôte. La sérologie est la méthode de diagnostic principal par lequel les animaux de laboratoire sont surveillés. Historiquement, le-enzymatique indirecte (ELISA) a été la principale méthode de dépistage pour la surveillance sérologique. Le test ELISA est réalisé comme un singleplex, dans lequel une microbienne réaction antigène-anticorps est mesurée dans chaque puits. Dans le comparateur de MFIA est réalisée comme un essai multiplex. Depuis les microsphères venir dans 100 jeux de couleurs distinctes, pas moins de 100 différents tests peuvent être effectués simultanément dans un seul puits de microplaques. Cette innovation réduit la quantité de sérum, réactifs et consommables nécessaires pour les tests de routine, tout en augmentant la quantité d'information obtenue à partir d'un seul test bien. En outre, nous sommes en mesure d'intégrer de multiples perles de contrôle interne pour vérifier l'échantillon et de l'adéquation du système et ainsi assurer l'exactitude des résultats. Ceux-ci incluent le contrôle des tissus et IgG anti-immunoglobuline de test espèces sérum (αIg) recouvertes de billes d'évaluer l'aptitude de l'échantillon. Comme dans le test ELISA et IFA, le tissu de contrôle détecte la liaison non spécifique des immunoglobulines de sérum. Le contrôle αIg (contrôle sérum) confirme que le sérum a été ajouté et contient une concentration en immunoglobuline IgG suffisante alors que le contrôle de cordon (contrôle de conformité du système), recouvert d'immunoglobuline sérique espèces, démontre que les réactifs marqués et Luminex lecteur fonctionnent correctement.
Protocole
1. Explication de la procédure MFIA (Figure 1)
- Le MFIA nécessite Charles River antigène polystyrène microsphères enrobées (perles), les sérums, réactifs marqués (BAG, SPE) et les tampons (diluant primaire, tampon de dosage).
- Les réactifs sont ajoutés progressivement dans les puits de plaques 96 puits de microtitration filtre à fond.
- Le MFIA est effectuée comme une incubations hétérogènes signification de test sont suivies d'étapes de lavage de filtre pour éliminer les constituants non liés de sérum ou de réactifs marqués. Solution de lavage ajouté à puits de la plaque est enlevée par aspiration à travers et filtre-fonds, qui retiennent les billes.
- Les tests sont effectués MFIA à la température ambiante (27 ° C + / -2 ° C).
- Complexes antigène-anticorps formés lors de l'étape d'incubation du sérum d'essai est détecté par incubation avec biotinylées de chèvre anti-espèces conjugués (SAC), suivie par la R-phycoérythrine-streptavidine marquée (SPE).
- Dans le lecteur de dosage, les billes passent une à la fois parun détecteur où ils sont exposés à deux lasers. Un laser excite les colorants internes qui identifient ensemble la couleur de la bille, ce qui correspond à un dosage, l'autre excite le colorant reporter phycoérythrine capturé pendant l'essai. Un nombre prédéterminé de perles sont lus par essai et l'intensité de fluorescence de la phycoérythrine est signalé comme un indice médian de fluorescence (MFI).
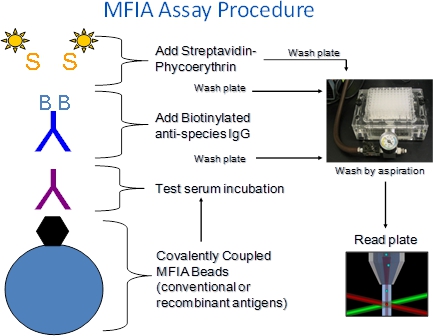
Figure 1. Procédure MFIA. Le MFIA xMAP basé sur une puce à ADN est une suspension qui utilise de couleur des perles de polystyrène microns 5,6 à quels antigènes (ou commandes) sont liés de manière covalente. Étant donné que les billes viennent en 100 ensembles de couleurs distinctes, pas moins de 100 tests différents peuvent être réalisées dans un seul puits de dosage étapes sont réalisées dans des plaques de microtitrage à fond filtrant de sorte que les billes peuvent être lavés par aspiration sur une rampe à vide. Les réactions sont lues avec le Luminex xMAP 100 fluorimètre. L'intensité de phycoerythrin fluorescence est signalé comme un indice médiane de fluorescence (MFI)
2. Avant de commencer S'il vous plaît noter les points suivants:
- Les perles sont MFIA sensible à la lumière
- Limiter le montant de l'exposition de la lumière directe est cruciale. La quantité normale de l'exposition lumineuse qui se produit pendant les tests de routine est acceptable, mais une exposition prolongée peut conduire à photoblanchiment des perles qui les rendent illisibles par le lecteur dosage.
- Il est crucial pour le succès de l'essai que les perles MFIA sont toujours en suspension au vortex puis soniquée (10-30 secondes) avant de l'utiliser.
- Le lecteur Assay rassemble des informations à partir de perles uniques seulement. Agrégées grappes de perles peut conduire à plus de temps de lecture.
- Soyez sûr de garder la plaque d'essai couverte avec le couvercle de la plaque au cours de toutes les étapes d'incubation pour éviter l'évaporation des solutions à doser.
- Équipement de protection individuelle requis: Laboratoire manteau, gloves et de protection des yeux devrait être porté en tout temps lorsque vous travaillez dans un environnement de laboratoire.
3. Réactifs
- Le tableau 1 présente la plupart des matériaux nécessaires à la création d'un laboratoire interne MFIA. Des articles supplémentaires ou duplicata peut être nécessaire en fonction de vos besoins spécifiques. S'il vous plaît noter que cet inventaire exclut les réactifs achetées chez Charles River (perles MFIA, des contrôles et des réactifs supplémentaires). Plusieurs sources commerciales de conjugués biotinylés et phycoérythrine streptavidine marquée sont disponibles. Toutefois, les réactifs disponibles auprès de Charles River ont été titré pour obtenir le signal optimal pour marquer le bruit avec nos réactifs, en utilisant des fournisseurs alternatifs ou lots de réactifs n'est pas recommandée.
Tableau 1. CR-RADS utilise un lecteur de suspension Bioplex tableau à partir d'BioRad et laveur de microplaques automatisé de BioTek. Un équipement équivalent est disponible auprès de fournisseurs alternatifs.
Article Vendeur Numéro de catalogue Équipement Lecteur réseau Suspension * BioRad 171-000205 96-bien laveur de microplaques BioTek ELX50/8FMW Nettoyeur à ultrasons / bain Cole Palmer EW0884900 Vortex analogique VWR 58816-121 Congélateur à -20 ° C Divers 4 ° C réfrigérateur Divers 12-canaux pipette, 20 200 pi VWR 83009-718 Orbital Agitateur de plaque VWR / Lab-Line 57019-600 Pipettes monocanal, 20-200 pl, avec des conseils VWR 83009-732 Pipettes monocanal, 2-20 pi, avec des conseils VWR 83009-726 Pipettes monocanal, 100-1000μl, avec des conseils VWR 83009-736 Dispositif de ventilation Vacushield VWR 55095-006 Pompe de pression à vide VWR 54908-037 Système de réservoir à déchets sous vide VWR 80200-640 À usage unique Plaque de polystyrène de 96 puits Fisher Scientific 14-245-145 MultiScreen HTS-BV plaque, 1.2μm filtre, le styrène Millipore MSBV N12 50 Tubes coniques de 15 ml (polypropylène) Sarstedt 62554.002 Tubes coniques de 50 ml (polypropylène) Sarstedt 62547.004 Flacons de sérum Sarstedt 72694.007 Le papier d'aluminium VWR 89079-068 1L, stérile VWR 28199-246 0,22 pm bouteille premiers filtres VWR 28199-307 Réservoirs à réactifs (100ml) VWR 82026-356 5ml, 10ml, 25ml pipettes pour distribuer des réactifs liquides VWR Réactifs PBS, pH 7,4 1 BSA, de la poudre (sachets) Sigma P3813 ProClin 300 Sigma / Supelco 48912-U Non couchés ni enduits microsphères Luminex varie en fonction du type
4. Préparation des réactifs
- Deux tampons sont nécessaires pour la procédure MFIA. Diluant primaire est disponible auprès de Charles River et contient des propriétaires des agents bloquants pour diminuer les interactions entre protéines non spécifiques. Tampon de lavage dosage est effectué dans votre établissement avec des réactifs disponibles dans le commerce.
- Dosage Tampon de lavage: PBS / BSA 1% pH 7,4 est disponible sous forme de poudre de Sigma-Aldrich.
- Élimination des particules par filtration est essentiel que ces particules peut conduire à des sabots dans le lecteur dosage. Filtrer le tampon grâce à une bouteille 0.2micron-dessus de l'unité filtre dans des récipients étiquetés stériles.
- SAC et SPE sont dilués à la concentration de travail en 2X tampon de lavage dosage. Remarque: SPE est sensible à la lumière et should ont limité l'exposition lumineuse.
5. Préparation des échantillons
- Assemblez vos essais de matériaux, réactifs et consommables.
- Micropipettes multi-et mono-canal et des conseils
- De 96 puits à faible plaques de microtitration protéines de liaison (dilutions de sérum) et le filtre à fond les plaques (test MFIA)
- Prélever des échantillons de sang en fonction de votre procédure standard. Laisser les échantillons de sang à coaguler complètement en les maintenant à température ambiante pendant au moins 30 minutes avant centrifugation et élimination du sérum. Undilute sérum doit être vortexé brièvement pour mélanger les composants du sérum avant l'échantillonnage.
- La dilution finale de test pour le MFIA est 1/50. Il est nécessaire de faire un 2X (1/25) échantillon de sérum à tester votre pour le dosage. Diluer les sérums à tester, non dilué en ajoutant 1 partie de sérum à 24 parties MFIA diluant primaire. Organisation de votre sérum à tester dans une plaque de microtitration à 96 puits réduit considérablement le temps de transfert de vos échantillons à des tesplaque de t et est fortement recommandée.
6. Préparation plaque d'essai
- Pré-mouillage de la plaque d'essai de 96 puits est nécessaire pour assurer bon, même bien évacuation. Même si la totalité de la plaque ne seront pas utilisées de cette étape est d'abord nécessaire, vous n'aurez pas à ajouter des réactifs ultérieure ou le tampon de lavage dans les puits vides.
- Certains laboratoires de fonctionner moins d'une pleine plaque de 96 puits en fermant les puits inutilisés sur la plaque d'essai et le plan de réutiliser ces puits à une date ultérieure. Nous vous déconseillons d'utiliser cette méthode, car cela peut affecter la bonne filtration de la plaque d'essai.
- Une bonne aspiration plaque d'essai est cruciale pour le succès de l'essai MFIA. Évacuation des puits d'échantillon devrait prendre que quelques secondes environ 5-10. Aspiration du contenu ainsi trop rapidement peut conduire à talon agrégation et la lenteur des temps de lecture à la fin de l'essai.
- Tamponnez la face inférieure de la plaque d'essai avec du papier absorbant après chaque wétape cendres pour assurer le drainage du liquide a cessé. Le défaut d'effacer la plaque d'essai peut conduire à des réactifs liquides mèche sur les puits pendant l'incubation et le résultat en omettant de chèvre anti-espèces et / ou des espèces IgG scores de perles. Ces perles sont conçus pour marquer dans un intervalle prédéterminé IMF lorsque la quantité appropriée de sérum primaire et réactifs marqués sont ajoutés à chaque puits.
7. Préparation MFIA suspension de billes
- Il est crucial pour le succès de l'essai que les perles sont toujours vortex et soniqué avant de l'utiliser. Le lecteur analyse rassemble des informations à partir de perles uniques seulement, des agrégats ou amas de perles peut conduire à plus de temps de lecture.
- Vortex du stock couplé suspension de billes (généralement de 10 ± 5 secondes)
- Remettre en suspension les perles suivi d'une sonication dans un bain d'ultrasons pendant 10-20 secondes.
- Diluer la suspension 20X stock pour une suspension 2X cordon de travail dans le diluant primaire. Distribuer 50 ul de la suspension 2X perleà chaque puits d'essai de la plaque de test pré-mouillé.
8. L'addition de sérum de test et de contrôle de la plaque d'essai
- Pipeter 50 pl de chaque test 2X et Sérum de contrôle de la plaque d'essai en fonction de votre carte plaque prédéfini. Couvercle sécurisé à la plaque avec un élastique ou une feuille d'aluminium et laisser incuber la plaque d'essai pendant 60 minutes sur un agitateur orbital, dans l'obscurité à température ambiante.
- La vitesse agitateur doit être supérieur à 400 mais inférieur à 700rpm. Il est essentiel que les perles sont maintenues en suspension afin de permettre anticorps sériques accès à toutes les surfaces des antigènes couplés. Le défaut de maintenir les billes en suspension entraînera des scores faibles d'IgG de contrôle de perles et le test devra être répété.
9. Lavage de la plaque d'essai
- Aspirer le contenu des puits à l'aide d'une rampe à vide. Évacuation des puits d'échantillon devrait prendre que quelques secondes environ 5-10.
- Tamponnez la face inférieure de la plaque de test avec papeserviettes après chaque r pour assurer le drainage du liquide a cessé.
- Remettre en suspension les billes dans 50 pl de tampon de lavage dosage. Il est important que les perles ne sont pas autorisés à se dessécher pendant le processus de test.
10. Ajout SAC et SPE à la plaque d'essai
- Distribuer 50 ul de dilution BAG 2X travail à tous les puits contenant des billes MFIA. Fixer le couvercle à la plaque avec une bande élastique ou une feuille d'aluminium. Incuber la plaque de test pour 30 minutes sous agitation comme ci-dessus, dans l'obscurité à la température ambiante.
- Après cette incubation, laver la plaque d'essai et remettre en suspension les perles avec du tampon de lavage dosage comme décrit précédemment après l'addition de sérum.
- Distribuer 50 ul de dilution 2X SPE travaillent dans tous les puits contenant des billes MFIA. Fixer le couvercle à la plaque avec une bande élastique ou une feuille d'aluminium. Incuber la plaque de test pour 30 minutes sous agitation comme ci-dessus, dans l'obscurité à la température ambiante.
- Après cette incubation laver la plaque d'essai et remettre en suspension les billes avec 125μl de tampon de lavage Dosage et agiter la plaque pendant environ deux minutes pour remettre en suspension les billes avant de placer dans le lecteur de test.
11. La lecture de la plaque d'essai
- Placez la plaque de test dans le lecteur de test dans les 10 minutes de la remise en suspension des billes. En cas de panne de courant ou autre incident, la plaque de test peut être conservé à température ambiante dans l'obscurité jusqu'à 12 heures avant d'être prêt à lire.
- Observer le premier échantillon et pour vérifier que le panneau de talon sélectionné correspond au profil de talon dans les puits d'essai. Si il ya des perles qui ne relèvent pas «zone de talon» leur a désigné sur le protocole d'affichage, une sélection de profil incorrect a été faite.
- Si les billes ont été resuspendues bien qu'ils doivent remplir dans leurs régions déterminées »indiqués dans le logiciel de lecture de dosage.
- Si les billes sont agrégées ils rempliront leurs régions à un rythme lenttaux. Vous pouvez retirer la plaque de test du lecteur et remettre en suspension les puits manuellement. Triturer chaque puits avec une pipette multi-canaux 3-4 fois pour aider à briser les agrégats de perles. Remplacez la plaque d'essai dans le lecteur et continuer.
12. Les résultats représentatifs
- Un nombre minimum de billes sont lues par le dosage et l'intensité de fluorescence de la phycoérythrine est signalé comme un indice médian de fluorescence (MFI) allant de 0 à 32.667. Après avoir comparés les chiffres de 25, 50 ou 100 billes par puits nous n'avons vu aucune différence statistique et systématiquement compte 25 perles par agent et par échantillon. Examiner le rapport des résultats des erreurs, comme le manque de chefs de perles ou, à défaut IgG / IgG anti-scores perles. Ces perles sont conçus pour «score» dans une fourchette prédéterminée IMF lorsque la quantité appropriée de sérum primaire et réactifs marqués sont ajoutés à chaque puits. Puits d'échantillon avec des erreurs, (faible numération de perles) ou, à défaut d'IgG de contrôle scores perles devraientêtre répétée pour acquérir des résultats valides.
- Exporter les résultats vers une feuille de calcul Excel. Pour notre interprétation des données de chaque essai est attribué:
- Un contrôle de tissus (TC) Test: Pour la plupart des tests MFIA rongeurs, le contrôle tissulaire est un extrait de cellules infectées par un baculovirus de type sauvage insectes.
- Une coupure d'essai: Cette valeur est la fluorescence minimale attendue et est ajusté pour chaque test afin de maximiser la précision du diagnostic. Pour la plupart des tests, le seuil de fluorescence est 3000.
- Indice de fluorescence net médian (MFI) est calculé pour chaque essai (sauf tissu et un contrôle de type IgG) par la formule suivante. En d'autres termes, le signal de test spécifique est le dosage total IMF moins le TC (fond) MFI Cette valeur est ensuite divisée par 1000 qui définit simplement la gamme des IMF nette entre 0-32 au lieu de 0-32,667.
Net MFI = (dosage des anticorps IMF - Contrôle tissus IMF) / 1000
Net MFI MFI et TC sont convertis en scores par rapport à la valeur seuil du dosage spécifique pour chaque antigène.
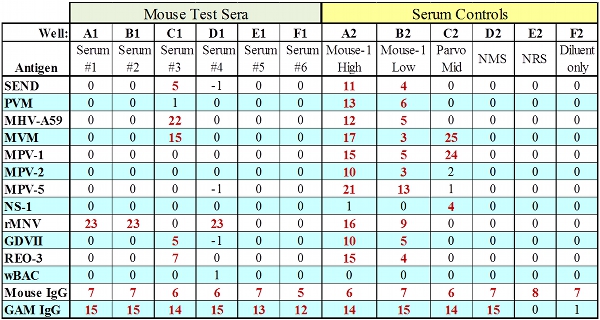
Figure 2. Représentant données MFIA pour les sérums testés avec tous les IgG contrôles de passage.
- 12.4 Interprétation MFIA
- Résultats plaque d'essai ne doit être interprété si le système de contrôle-Adéquation et Sérum de contrôle (IgG / IgG anti-perles) résultats répondent aux critères d'acceptation figurant au tableau 2. L'échec de ces deux perles de contrôle IgG peut indiquer plusieurs erreurs procédurales telles que la dilution incorrecte ou conjugué volume insuffisant ou SPE, la dilution de test de sérum ou de mauvaise utilisation de sérum d'un animal immunocomprimised.
Tableau 2
Critères d'acceptation pour les contrôles d'analyse Contrôler Résultat acceptable Score Classification High Range immunsérum ≥ 4,5 Positif Low Range immunsérum ≥ 1,5 ≥ Borderline Sérum non immun <2,5 ≤ Borderline Diluant <2,5 ≤ Borderline Ig perle Set * ≥ Cutoff/1000 Passer * Perle mettre recouvert d'une espèce spécifique anti-sérum à tester immunoglobuline (Ig): scores défaut pour ce contrôle approprié échantillon pourrait résulter de l'addition de l'échantillon est insuffisante, une trop grande dilution de l'échantillon, les espèces incorrectes ou de sérum test d'un déficit immunitaire hor.
- Si l'un des contrôles de test échoue l'essai sur plaque, sauf le Sérum Haute Gamme immunitaire, les résultats ne sont pas acceptables et doivent être répétés. Passing scores faibles gamme sérum de contrôle sont essentiels, car elle démontre le niveau de sensibilité de détection de la plaque d'essai.
- La chèvre anti-IgG espèces perle score est basé sur la quantité de sérum à tester primaire ajoutées à l'essai. Si cette perle de contrôle échoue, mais les IgG espèce passe (B1 Eh bien, Fig.3), puis il indique que les réactifs de test assez BAG (SPE) ont été ajoutés au puits d'essai et il s'agit d'un problème lié sérum. Si la quantité de réactifs de test est insuffisant dans un puits particulier à la fois les IgG et billes de contrôle anti-IgG échouera (E1 Eh bien, Fig.3).
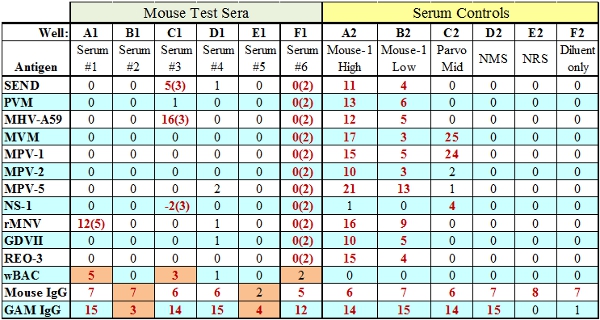
Figure 3. Les résultats représentatifs de test MFIA avec des échecs (indiqué en orange). Les puits A1, C1 et F1 indiquer un TC (réactive tissus) l'échecoù le score TC est représenté entre parenthèses. Les puits B1 et E1 illustrent les deux types de défaillances de contrôle interne IgG, anticorps essai insuffisante (B1) ou des réactifs de test (E1) SAC / SPE respectivement.
- Si les résultats de test de contrôle de plaque d'essai sont satisfaisants, les résultats d'essais individuels sont classés comme indiqué dans le tableau 3. Il est essentiel de confirmer une conclusion limite ou positif par une méthode alternative.
Tableau 3
Classification Score MFIA Score Classification TC Net TC + * Net ≥ 2 <0,5 <2,5 Négative (-) ≥ 0,5 ≥ 2,5 Réaction TC (T) <2 <1,5 - 1,5 ≤ X <2,5 Borderline (B) ≥ 2,5 Positive (+) * Un classement des négatifs peuvent encore être déterminée avec un score de zéro à condition que le TC TC + score net (= Ag score) est négatif
- Résultats plaque d'essai ne doit être interprété si le système de contrôle-Adéquation et Sérum de contrôle (IgG / IgG anti-perles) résultats répondent aux critères d'acceptation figurant au tableau 2. L'échec de ces deux perles de contrôle IgG peut indiquer plusieurs erreurs procédurales telles que la dilution incorrecte ou conjugué volume insuffisant ou SPE, la dilution de test de sérum ou de mauvaise utilisation de sérum d'un animal immunocomprimised.
Discussion
Le processus de test MFIA est très efficace, nécessitant moins de matériel et petit échantillon et des volumes de réactifs que les tests traditionnels singleplex. La fonctionnalité du système multiplex donne à l'utilisateur la possibilité de filtrer simultanément pour plusieurs souches ou sérotypes d'agents communs chez les rongeurs de laboratoire (c.-à-coronavirus, les parvovirus, etc.) Cela nous permet aussi, de concevoir sur mesure des panneaux de perles basée sur la zone d'intérêt (c.-famille de virus spécifique) et est adaptable à d'autres types de dépistage de biomolécules incluant les cytokines et autres bio-marqueurs. En outre, il nous permet d'intégrer plusieurs tests de contrôle interne pour vérifier l'échantillon et de l'adéquation du système et ainsi assurer l'exactitude des résultats. Ceux-ci incluent le contrôle des tissus et IgG anti-immunoglobuline de test espèces sérum (αIg) recouvertes de billes d'évaluer l'aptitude de l'échantillon. Un tissu de contrôle bourrelet détecte la liaison non spécifique des immunoglobulines de sérum et le contrôle αIg bourrelet confirmeque le sérum a été ajouté et contient une concentration suffisante d'immunoglobuline. Une autre perle de contrôle, recouvert d'immunoglobuline sérique espèces, démontre que les réactifs marqués et un lecteur de test fonctionnent correctement. D'autres tests disponibles dans le commerce format multiplex sérologiques (c.-à MicroArrays, ImmunoComb) peuvent ne pas offrir le même niveau de résultat de confirmation.
La possibilité de réduire les causes possibles de l'échec d'essai avant de nouveaux tests peuvent aider un enquêteur économiser du temps et des matériaux. Les aspects critiques de la MFIA doit être confirmée avant de répéter un échantillon échoué. Depuis le dosage est effectué à la température ambiante, il convient de vérifier que la température du laboratoire est d'environ 27 ° C ± 2 ° C, des températures plus élevées peut entraîner une baisse de scores attendus pour les contrôles et les échantillons. Laver est peut-être l'étape la plus critique dans l'analyse. Assurer que la plaque d'essai est bien lavé, effacé et remis en suspension peut éliminerla grande majorité des erreurs d'échantillonnage dues à talon faible numération (en raison de perles agrégées) ou l'ajout de réactif insuffisante (perte par effet de mèche sur fond de plaque d'essai du filtre). Nous avons régulièrement compte 25 perles par dosage (agent) et n'ont trouvé aucune différence statistique dans les résultats en comptant plus grand nombre de billes qui aboutira également à un plus long temps de lecture de la plaque.
Nous avons effectué des études de validation complets de MFIA sur plusieurs espèces d'animaux de laboratoire couramment utilisés (souris, rat, hamster, cochon Guinée et le lapin) pour démontrer la précision du diagnostic, la reproductibilité et la robustesse de tester un grand nombre de positifs et négatifs connus des échantillons de sérum et comparant leur ELISA, IFI et les résultats MFIA. Les limites de détection (c.-à-immunes critères d'évaluation standards de titrage du sérum) de MFIA étaient comparables, et dans certains cas dépassé, ceux de correspondant ELISA. La spécificité diagnostique, mesurée avec des rongeurs SPF sérums, a dépassé les 99%, le betwee correspondance globalen ELISA et MFIA effectuée sur sérums négatifs connus positive et connue était supérieure à 95%. En résumé, ces résultats ont prouvé que MFIA multiplex est un autre bon test ELISA singleplex, et est adapté à l'usage, c'est à dire prévu dans la surveillance sérologique de routine des colonies d'animaux de laboratoire.
Déclarations de divulgation
Tous les auteurs travaillent pour Charles River RADS, un important fournisseur de services animaliers tests sérologiques et des réactifs.
Remerciements
La recherche présentée ici a été soutenu par Charles River.
Références
- MFIA Rodent Methods Manual [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA Rodent_Methods_Manual.pdf (2011).
- Rodent MFIA Validation Summary Report [Internet]. , Charles River. Available from: http://www.criver.com/SiteCollectionDocuments/rm_ld_r_MFIA _summary_report.pdf (2007).
- Jacobson, R. H., et al. Principles of validation of diagnostic assays for infectious diseases. Manual of Standards for Diagnostic Tests and Vaccines. , Office International des Epizooties (OIE). France. 8-15 (1996).
- Wright, P. F. International standards for test methods and reference sera for diagnostic tests for antibody detection. Rev. sci. tech. Off. int. Epiz. 17 (2), Office International des Epizooties (OIE). France. 527-533 (1998).
- Pepe, M. S. The Statistical Evaluation of Medical Tests for Classification and Prediction. , Oxford University Press. Oxford, New York. (2003).
- Barr, M. C., et al. Comparison and interpretation of diagnostic tests for feline immunodeficiency virus infection. J. Am. Vet. Med. Assoc. 199, 1377-1381 (1991).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon