Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Perfusión retrógrada y llenado de la vasculatura coronaria del ratón, como preparación para la Micro tomografía computarizada
En este artículo
Resumen
La visualización de los vasos coronarios es fundamental para avanzar en nuestra comprensión de las enfermedades cardiovasculares. Aquí se describe un método para la perfusión vascular coronaria murino con una goma de silicona radiopaco (Microfil), en preparación para la micro-tomografía axial computerizada (μCT) de imágenes.
Resumen
La visualización de la vasculatura se está convirtiendo cada vez más importante para la comprensión de muchos estados patológicos diferentes. Si bien existen varias técnicas para obtener imágenes de la vasculatura, pocos son capaces de visualizar la red vascular en su conjunto, mientras que se extiende a una resolución que incluye el 1,2 vasos más pequeños. Además, muchas de las técnicas de colada vasculares destruir el tejido circundante, evitando su posterior análisis de la muestra 3-5. Un método que evita estos problemas es de micro-tomografía axial computerizada (μCT). μCT imagen puede escanear a resoluciones menores de 10 micras, es capaz de producir reconstrucciones en 3D de la red vascular, y deja el tejido intacto para su posterior análisis (por ejemplo, histología y morfometría) 11.06. Sin embargo, los vasos de imágenes ex vivo por métodos μCT requiere que los vasos se llena con un compuesto radiopaco. Como tal, la representación exacta de la vasculatura producido por μCT imagen dependellenado fiable y completa de los vasos. En este protocolo, se describe una técnica para el llenado de los vasos coronarios del ratón en la preparación de imágenes μCT.
Dos técnicas que predominan existen para el llenado de los vasos coronarios: en vivo a través de la perfusión de la canalización y retrógrado de la aorta (o una rama del arco aórtico) 12-14, o ex vivo a través de un sistema de perfusión Langendorff 15-17. A continuación se describe un método in vivo canulación aórtica, que ha sido específicamente diseñado para garantizar el llenado de todos los buques. Nosotros utilizamos un compuesto viscosidad baja radiopaco llamado Microfil que puede perfundir a través de los vasos más pequeños para llenar todos los capilares, así como los dos lados arteriales y venosas de la red vascular. Los buques son perfundidos con buffer usando un sistema de perfusión a presión, y se rellena con Microfil. Para asegurarse de que Microfil llena los pequeños vasos de resistencia más altos, que ligan las ramas grandes emanating de la aorta, que desvía el Microfil en las coronarias. Una vez finalizado el llenado, para evitar que la naturaleza elástica del tejido cardíaco de exprimir Microfil cabo de algunos vasos, que ligar accesibles los puntos importantes de salida vasculares inmediatamente después del llenado. Por lo tanto, nuestra técnica está optimizado para el llenado completo y la retención máxima del agente de carga, lo que permite la visualización completa de la red vascular coronaria - arterias, capilares y venas por igual.
Protocolo
1. Los preparativos antes de iniciar
- Llenar cada lado del aparato de presión de perfusión con tampón Vasodilatador (4 mg / l papaverina + 1g / l adenosina en PBS) o 4% de paraformaldehído (PFA) en PBS, respectivamente.
- Preparar una jeringa de insulina 1/2cc (con un 29G conectado permanentemente ½ "aguja) llenándolo con 0,1 ml de heparina 1:100 (stock 5000U/ml) y doblar la aguja a un ángulo de 120 grados ~ con el bisel hacia arriba. Haga lo misma con una jeringa de 1 ml (con un 26G ½ "aguja) llena con 0,3 ml de solución saturada de KCl.
2. Exponiendo el corazón y la canulación de la aorta
- Se anestesia el ratón usando el anestésico de elección. (Usamos una sobredosis de una mezcla de ketamina / xilazina. Inyección IP de 130 mg / kg de ketamina y 8,8 mg / kg de xilazina en solución salina)
- Pin del ratón anestesiado en la bandeja de disección, hasta la parte ventral. Abrir la cavidad abdominal con una incisión central y retraer la pielpara exponer los órganos. Mover los intestinos a un lado para exponer una región de la vena cava posterior (PVC).
- Inyectar solución de heparina en el PVC. Como se extrae la aguja, cubra el orificio de la aguja con un aplicador con punta de algodón para evitar fugas y mantenerla durante unos segundos hasta que los coágulos de PVC de pared y sellos. Esperar 2-3 minutos para heparina para dispersar a lo largo de la circulación del ratón.
- Diseccionar el diafragma y la caja torácica por lo que se puede observar el corazón latiendo. Inyecte lentamente solución de KCl en el PVC hasta las detenciones del corazón.
- Retire todos los órganos están debajo del diafragma y los impuestos especiales la parte posterior del ratón, dejando a la región anterior de la membrana intacta. Retire el diafragma, teniendo cuidado de cortar el PVC cerca del diafragma por lo que la porción proximal del corazón es fácil de localizar en los siguientes pasos.
- Localice el extremo del corte de la aorta. Coloque un pedazo largo de 6-0 sutura de seda trenzada por debajo de la aorta de un lado a otro pocos milímetros anterioresm del extremo cortado de tal manera que la sutura se dobla hacia atrás sobre sí mismo. Cortar esta sutura ya a la mitad por lo que hay 2 piezas de sutura en la aorta. Insertar el angiocatéter en el extremo cortado de la aorta (Fig. 1A, B) y atar cada sutura con un nudo doble para sujetar el angiocatéter en su lugar y evitar cualquier contrapresión dentro de la aorta se escape.
3. La perfusión e inyección Microfil
- Conectar el angiocatéter al aparato de la presión de perfusión (Fig. 2) y comenzar la perfusión de los vasos con tampón vasodilatador (Fig. 1C) bombeando el aparato de perfusión a una presión de conducción de 100-110 mm Hg. Compruebe que el buffer se perfunde a través de las arterias coronarias, garantizando el líquido se sale de la PVC. Continuar a perfundir durante al menos 3 minutos o hasta que el fluido que sale del PVC es clara. (Continúe con los pasos a seguir, mientras que la perfusión).
- Disección de las costillas y la espalda pin (o eliminar) la caja torácica para exponer el corazón. Una vez expuesto, ser careful no dejar que el corazón se secan apretando gotas de tampón en el corazón de una pieza tampón empapado de gasa. Despeja el timo para exponer el arco aórtico. Ligar las tres ramas principales de aorta con sutura de seda trenzada 6-0 para asegurar el líquido se desvía a través de las arterias coronarias, más que a través de estos vasos más grandes, de baja resistencia (Fig. 1D).
- La perfusión del corazón con el fijador durante 15 minutos, luego enjuague con tampón vasodilatación por lo menos 2 minutos. Mientras tanto, ligar, tanto anterior vena cava para evitar que se escape Microfil del corazón después de la inyección (Fig. 1E). Coloque las suturas alrededor de la PVC y la aorta, pero no los apriete hasta después del llenado.
- Preparar el Microfil (como se especifica en la tabla de reactivos) y cargarlo en una jeringa de 1 ml. Llenar la bandeja de disección con agua suficiente para cubrir el catéter (así como para prevenir la introducción de burbujas de aire cuando se cambia de un tubo de perfusión a la jeringa Microfil). Desconecte la perfusión APParatus del catéter y conectar la jeringa Microfil preparada.
- Se inyecta la Microfil en la aorta hasta buen llenado de las arterias coronarias es evidente (Figuras 1F, 3A): las arterias se llenan primero, y luego el Microfil se "derrame" en los capilares como los sofocos tejido con el color de la Microfil. Una vez en el lado venoso, la naturaleza hidrófoba de la Microfil es para que aparezca inicialmente como esferas independientes como se desprende de los vasos más pequeños. Continuar para inyectar el Microfil hasta una columna continua llena las venas. Llenado completo será evidente cuando el Microfil es continua dentro de los vasos, y se sale a través del PVC.
- Después de llenar es completa, rápidamente apretar las suturas que se colocaron previamente alrededor del PVC y la aorta para prevenir la naturaleza elástica del tejido cardíaco de apretar el Microfil fuera de los vasos.
- Cubra el corazón con una gasa húmeda (empapado con agua de la bandeja de disección) Para evitar su desecación, y dejar que repose durante aproximadamente 1 hora a temperatura ambiente hasta que el Microfil ha polimerizado. Evitar cualquier tipo de presiones externas sobre el corazón durante el proceso de polimerización, como levantar o girar el corazón en un intento de obtener una visión temprana de los vasos llenos en la parte posterior del corazón. Esto puede exprimir Microfil de algunos buques en una zona más elástica del corazón, causando interrupciones en la Microfil.
- Quitar el corazón y post-fijar en PFA al 4% durante toda la noche a 4 ° C. A continuación, almacenar en el 70% de etanol a 4 ° C. La vasculatura del corazón ya está listo para obtener imágenes de μCT.
4. Los resultados representativos
Los buques que estén efectivamente perfundidos por Microfil tendrá Microfil continua, ininterrumpida a lo largo de los vasos (Fig. 3). El grado de llenado de los vasos coronarios se puede juzgar por ojo; venas se encuentra epicárdica 18, y puede ser fácilmente observado (Fig. 3A, punta de flecha); arterias,que son más intramiocárdica 18, también son visibles a través de la superficie del corazón (Fig. 3A, flecha). Llenado capilar es también evidente, como tejido cardíaco tiene una densidad muy alta de los capilares, y por lo tanto, cuando el relleno capilares, el tejido cardíaco se lave con el color de la Microfil (Fig. 3A, en estrella). Así, cualquier red vascular que fallaron en llenar será notable debido a la falta de Microfil (Fig. 3B, C).
Las discontinuidades en el Microfil (asteriscos en la Fig. 3B) aparecen a menudo debido a la naturaleza hidrofóbica de la Microfil hará que se contraiga en sí mismo y hacer que "rompe" dentro de los vasos llenos. Estos "descansos" se puede reducir si la presión dentro de los vasos se mantiene a través adecuada como tie-offs de los puntos de salida vasculares del corazón. Otras discontinuidades pueden ser causados por las burbujas de aire dentro de la Microfil. Para evitar la introducción de aire, asegúrese de que el angiocatéter está totalmente sumergido en el agua cuando se pasa de la perfusión AP Paratus a la jeringa Microfil. Si una burbuja de aire se introduce, a menudo puede ser eliminado simplemente al continuar la perfusión Microfil hasta que la burbuja se ha empujado a través y fuera de los vasos coronarios.
Redes vasculares no puede llenar completamente si una porción del lecho vascular está bloqueado (Fig. 3B, flecha). Mientras que la heparina inhibe la formación de coágulos de sangre, los bloqueos ocasionales pueden producirse debido a la perfusión de heparina incompleta antes de comenzar el procedimiento, o debido a otros factores desconocidos. Si ocurre un bloqueo, no hay, hasta donde sabemos, ningún método para desalojar el bloqueo para completar el relleno vascular. Llenado incompleto también puede resultar si la presión se usa demasiado poco durante el llenado, como el Microfil no se verán obligados a todos los lechos vasculares y redes capilares (Fig. 3C). Por el contrario, la presión excesiva puede provocar que los capilares se rompen y extravasación Microfil en el tejido circundante (Fig. 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" Figura 1 "/>
Figura 1. Descripción general del sistema de perfusión Microfil. (A) La aorta y el PVC se cortan aproximadamente al nivel del diafragma. (B) La aorta ascendente se canula con un angiocatéter. (C) La vasodilatación de amortiguación se perfunde a través de los vasos, impulsados por el aparato de presión de perfusión (no se muestra), mientras que (D) las tres ramas principales fuera del arco aórtico se ligan. (S) 4% PFA se perfunde a través de las arterias coronarias, mientras tanto anterior venas cavas se ligan. (F) Utilizando una jeringa, Microfil se perfunde a través de las coronarias hasta que se observa que sale del PVC.
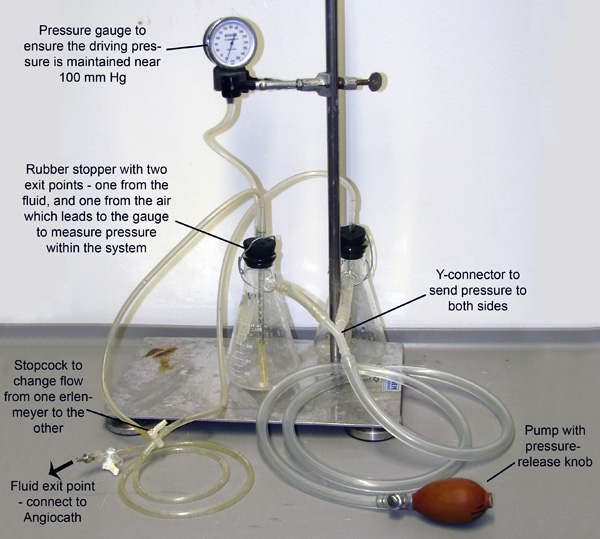
Figura 2. Aparato de perfusión. Dos matraces Erlenmeyer, cada uno lleno con tampón Vasodilatación cualquiera o 4% PFA, se unen y se presuriza a través de tubos conectados a sus brazos laterales. El sistema está presurizado a través de bombeo manual delbombilla, y un manómetro de presión está conectado a uno de los matraces para permitir la supervisión y mantenimiento de la presión. Pequeños tubos se extienden a través de tapones de caucho y hacia abajo en el líquido en cada matraz. La presión que entra desde las bombas de armas blancas el líquido de cada matraz a cabo estos tubos más pequeños. Los tubos entonces se fusionan en una llave de paso que sólo permite que el líquido fluya desde un matraz al mismo tiempo.
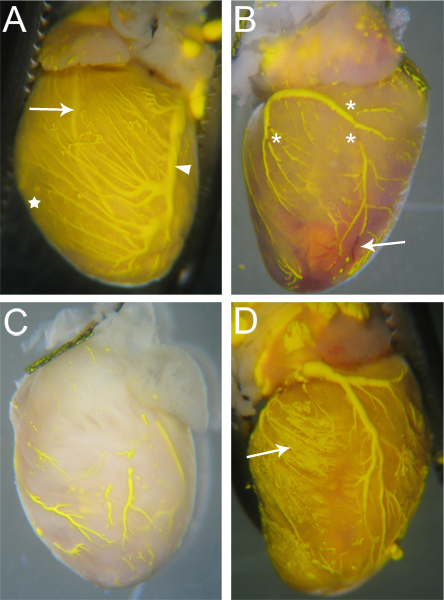
Figura 3. Muestra corazones microrrellenos. (A) Los buques que se llenan y se tienen pocos (si alguno) se rompe en el Microfil, y el tejido del corazón se teñirá del color de la Microfil debido a la llena de capilares (estrella, y comparar con C). Ambas arterias (flecha - Izquierda arteria descendente anterior) y venas (punta de flecha - vena coronaria izquierda) son visibles a través de la superficie del corazón. (B) Un corazón con cortes en el Microfil (asteriscos), así como bloqueos en algunos barcos que impedía micrófono completaRofil penetración. Los vasos bloqueados permanecen rojo (flecha), como la sangre no se barrió a cabo durante el proceso de perfusión. (C) Un corazón con las embarcaciones que se llenaron completamente. Tenga en cuenta que el tejido no se ha tomado el color amarillo de la Microfil, indicando el Microfil no penetran en los capilares. (D) Un corazón donde la rotura de capilares, durante el llenado, haciendo que el Microfil a la fuga en el tejido circundante (flecha).
Discusión
Tejido cardíaco tiene una demanda metabólica muy alta, y por tanto requiere un suministro constante de nutrientes y el oxígeno de la sangre entregada por la vasculatura coronaria. Las enfermedades de los vasos coronarios, los cuales disminuyen la función coronaria debido a la estenosis del vaso y el bloqueo, puede llevar a la hipoxia tisular y la isquemia, y poner a los pacientes afectados por el riesgo de infarto de miocardio y un daño irreparable al músculo del corazón. Una mejor comprensión del estado de enfe...
Divulgaciones
Los ratones han sido manipulados con métodos aprobados por el Cuidado de Animales institucional y el empleo de la Universidad de Washington y de acuerdo con la Guía para el Cuidado y Uso de Animales de Laboratorio publicada por los EE.UU. Institutos Nacionales de Salud (NIH Publication No. 85-23, revisada en 1996).
Agradecimientos
Agradecemos al Dr. Kelly Stevens para las pruebas iniciales del protocolo, el Dr. Michael Simons, Hauch Dr. Kip, y los miembros de sus dos laboratorios para la discusión general.
Este trabajo es el apoyo de subvenciones del NIH HL087513 y HL094374 P01.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| 1 ml jeringas | Becton Dickinson | BD-309602 | |
| 1/2cc jeringas para insulina con agujas 29G ½ conectado permanentemente ' | Becton Dickinson | BD-309306 | |
| 2 "x 2" Almohadillas de gasa | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath IV del catéter | Becton Dickinson | BD-381112 | |
| 26G ½ "agujas de calibre | lacio "> Becton Dickinson | BD-305111 | |
| La adenosina | Sigma | A9251 | 1 g / l en PBS durante Buffer vasodilatación (con papaverina) |
| Pinzas angulares Graefe | Herramientas de Bellas Ciencia | 11052-10 | |
| De algodón con punta de aplicadores: 6 "no estéril | Cardinal Health | C15055-006 | |
| Curvas Tijeras quirúrgicas | Herramientas de Bellas Ciencia | 14085-09 | |
| Estereoscopio de disección y la fuente de luz | Nikon | NA | NA |
| Bandeja de disección, 11.5 x 7.5 pulgadas | Cole-Parmer | YO-10915-12 | Lleno de alquitrán para la fijación abajo el ratón |
| Bellas pinzas curvas | Aesculap | FD281R | Necesitas dos |
| La heparina, 5.000 U / ml de caldo | APP Pharmaceuticals LLC | NDC 63323-047-10 | 1:100 dilución en agua |
| KCl | Pescador | P217 | Solución saturada en H2O |
| Ketamina (Ketaset), 100 mg / ml de stock | Fort Dodge, de Overland Park, KS, EE.UU. | NDC 0856-2013-01 | Mezclado como el peso corporal 130 mg / kg, con xilacina en s 0,9%aline |
| Microfil | Flujo Tech | MV-122 (amarillo). Otras opciones de color están también disponibles. | Mezclar 1:1 en peso, con 10% en volumen de agente de curado. Prepararse inmediatamente antes de la inyección, y agitar para asegurar que esté bien mezclado |
| No estériles de sutura: 6-0, trenzado de seda | Aparato de Harvard | 723287 | |
| Papaverina | América Regent Inc. | NDC 0517-4010-01 | 4 mg / l en PBS durante Buffer vasodilatación (con adenosina) |
| Paraformaldehído | Sigma | P6148 | Preparado como solución al 4% |
| Aparato de perfusión | Ver figura 2 | ||
| Tijeras de primavera | Herramientas de Bellas Ciencia | 15018-10 | |
| Xilazina (Anased), 20 mg / dL de valores | Lloyd Labs | NADA # 139-236 | Mezclado como el peso corporal 8,8 mg / kg, con ketamina en 0,9% de solución salina |
Referencias
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados